文冠果果壳提取物对植物病原菌的抑菌活性
2020-03-04王志玲张家兴王晓瞳杨秀云谷晓杰闫冬佳曹挥
王志玲,张家兴,王晓瞳,杨秀云,谷晓杰,闫冬佳,曹挥*
(1.山西农业大学 林学院,北方功能油料树种培育与研发山西省重点实验室,山西 太谷 030801;2.山西农业大学 农学院,山西 太谷 030801)
文冠果(XanthocerassorbifoliumBunge)是无患子科文冠果属植物,原产于我国黄土高原地区,目前主要分布在内蒙、陕西、山西、河北、甘肃等地[1]。文冠果果实包括果壳和种子2部分,果壳约占果实总重的50%[2]。文冠果果壳具有多种生物活性,如抗阿尔茨海默病[3]、抗肿瘤[4]、改善学习记忆障碍等[5]。也有研究指出文冠果果壳可作为牛羊的饲养材料[6]或新型的高密度聚乙烯复合材料[7]。另外文冠果果壳提取物对一些人体致病菌,如肺炎克雷伯菌、大肠杆菌、绿脓杆菌、金黄色葡萄球菌均有不同程度的抑制活性[8,9]。前人报道,次生代谢产物单宁[10]、类黄酮[11]、皂苷[12]等成分是提取物产生抑菌活性的主要原因。
文冠果种子含油率达35%~40%,是一种良好的生物柴油原料。随着全球能源危机和环境污染问题的日益严重,国家林业局早在本世纪初已开展文冠果种子制备生物柴油的研究和推广工作[13]。目前我国北方地区已发展文冠果十万余亩,按照中石油生产生物柴油标准,小规模标准厂房年消耗文冠果种子约30万t,同时会产生30万t果壳[13]。如何有效利用文冠果果壳这一重要资源、是我们面临的一个重要问题。
苹果轮纹病菌(Botryosphaeriadothidea)[14]、葡萄圆斑根腐病菌(Fusariumoxysporum)[15]、山核桃根腐病菌(Fusariumspp.)[16]、番茄枯萎病菌(Fusariumoxysporumf.sp.lycopersici)[17]、番茄灰霉病菌(Botrytiscinerea)[18]、梨黑斑病菌(Alternariaalternata)[19]是果蔬上的重要病害,显著影响了我省苹果、葡萄、梨、番茄等经济果蔬的产量和质量,发病严重时造成了全部植株的死亡。现阶段对这些病害的防治措施主要是喷洒化学农药,但大量使用化学农药会造成严重的食品农药超标及环境污染。由于植物源农药对生态环境比较安全、对非靶标生物影响较小、原材料来源广泛等特点,在病虫害的防治过程中备受关注。文冠果果壳富含生物活性物质,但大量果壳作为废弃物处理、未得到充分应用。因此本文拟对果壳提取物进行初步的成分分析和抗植物病原菌活性试验,以期为文冠果果壳做杀菌剂的研究提供科学依据。
1 材料与方法
1.1 供试材料
1.1.1 植物材料
文冠果果壳购自山西忻州市河曲县晋野草药,经咨询采自忻州东部黄土丘陵区,为当地野生文冠果品种,含水量<5%。
1.1.2 供试菌种
苹果轮纹病菌(B.berengeriana)、葡萄圆斑根腐病菌(F.oxysporum)、山核桃根腐病菌(Fusariumspp.)、番茄枯萎病菌(F.oxysporumf.sp.lycopersici)、番茄灰霉病菌(B.cinerea)和梨黑斑病菌(A.alternata)由山西农业大学植物病理实验室提供。
1.1.3 药品与试剂
药品:人参皂苷Rb1(Ginsenoside Rb1,HPLC>98%,成都植标化纯生物技术有限公司)。
试剂:单宁、总酚、类黄酮检测试剂盒/测试方法(上海信帆生物科技有限公司)。乙醇/水(75%±5%,批号:170302,河北康济药械有限公司)、石油醚(分析纯,天津市北辰方正试剂场)、乙酸乙酯(分析纯,天津市凯通化学试剂有限公司)、甲醇(分析纯,天津市天力化学试剂有限公司)、高氯酸(优级纯,天津政成化学制品有限公司)。
1.1.4 供试培养基
本试验采用马铃薯葡萄糖琼脂培养基(PDA)[20]:将马铃薯洗净去皮,称取200 g马铃薯切块放入锅中加水1 000 mL煮20~30 min,以4层纱布过滤后,加入20 g葡萄糖及20 g琼脂粉摇匀冷却后,补加至 1 000 mL,三角瓶分装后,塞上棉塞以报纸包裹瓶口放入灭菌锅灭菌,冷却至室温保存备用。
1.2 主要仪器设备
仪器设备:粉碎机(上海垒固仪器有限公司)、BSA224S-CW电子天平(赛多利斯科学仪器(北京)有限公司)、DL-400循环冷却器(郑州长城科中贸有限公司)、RE-52旋转蒸发器(上海亚荣生化仪器厂)、SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂)、超声波清洗仪(上海亚荣生化仪器厂)、721G可见分光光度计(上海仪电分析仪器有限公司)、Eppendorf生物光谱计、水浴锅(天津市泰斯特仪器有限公司)、超净工作台(北京东联哈尔仪器制造有限责任公司)、灭菌锅(江阴滨江医疗设备有限公司)、恒温培养箱(哈尔滨市东联电子技术开发有限公司)。
1.3 试验方法
1.3.1 文冠果果壳不同提取物的制备
将文冠果果壳通过粉碎机磨至粉末(200目),取60 g粉末于1 000 mL三角瓶中,加入420 mL 75%乙醇-水溶液(以下简称为75%乙醇或乙醇),封膜后放于超声波清洗仪中萃取30 min,得到萃取液后,于滤渣中再次加入420 mL 75%乙醇重复萃取30 min,将2次萃取液混合并通过旋转蒸发仪浓缩,蒸干即得到文冠果果壳的乙醇提取物,4 ℃储存备用。
采用相似的方法,取60 g粉末于1 000 mL三角瓶中,加入500 mL乙酸乙酯或石油醚,做3组重复,每组按上述方法萃取2次后,3组萃取液混合浓缩后蒸干,得到乙酸乙酯及石油醚提取物,4 ℃储存备用。
1.3.2 不同提取物中单宁、总酚、类黄酮以及皂苷含量检测
1.3.2.1 单宁含量测定及计算[21,22]
称取0.1 g提取物,加入1 mL蒸馏水,充分匀浆后转移至2 mL离心管中,80 ℃水浴提取30 min,于25 ℃离心10 min后(RCF=8 000×g),取上清液待测。具体检测方法如下:将磷钼酸溶液、氢氧化钠溶液在37 ℃预热10 min,取2支试管分别标记为对照管和测定管,对照管中加入1 330 μL蒸馏水、350 μL磷钼酸溶液;测定管中加入30 μL待测液样本、1 300 μL蒸馏水和350 μL磷钼酸溶液。分别静置5 min后,向2试管中加入320 μL的氢氧化钠溶液。由于单宁在碱性环境下与磷钼酸反应,生成蓝色化合物,可运用可见分光光度法(760 nm)测定其吸光值。
标准条件下测定的回归方程为y=0.008x-0.002 1;x为标准品单宁酸的浓度(mg·L-1),y为吸光值。
单宁含量(mg·g-1)=(C×V)/(W×1000);C为根据标准曲线求得的测定管单宁酸含量(mg·L-1), V为单宁粗提液总体积(2 mL),W为提取物质量(0.1 g)。
1.3.2.2 总酚含量测定及计算[23]
称取0.25 g提取物与10 mL离心管中,加入甲醇-盐酸缓冲液至8 mL。4 ℃下避光静置20 min,期间摇动2~3次,然后过滤至离心管中,滤液即为总酚粗提液。吸取2 mL总酚粗提液待测。具体检测方法如下:分别吸取没食子酸标准溶液0.1、0.2、0.3、0.4、0.5、1.0 mL于试管中,加蒸馏水至1 mL,配置成0.1、0.2、0.3、0.4、0.5、1.0 g·L-1的系列总酚标准溶液。以甲醇-盐酸缓冲液作为空白对照调零,在280 nm下测定其吸光值。以同样方式测量样品中吸光值的大小,并通过标准曲线计算出粗提物的总酚含量。
标准条件下测定的回归方程为y=1.739 3x-0.040 2;x为标准品没食子酸的浓度/(g·L-1),y为吸光值。
总酚含量/(mg·g-1)=(C×V)/W;C为根据标准曲线求得的测定管没食子酸含量/(g·L-1), V为总酚粗提液总体积(8 mL),W为提取物质量(0.25 g)。
1.3.2.3 类黄酮含量测定及计算[24]
类黄酮的测定与总酚测定方法相似,以甲醇-盐酸缓冲液为对照进行调零,在325 nm处测定。标准条件下测定的回归方程为y=0.004 1x+0.035;x为标准品芦丁的浓度/(mg·L-1),y为吸光值。
类黄酮含量/(mg·g-1)=(C×V)/(W×1000);C为根据标准曲线求得的测定管芦丁的含量/(mg·L-1), V为总酚粗提液总体积(8 mL),W为提取物质量(0.25 g)。
1.3.2.4 皂苷含量的测定[25]
以人参皂苷作为标准品,甲醇作为溶剂,配置成0.312 g·L-1的标准溶液,取6只试管编号,分别吸取0.6、0.8、1.0、1.2、1.4、1.6 mL的标准溶液于试管中,另取1只试管加入1 mL甲醇溶液做空白对照,将7只试管100 ℃水浴加热,使甲醇烘干。而后加入10 mL高氯酸溶液,65 ℃水浴加热15 min,待反应结束后放入冰水中冷却,使其停止反应。将各试管溶液转移至比色皿中,以对照管调零,于321 nm处测量吸光值并绘制标准曲线。
标准曲线为y=2.437 3x+0.091 4;x为标准品人参皂苷的浓度(g·L-1),y为吸光值。
分别称取10 mg乙醇提取物、乙酸乙酯提取物、石油醚提取物于试管中,加入少量甲醇于烧杯中溶解后,转移至100 mL容量瓶中,洗涤烧杯3次并将洗涤液转移至容量瓶中,滴加溶液至刻度线后摇匀,对配置成的0.1 g·L-1的3种溶液进行测定并计算。
1.3.3 抑菌活性检测
利用二倍稀释法[26]将乙醇、乙酸乙酯和石油醚3种不同提取物配置成2 g·L-1的加药培养基,按1∶10的比例与培养基混合后,倒平板。采用生长速率测定法[20]进行抑菌活性检测:分别利用6 mm孔径的打孔器在菌丝生长旺盛的地方打取6种菌饼,接种至加药后的PDA平板中,在25 ℃下恒温培养,每种提取物重复3次,以无菌水作为空白对照。分别于24、48、72、96 h后测量每个菌落的直径,并根据以下公式计算出其抑制率。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.6)×100%
1.4 数据分析
采用Excel 2010和SPSS22.0对试验数据进行系统处理,采用单因素方差分析法(one-way ANOVA)对数据进行方差分析和差异显著性检验(α=0.05),采用逐步回归模型对抑菌活性以及提取物活性成分进行分析,并建立了回归方程。
2 结果与分析
2.1 各提取物成分分析
研究发现不同溶剂提取物中,单宁、总酚、类黄酮和皂苷含量各有所不同。除类黄酮含量在乙醇/水(75%)和乙酸乙酯提取物中没有显著差异外,其余成分含量均为乙醇/水(75%)提取物中最高,乙酸乙酯次之,而石油醚中最低。乙醇/水(75%)提取物中单宁、总酚、类黄酮和皂苷的含量分别是石油醚提取物的20、4、5和10倍(表1)。
2.2 不同提取物对致病菌的抑制活性
不同溶剂提取物对6种致病菌的抑制活性普遍表现为75%乙醇>乙酸乙酯>石油醚(图1)。在不同的处理时间,乙醇提取物的抑菌效果相对稳定,乙酸乙酯和石油醚提取物的抑菌效果在处理48 h后趋于稳定。24 h时,乙酸乙酯提取物对苹果轮纹病菌的抑制率为100%,大于75%乙醇,随着时间的推移,其抑制效果逐渐减弱,于96 h降到了50%;石油醚提取物在24 h时对苹果轮纹病菌的抑制率与75%乙醇无显著差异,之后大幅度降低(图1A)。乙酸乙酯提取物对葡萄根腐病菌的抑制率于24 h时为87%,与75%乙醇提取物无显著性差异,之后逐渐降低,于96 h后降到46%;石油醚提取物的抑制率最初为63%,之后大幅度降低,于96 h降低到27%(图1B)。乙酸乙酯提取物在24 h时对山核桃根腐病菌的抑制率与75%乙醇无显著差异,之后降低,于96 h后降到38%;24 h时,石油醚提取物的抑制率与75%乙醇无显著差异,后大幅度降低,于96 h后降至46%(图1C)。乙酸乙酯提取物在24 h时对番茄灰霉病菌的抑制率与75%的乙醇提取物相似,之后缓慢降低,于96 h后降到29%;24 h时,石油醚提取物对番茄灰霉病菌的抑制率为56%,在48 h时陡然下降至9%,之后逐步趋于稳定(图1D)。乙酸乙酯提取物在24 h时对番茄枯萎病菌的抑制率为50%,远低于75%乙醇提取物,之后逐渐降低,于96 h降到29%;石油醚提取物在24 h时的抑制率为0%,之后缓慢增加,经过小幅度增长与降低,于96 h后稳定到5%(图1E)。乙酸乙酯提取物在24 h时对梨黑斑病菌的抑制率为76%,与75%乙醇提取物没有显著差异,之后逐渐降低,于96 h后降到28%,石油醚提取物对梨黑斑病菌的抑制率抑制保持在较低水平(图1F)。
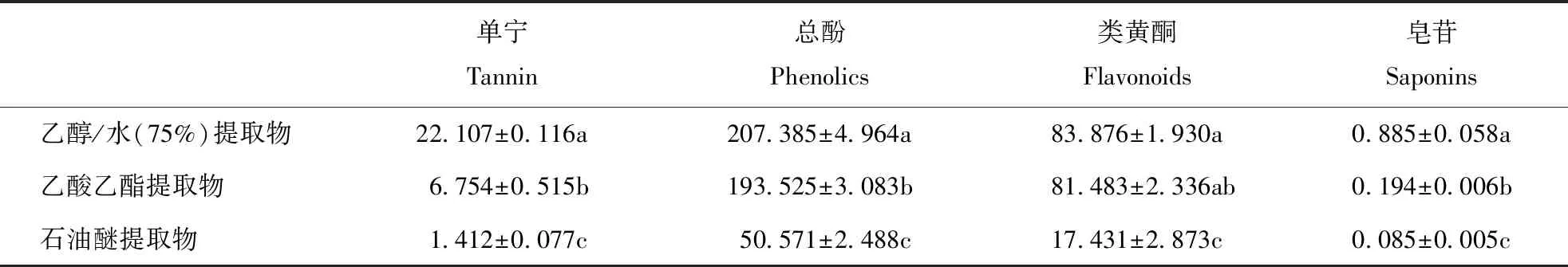
表1 不同溶剂提取物成分分析Table 1 Component analysis of different solvent extracts 单位:(mg·g-1)
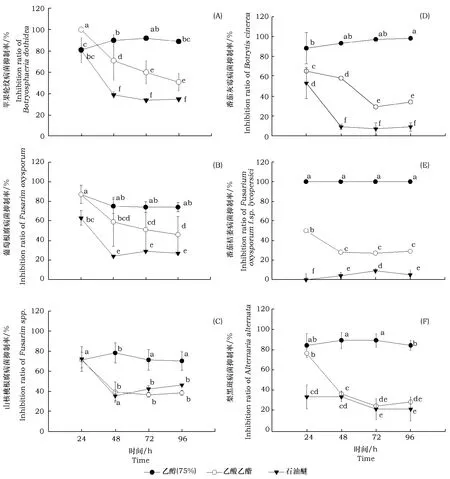
图中小写字母不同表示差异性显著(P<0.05)The different lowercase letters in the figure indicate significant difference(P<0.05)图1 文冠果果壳提取物对不同植物病原菌的抑制效果Fig.1 Inhibitory effect of Shells extracts from X. Sorbifolium on different plant pathogens
2.3 逐步回归分析
逐步回归分析总偏回归方程标准化系数(NC)的大小代表对应自变量影响力的强弱,标准化系数正负值分别代表自变量对因变量起到促进或抑制作用[27],P为拒绝原假设的值,P<0.05表示促进或抑制作用显著,P<0.01表示极显著。本文设48 h提取物对不同致病菌的抑制率为因变量,不同提取物中各活性组分的含量为自变量,通过逐步回归分析,剔除无关变量后得到以下回归方程(表2)。结果表明,影响苹果轮纹病菌的主导因素为单宁(NC=0.917,P<0.01)。类黄酮是葡萄根腐病菌的主导影响因子(NC=0.927,P<0.05);皂苷是山核桃根腐病菌(NC=0.940,P<0.01)和梨黑斑病菌(NC=0.945,P<0.05)的主导影响因子;番茄枯萎病菌的主导影响因子是单宁与总酚(NC=1.043,P<0.01);回归方程显示单宁也是番茄灰霉病菌的影响因子,但差异不显著(NC=0.995,P>0.05)。
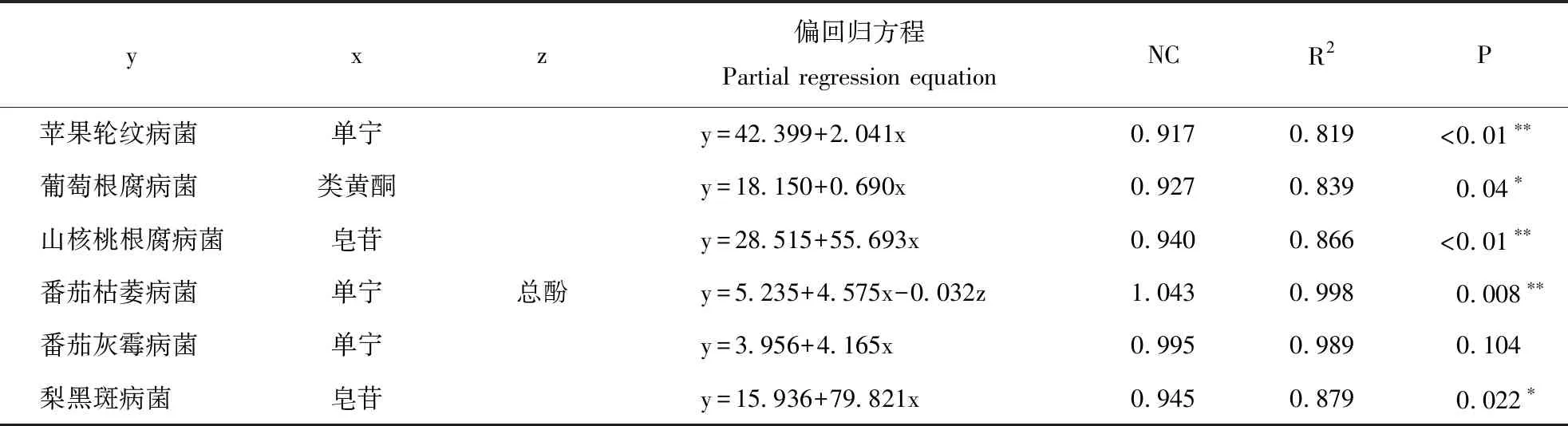
表2 逐步回归分析Table 2 Stepwise regression analysis
3 讨论与结论
本试验以文冠果果壳为研究材料,检测其活性成分及抑菌效果。结果表明乙醇提取物对总酚、单宁、类黄酮和皂苷的提取率均为最佳,并且对6种病原菌的抑制效果最好,最稳定。段苏珍等[28]测试了烟草乙醇提取物对4种细菌、11种真菌的抑制效果,发现乙醇溶液提取物对苹果炭疽、苹果腐烂病菌、番茄枯萎、棉花枯萎和黄瓜枯萎病菌抑制效果最佳。相对于其它有机溶剂,乙醇为相对安全、温和,在植物化学领域应用广泛。乙醇提取物对番茄枯萎病菌的抑制率达到了100%,对其它5种病原菌的抑制活性均大于80%,表现出良好的抑菌效果。杨苏苏等[29]人曾比较了20多种不同的植物提取物对番茄枯萎病菌的抑制效果,发现所选材料中只有丁香茎提取物对其抑制效果达到100%,与文冠果果壳提取物相似,因此文冠果果壳可作为研究番茄枯萎病菌抑制效果的良好原材料。
逐步回归分析结果表明,单宁为苹果轮纹病菌和番茄灰霉病菌的主导影响因子。单宁具有调节植物生长代谢和杀虫抑菌的作用[30],比如五倍子单宁提取物对绿脓假单胞菌、鼠伤寒杆菌、李斯特杆菌、白色念珠球菌、苹果青霉、耐热菌繁殖体、巨大芽孢杆菌均有显著的抑菌作用[31],目前已应用到杀菌剂的生产中[32]。皂苷是山核桃根腐病菌和梨黑斑病菌2种病菌的主导抑制因子,但并不意味着皂苷对其余4种植物病原菌没有效果,有可能是提取物中皂苷含量相对较低,还未能达到抑制相关病原菌的浓度。比如同为无患子科的无患子,其皂苷提取液对猕猴桃腐烂病菌、桉树溃疡病菌、欧美杨树溃疡病细菌均有较强的抑制活性[12]。
目前对文冠果果壳生物活性的筛选和评价大多停留在粗提物水平,对化学成分和生物活性结合的研究不多,活性物质与作用机制尚不清晰,在植物保护领域的报道相对较少。后续对文冠果果壳活性成分的提取、分离以及生物活性测试,能够验证此类成分的杀菌效果以及起作用的关键化合物,为开发以文冠果果壳为原料的植物杀菌剂的提供数据支撑。
