黄芩中FNSII-1与CHS-2真核表达载体的构建
2020-03-04咸珅王德富裴燕妮牛颜冰
咸珅,王德富,裴燕妮,牛颜冰*
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.山西农业大学 生命科学学院,山西 太谷 030801)
黄芩(ScutellariabaicalensisGeorgi)为唇形科(Labiatae)黄芩属多年生草本植物,具有清热燥湿、泻火解毒、安胎、止血等功效[1],是我国的传统中药材[2]。黄酮类化合物是黄芩中主要活性成分,其含量积累对疾病治疗疗效起着重要作用,主要包括黄芩苷(baicalin)、黄芩素(baicalein)等化合物[3,4]。近年来,对黄芩黄酮类化合物的研究不断深入,研究表明黄芩苷及黄芩素有抗菌、抗病毒、抗肿瘤、抗感染、抗HIV、抗氧化、清除氧自由基以及治疗心血管疾病等作用[5]。随着黄芩的药效价值被日益重视,临床上对黄芩药材的需求量也在逐年上升,导致其野生资源遭到严重破坏。目前,国内外对黄芩活性成分的研究则多集中于制备工艺、测定方法、生化特性及药理作用等[6~8],而对其生物合成的分子机理与代谢调控研究相对较少,通过传统的细胞工程技术,虽在一定程度上促进了黄芩苷的合成和积累,但其含量增幅尚不稳定[9]。研究表明黄芩活性成分的合成主要分为地上地下2种途径,通过对黄芩的根、茎、叶和花进行转录组测序和分析,从黄芩转录组中发现了5个与黄芩苷生物合成相关的关键酶候选基因,分别为PAL、C4H、4CL、CHS和FNS。研究明确了黄芩叶中黄酮生物合成途径的相关酶主要有苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)和4-香豆酸辅酶A连接酶(4CL)。3个丙二酰CoA和1个香豆酰CoA在查尔酮合成酶(CHS)的作用下生成查耳酮,接着查耳酮异构酶催化查耳酮形成黄烷酮或二氢黄酮,进而在黄酮合成酶I(FNSII-1)的催化下形成黄芩苷;黄芩根部黄酮生物合成途径主要由肉桂酸CoA经查尔酮合成酶II(CHS-2)合成并异构化,再由黄酮合成酶II(FNSII-2)生成黄芩素[10]。
本研究通过筛选叶中关键酶基因黄酮合成酶I(FNSII-1)与根中关键酶基因查尔酮合成酶II(CHS-2)为目的基因,通过Gateway重组技术将目的基因FNSII-1和CHS-2整合到目的载体pYES-dest52中,从而获得酵母表达载体pYES-dest52-FNSII-1、pYES-dest52-CHS-2的重组质粒[11]。进而将已构建的重组质粒转入酵母菌株中进行真核表达[12],从而获得高效表达工程菌,旨在为进一步的大规模生物转化试验提供足够底物,并为探索黄芩活性物质体外大规模合成途径的研究奠定基础[13]。
1 材料和方法
1.1 材料
黄芩植物材料采自山西农业大学生命科学学院实验基地,于-80 ℃低温冰箱保存备用。
本试验所用主要试剂及菌种:Transzol Up Plus RNA Kiit、Fastfu DNA Polymerase购自TransGen Biotech公司;Gateway Cloning Enzymes购自美国Thermo Fisher Scientific公司;Gel Extraction Kit、Plasmid Mini Kit购自Omega Bio-tek公司;酵母蛋白提取试剂盒购自华越洋生物科技有限公司;农杆菌菌株A4 由本试验室保存;酿酒酵母菌株INVSc1购自唯地生物技术有限公司;大肠杆菌DB3.1、DH5α感受态购自北京全式金生物技术有限公司;pYES-dest52质粒、pDONR221质粒由山西农业大学王文斌老师惠赠。
1.2 黄芩总RNA的提取
分别提取黄芩叶与根中的总RNA,具体步骤按照RNA提取试剂盒说明书进行。经NanoDrop核酸定量检测仪检测其纯度,琼脂糖凝胶电泳检测其完整性后,-80 ℃保存。
1.3 RT-PCR扩增及克隆
以提取的总RNA为模板,利用引物Oligo(dT)18将总RNA反转录为成第一链cDNA;参照NCBI收录的FNSII-1基因组序列(登录号:KT963453)、CHS-2基因组序列(登录号: KT963461),利用Primmer 5设计特异性引物,并在引物前后加上Gateway重组位点,分别对黄芩叶中FNSII-1序列和根中CHS-2基因组序列进行PCR扩增(表1)。本试验PCR使用高保真酶Fastfu DNA Polymerase(TransGen),反应体系具体如下:95 ℃ 2 min;94 ℃ 20 s,X ℃ 20 s,72 ℃ 2 min,35 cycles;72 ℃ 5 min;4 ℃ 保存。

表1 两个关键基因的PCR引物序列Table 1 two key genes sequence primers used for PCR
PCR产物经琼脂糖凝胶电泳检测鉴定大小后,采用OMEGA公司的Gel Extraction Kit回收,将PCR产物与pEASY-blunt Vector(TransGen)连接并转化至大肠杆菌DH5α(TransGen)中,通过菌液PCR挑选3个阳性克隆送至武汉金开瑞公司测序。利用在线软件NCBI将测序结果进行BLAST比对,去除多余的载体序列,保存获得黄芩中FNSII-1、CHS-2基因组序列。
1.4 FNSII-1、CHS-2真核表达载体的构建
本试验采用Gateway重组技术构建真核表达载体,将FNSII-1、CHS-2整合至目的载体pYES-dest52中,具体包括BP反应和LR反应[14]。利用BP反应将FNSII-1、CHS-2与载体pDONR221连接,获得入门载体pDONR221-FNSII-1、pDONR221-CHS-2。然后与表达载体pYES-dest52进行LR反应,产生重组表达质粒pYES-dest52-FNSII-1、pYES-dest52-CHS-2,具体操作为:于室温添加LR克隆反应体系:入门克隆产物100 ng,目的载体150 ng,加ddH2O至终体积8 μL于离心管;每管加2 μL的LR Clonase Ⅱ,轻轻混匀后于25 ℃孵育12 h;加1 μL Proteinase K于37 ℃孵育10 min。将测序正确的重组表达质粒转化至酿酒酵母INVSc1感受态细胞后均匀涂布于尿嘧啶缺陷的合成完全培养基SD-Ura固体培养基上,置于29 ℃培养箱中36~48 h,直至长出酵母单菌落。
1.5 重组载体的真核表达
挑取酵母单菌落作为模板,通过特异性引物进行菌液PCR,并将PCR筛选出的有目的片段的菌液送至武汉金凯瑞测序公司进行测序,通过SnapGene软件将测序结果与FNSII-1基因序列(登录号:KT963453)、CHS-2基因序列(登录号:KT963461)进行比对,从而筛选出酿酒酵母INVSc1阳性转化菌株。挑取阳性转化酵母菌株接种于50 mL含有2%葡萄糖和2%半乳糖的SD-Ura液体培养基中,29 ℃振荡培养,挑选出5个OD600值分别为0.5、0.8、1.0、1.2、1.5的酵母菌液进行蛋白表达。使用酵母提取试剂盒提取酵母蛋白,具体步骤参照说明书,并进行SDS-PAGE凝胶检测。
2 结果与分析
2.1 FNSII-1和CHS-2的体外扩增
以黄芩叶片和根组织所提RNA为模板,分别利用含Gateway重组位点的FNSII-1、CHS-2特异性引物进行克隆,获得与预期结果大小基本相符的目的片段,分别为1 491 bp和1 205 bp(图1);通过NCBI将所获序列进行Blast比对,结果显示所获FNSII-1、CHS-2序列与已上传的相应关键基因相似性高达99%。

A:FNSII-1电泳图; B:CHS-2电泳图。M:DL 2000TM DNA marker;1-3为目的条带;CK为空白对照A: Electrophoresis of FNSII-1 products; B: Electrophoresis of CHS-2 products. M: DL 2000TM DNA marker; Lane 1-3: target gene; CK: Blank control图1 两个关键基因扩增结果Fig.1 Amplification results of two key genes
2.2 pYES-dest52-FNSII-1和pYES-dest52-CHS-2重组载体的构建
利用Gateway重组技术,经BP、LR反应后,将目的基因FNSII-1和CHS-2分别连接到目的载体pYES-dest52上,获得重组载体pYES-dest52-FNSII-1和pYES-dest52-CHS-2。将重组表达载体转化至酿酒酵母INVSc1感受态细胞后,经测序获得目的序列,测序结果经Blast比对发现,2个基因与各自相应基因的相似性达到94.18%和91.77%。使用SnapGene软件将测序结果分别与NCBI已上传的FNSII-1基因序列(登录号:KT963453)、CHS-2基因序列(登录号:KT963461)进行对比,载体上两个关键基因的编码序列与预期一致,pYES-dest52-FNSII-1和pYES-dest52-CHS-2重组载体的构建成功(图2)。
2.3 FNSII-1和CHS-2的真核表达
将筛选出的阳性酵母菌株振荡培养诱导表达蛋白,收集OD600值分别为0.5、0.8、1.0、1.2、1.5的菌液,进行SDS-PAGE检测。2个关键蛋白在不同OD值下均有表达,其中FNSII-1的蛋白大小为57.36 kDa,,CHS-2的蛋白大小为42.9 kDa,与预期值相符,黄芩中FNSII-1与CHS-2真核表达载体的构建成功(图3)。
3 讨论与结论
黄芩为《中华人民共和国药典》(2015版)收录的正品,随着中药现代化的快速发展,黄芩中药用活性成分日渐受到重视,临床上对黄芩药材的需求量逐年上升导致其野生资源遭到严重破坏,黄芩已被列为国家三级濒危保护物种[15]。目前,国内外对黄芩黄酮类物质的研究多集中于提取和测定等方面,有关其合成的分子机制研究较少。已有相关文献指出黄芩活性成分的合成通路分为叶和根两部分,其中叶通路中黄酮合酶FNSII-1可催化二氢黄酮形成5,7-二羟黄酮,该化合物是黄芩中合成黄芩素及黄芩苷的重要前体,其含量直接影响黄芩中有效成分黄芩苷的储量。根通路中的查耳酮合成酶CHS-2能催化香豆酰CoA和丙二酸单酰CoA缩合产生查耳酮,该酶是在黄酮类化合物合成中起到限速作用的关键酶,也是高等植物中黄酮类化合物合成途径中的首个关键酶[16]。酵母表达系统作为真核表达系统,却具备像原核生物一样快速繁殖、易于培养的特点,所以在动物、植物、微生物的转基因功能鉴定研究中被广泛应用。而Gateway技术能够克隆一个或多个基因进入到任何蛋白表达系统,这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤,而且典型的克隆效率高达95%具有简单高效的优点。
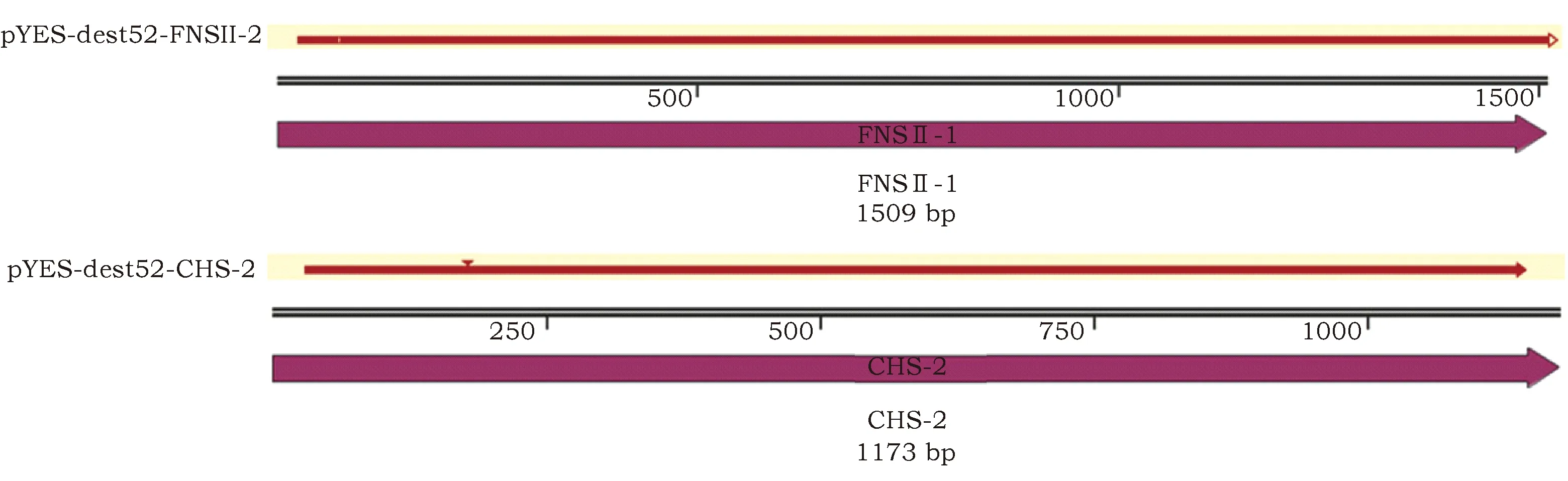
FNSII-1为pYES-dest52-FNSII-1重组载体中FNSII-1与KT963453比对结果;CHS-2为pYES-dest52-CHS-2重组载体中CHS-2与KT963461比对结果FNSII-1 is the result of the alignment of KT963453 and FNSII-1 in the pYES-dest52-FNSII-1 recombinant vector; CHS-2 is the result of the comparison of KT963461 and CHS-2 in the pYES-dest52-CHS-2 recombinant vector图2 重组载体中目的基因序列比对Fig.2 Sequence alignment of target genes in recombinant vector

图中的M为彩虹蛋白marker;1、2、3、4、5代表不同的OD600值,分别为0.5、0.8、1.0、1.2、1.5;CK为空白对照M in the figure is marker of rainbow protein; 1, 2, 3, 4 and 5 represent different OD600 value is 0.5, 0.8, 1.0, 1.2 and 1.5, respectively; CK is a blank control图3 2个关键酶基因的蛋白电泳图Fig.3 Protein electrophoresis of 2 key enzyme genes
本研究通过提取道地产区黄芩叶与根组织中总RNA,经RT-PCR获得目的基因FNSII-1和CHS-2,其序列长度分别为1 491 bp和1 205 bp;利用Gateway重组技术成功构建pYES-dest52-FNSII-1和pYES-dest52-CHS-2酵母表达载体。经SDS-PAGE检测表明2个表达载体在酵母菌液OD600值分别为0.5、0.8、1.0、1.2、1.5时均能获得目的大小蛋白且稳定表达,由于酵母在OD600值为0.8~1.0时活力最强,且随着OD值升高会伴随着菌丝出现,因此筛选出OD值为0.8~1.0时使酵母表达载体最适表达条件。本研究构建FNSII-1和CHS-2蛋白的酵母表达体系,通过分子手段对黄芩活性物质进行体外表达,从而为研究黄芩活性物质体外合成奠定基础。
