和胃反流康对胆汁反流性胃炎模型大鼠血清及胃黏膜组织白细胞介素6、白细胞介素8的含量及表达水平的影响※
2020-03-03汪楠李岩
汪 楠 李 岩
(辽宁中医药大学附属医院GCP办公室,辽宁 沈阳 110032)
胆汁反流性胃炎(bile reflux gastritis,BRG)是多种原因引起胃黏膜组织损伤的一种疾病,由十二指肠胃反流(duodenogastric reflux,DGR)现象异常增多导致[1],属消化内科常见疾病之一,其发生与幽门功能下降、胃窦清除能力降低、十二指肠动力异常等因素有关[2]。这些因素的存在既可增加DGR,又可延缓胃排空,延长胃黏膜与反流液的接触时间,从而加重胃黏膜损伤。目前,现代医学对BRG的治疗主要应用促胃动力药、胃黏膜保护剂及抑酸剂等,增加了耐药性及药物副作用的可能,不宜长期服用。大量临床实践表明,中药具有疗效高、靶点多、副作用小等优势,更有益于BRG的治疗。和胃反流康是我院脾胃病科多年临床观察筛选的效方,广泛用于治疗各类消化性疾病,如慢性非萎缩性胃炎、BRG、非溃疡性消化不良等,有疏肝利胆、益气健脾、和胃降逆功效,可明显缓解患者胃痛、胃胀、反酸、烧心、嘈杂等症状。炎症细胞因子在BRG的发生发展中起着至关重要的作用,在众多炎症细胞因子中,白细胞介素6(IL-6)、IL-8的作用表现尤为突出。本实验通过比较BRG模型大鼠血清及胃黏膜IL-6、IL-8的含量及表达水平变化,了解和胃反流康对胃黏膜炎性损害的改善,从而观察其对胃黏膜的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Wistar大鼠60只,雌雄各半,体质量(200±20)g,购自辽宁长生生物技术股份有限公司,动物合格证号:SCXK(辽)2010-0001。饲养于辽宁中医药大学实验动物中心SPF级动物室,常规颗粒饲料饲养,室温(20±2) ℃,相对湿度45%,12 h昼夜节律,自由食水。
1.1.2 实验药物及试剂 和胃反流康药物组成:柴胡15 g,陈皮10 g,白芍10 g,枳壳10 g,香附15 g,炒白术15 g,茯苓10 g,黄连6 g,蒲公英20 g,半夏10 g,甘草10 g。以上中药均购自辽宁中医药大学附属医院中药局,水煎浓缩,分别制成含量为5.46、2.73、 1.37 g生药/mL的高、中、低混悬液。多潘立酮片(西安杨森制药有限公司,国药准字H20093426),制成含量为0.278 mg/mL的混悬液。牛磺胆酸钠(北京博奥拓达科技有限公司);胰酶(美国Amresco公司);卵磷脂(美国Sigma公司);4%多聚甲醛溶液(南京森贝伽生物科技有限公司);10%水合氯醛溶液(上海联硕生物科技有限公司);IL-6、IL-8酶联免疫吸附(ELISA)试剂盒(武汉博士德生物工程有限公司);IL-6免疫组化试剂盒含试剂(武汉云克隆科技股份有限公司);IL-8免疫组化试剂盒含试剂(美国Sigma公司)。
1.1.3 实验仪器及设备 离心机(C4-12型,法国捷安公司);酶标仪(Antho2010型,奥地利安图公司);移液器(美国热电公司);水浴恒温振荡器(SHA-B型,常州国华仪器设备厂);全自动脱水机、包埋机、轮转式切片机、Q550CW图象采集和分析系统(德国Leica公司)。
1.2 方法
1.2.1 反流液配制 依据相关文献[3],将牛磺胆酸钠2.5 g、胰酶1.5 g、卵磷脂0.25 g溶于蒸馏水100 mL中配制成反流液。
1.2.2 动物分组 将60只Wistar大鼠按照随机数字法分为6组,即空白组、模型组、对照组及和胃反流康高、中、低剂量组,每组10只。
1.2.3 动物造模 除空白组外,其余各组大鼠用配制好的反流液灌胃造模,给药容积为15 mL/kg,每日1次,连续5周。
1.2.4 给药 各给药组自造模第2周开始至造模结束,每日造模结束6 h后灌胃给药,每日1次[4]。和胃反流康高、中、低剂量组分别予和胃反流康54.6、27.3、13.7 g生药/kg灌胃;对照组予多潘立酮片2.78 mg/kg灌胃;空白组、模型组予等容积蒸馏水灌胃。
1.3 取材及指标检测 (1)血清IL-6、IL-8含量检测。各组大鼠末次给药前1 d,禁食不禁水24 h,末次给药后,10%水合氯醛溶液腹腔注射麻醉,采集腹主动脉全血,常温下静置1 h后,于4 ℃、3 000 r/min离心15 min,取上清液,-20 ℃冻存,采用酶联免疫吸附(ELISA)法检测血清IL-6、IL-8含量。(2)采集完腹主动脉全血后,免疫组化法检测胃窦部胃黏膜组织IL-6、IL-8表达水平。每组随机取6只大鼠,无菌操作剖腹取胃,将胃内容物用冰0.9%氯化钠注射液漂洗干净,浸泡于4%多聚甲醛溶液中,4 ℃保存备用。常规制备石蜡切片,将固定好的胃窦组织取出,自来水下充分冲洗,冲洗后经全自动脱水机脱水;透明、浸蜡和包埋(包埋机上进行);轮转式切片机切片,脱蜡、水化,微波修复,血清封闭,分别加相应的一抗孵育,4 ℃过夜,加二抗后显色。选择染色良好的区域,封片。每只大鼠观察4张切片,每张切片选取5个互不重叠视野,显微镜下(40×10)观察IL-6、IL-8表达水平,阳性表达为棕黄色颗粒沉着。应用Q550CW图象采集和分析系统,测定单位面积阳性细胞表达的平均光密度值(AOD)作为其水平表达。

2 结 果
2.1 各组大鼠血清IL-6、IL-8含量比较 见表1。
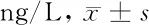
表1 各组大鼠血清IL-6、IL-8含量比较
由表1可见,模型组大鼠血清IL-6、IL-8水平均高于空白组(P<0.05);和胃反流康高、中、低剂量组及对照组大鼠血清IL-6、IL-8水平均低于模型组(P<0.05);和胃反流康高剂量组大鼠血清IL-6水平低于对照组(P<0.05),和胃反流康低剂量组大鼠血清IL-6水平高于对照组(P<0.05),和胃反流康中剂量组大鼠血清IL-6水平与对照组比较差异无统计学意义(P>0.05)。和胃反流康低剂量组大鼠血清IL-8水平高于对照组(P<0.05);和胃反流康高、中剂量组与对照组大鼠血清IL-8水平两两比较差异均无统计学意义(P>0.05)。
2.2 各组大鼠胃黏膜组织IL-6、IL-8 AOD比较 见表2。

表2 各组大鼠胃黏膜组织IL-6、IL-8 AOD比较
由表2可见,模型组大鼠胃黏膜组织IL-6、IL-8 AOD均高于空白组(P<0.05);和胃反流康高、中、低剂量组及对照组大鼠胃黏膜组织IL-6 AOD均低于模型组(P<0.05);和胃反流康高、中剂量组及对照组大鼠胃黏膜组织IL-8 AOD均低于模型组(P<0.05);和胃反流康高、中剂组及对照组大鼠胃黏膜组织IL-6、IL-8 AOD均低于和胃反流康低剂量组(P<0.05);和胃反流康高、中剂量组及对照组大鼠胃黏膜组织IL-6、IL-8 AOD两两比较差异均无统计学意义(P>0.05)。
2.3 各组大鼠胃黏膜组织IL-6表达免疫组化观察 各组大鼠胃黏膜组织的上皮细胞和浸润的炎症细胞均能表达IL-6,其中空白组大鼠胃黏膜组织细胞浆内未见明显棕黄色颗粒沉着;模型组大鼠胃黏膜组织细胞浆内可见大量棕黄色颗粒,细胞核亦可见棕黄色着色,提示IL-6表达水平较高;和胃反流康高、中、低剂量组及对照组大鼠胃黏膜组织细胞浆内虽有棕黄色颗粒沉着,但颜色浅、颗粒少,提示IL-6表达水平较低。见图1。

图1 各组大鼠胃黏膜组织IL-6表达(免疫组化染色,×400)
2.4 各组大鼠胃黏膜组织IL-8表达免疫组化观察 各组大鼠胃黏膜组织的上皮细胞和浸润的炎症细胞均能表达IL-8,其中空白组大鼠胃黏膜组织细胞浆内未见明显棕黄色颗粒沉着;模型组大鼠胃黏膜组织细胞浆内可见大量棕黄色颗粒,细胞核亦可见棕黄色着色,提示IL-8表达水平较高;和胃反流康高、中剂量组及对照组大鼠胃黏膜组织细胞浆内虽有棕黄色颗粒沉着,但颜色浅、颗粒少,提示IL-8表达水平较低;和胃反流康低剂量组在细胞膜、细胞浆及细胞外间质均可见较多棕黄色颗粒沉着,与和胃反流康高、中剂量组及对照组比较,黄棕色颗粒沉着范围较大,颜色较深,但与模型组比较,黄棕色颗粒沉着范围较小,颜色相对较浅,提示和胃反流康低剂量组IL-8表达水平高于和胃反流康高、中剂量组及对照组,低于模型组。见图2。
3 讨 论
BRG属中医学胃脘痛、胆瘅、嘈杂、呕吐等范畴,病位在胃,与肝、胆、脾功能失调密切相关,其病因主要包括外邪侵袭、饮食不节、情志失调、久病体虚等,基本病机为气机不利,胃失和降。气机不利日久,气郁而化火灼津,以致胃失和降,胆汁随胃气上逆,灼伤胃络,此为导致BRG发生的主要原因之一。常见临床表现有上腹部饱胀不适,胸骨后烧灼感及疼痛感,可与腹胀、嗳气、反酸、烧心、嘈杂、恶心等症状同时出现,本病病程较长,症状缓解困难且易复发,因此给患者身心造成极大的压力与痛苦[5]。随着消化内镜广泛应用于临床,BRG检出率也随之上升,约占同期胃镜检出率的22.6%~50.0%[6]。
在BRG形成过程中,胆汁酸是造成黏膜损伤的最主要因素,胰酶和溶血卵磷脂次之。胆汁酸是胆汁的主要成分,属亲脂性类固醇,其“皂化”特性极强,胃黏膜屏障也因此受损[7]。大量研究表明,长时间反流与胃黏膜活动性炎症、萎缩、肠上皮化生相关,尤其与幽门螺杆菌(Hp)感染同时存在时,胃黏膜肠上皮化生的可能性会大大增加[8-10]。炎性反应的发生发展过程中,炎症因子起着重要作用,其中IL-6、IL-8表现尤为突出。作为具有多种生物学活性的细胞因子,IL-6对于炎症、防御、肿瘤形成等免疫反应均有较强的调节功能。同时,作为重要介质,IL-6参与机体炎性反应和一系列病理生理过程,可诱导T淋巴细胞、B淋巴细胞分化,从而增强单核细胞及自然杀伤(NK)细胞的杀伤功能。在IL-6参与下,部分肿瘤坏死因子(TNF)如TNF-ɑ可诱导凝血酶形成,使上皮细胞表面由抗凝转为促凝,导致因微血栓形成而引起的胃黏膜血液循环障碍,从而大大削弱胃黏膜的防御修复机制[11]。目前已知,作为最强的多形核白细胞趋化和激活因子,IL-8主要生物学效应为刺激中性粒细胞向炎性组织聚集,诱导中性粒细胞的吞噬作用,使溶酶体酶的生物活性提高,并促进其释放,导致中性粒细胞呼吸爆发,生成活性氧代谢物,从而加剧局部组织炎症和溃疡[12]。此外,IL-8还可趋化其他白细胞亚类,如嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞等[13]。目前研究表明,IL-8可作用于多种细胞,加速炎性反应进程,促进有丝分裂,刺激血管形成,调节宿主免疫功能,在多种炎性反应性疾病、肿瘤及免疫相关疾病的起病过程中发挥重要作用[14]。研究认为,IL-8与胃黏膜损伤的严重程度及炎症分级具有一定相关性[15]。本实验采用BRG大鼠模型,进一步研究和胃反流康对炎症因子IL-6、IL-8含量及表达的影响,探讨其对胃黏膜组织损伤的修复和改善作用机制。实验结果表明,和胃反流康可降低大鼠胃黏膜组织中IL-6、IL-8含量(P<0.05),抑制IL-6、IL-8表达水平(P<0.05)。

图2 各组大鼠胃黏膜组织IL-8表达(免疫组化染色,×400)
综上所述,和胃反流康可显著减少BRG大鼠血清IL-6、IL-8含量,抑制胃黏膜组织IL-6、IL-8表达,减轻反流液对胃黏膜的炎性损害,有助于胃黏膜组织损伤的修复和改善,从而更好地保护胃黏膜,为其在临床上治疗BRG提供了现代药理学依据,为进一步扩大其临床适应证、加速其临床推广提供了实验依据。
