基于ddPCR技术分析EB病毒载量特征及与qPCR技术的比较研究
2020-03-02王心仪应斌武
王心仪,周 娟,刘 颖,应斌武
(四川大学华西医院实验医学科,四川成都 610041)
EB病毒(EBV)是一种线性双链DNA病毒,成人感染率高达90%,存在于人类B淋巴细胞内,通过血液循环造成全身性感染[1],大量病毒通过诱导细胞增殖、抑制细胞分化及凋亡,导致各种增生性疾病[2]。病毒感染可累及多个器官,疾病症状的多样化易造成漏诊、误诊,给临床诊断带来一定困难。传统的血清学方法可判断人体是否近期或曾经感染过EBV,但检测结果不能反映EBV的活动状况。目前核酸载量测定是诊断EBV感染相关疾病最常用的实验室诊断方法[3],通常使用实时荧光定量PCR(qPCR)方法检测EBV-DNA用于确认EBV的感染。而基于EBV感染后疾病分布特点,根据各疾病发病率的不同,其EBV-DNA载量也不同[4],但在西南地区常出现实验室结果和临床诊断不符的情况,导致qPCR检测结果对临床诊断支持能力不足,推测西南地区EBV-DNA载量有其自身特征。目前微滴式数字PCR(ddPCR)方法的灵敏度高和绝对定量的能力在分子诊断方面具有巨大的潜力,作为一种绝对定量的方法[5],可作为检测EBV-DNA载量的金标准。
故本研究旨在解决临床工作中用qPCR方法检测EBV载量与临床诊断不符的问题,一方面可以准确反映西南地区的EBV载量特点,另一方面比较ddPCR和qPCR方法检测EBV载量的能力,以ddPCR为标准,评价qPCR的性能,并为临床提供可能的解决方案。
1 资料与方法
1.1一般资料 收集2017年9-12月四川大学华西医院510例疑似EBV感染的患者血浆标本。510例患者中,免疫功能不全者201例;淋巴瘤128例;未治疗的鼻咽癌38例;治疗后的鼻咽癌143例。本研究经医院伦理委员会批准。
1.2仪器与试剂 qPCR采用EBV载量定量试剂盒,购自中国湖南圣湘生物科技有限公司;ddPCR使用全自动PCR仪,购自美国Bio-Rad公司,型号QX200。
1.3方法
1.3.1标本收集 纳入高度怀疑EBV感染的510例1 mL标本血浆,在4 ℃低温条件下,12 000 r/min离心10 min后弃沉淀吸取上清液,分装标记保存至-80 ℃冰箱中备用。
1.3.2ddPCR检测EBV核酸载量 按照DNA提取试剂盒具体说明书进行DNA的提取,在罗氏Q480仪器上进行PCR扩增,循环条件包括在95 ℃ 10 min; 94 ℃ 30 s 40个循环;56 ℃ 60 s;98 ℃ 10 min。扩增后,将PCR板转移至Bio-Rad QX200进行检测,并通过Quanta-Soft软件获得数据。
1.3.3qPCR检测EBV核酸载量 qPCR检测扩增BamHI-W片段,用已知EBV-DNA 水平的标准阳性对照品制备标准曲线;提取血浆EBV-DNA具体按照说明书进行,将待测标本严格按照说明书进行PCR扩增。按照试剂盒说明:EBV-DNA定量以400 copies/mL为界值判断结果。
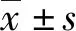
2 结 果
2.1疑似EB感染患者的EBV载量特征分析 510例疑似EBV感染病例中,男性302例,女性208例。基于ddPCR检测结果,男性阳性率为68.5%,女性阳性率为61.5%,差异无统计学意义(χ2=2.681,P>0.05)。患者平均年龄(45±16)岁,随着年龄上升,阳性率升高,差异有统计学意义(P<0.05)。初诊未治鼻咽癌患者中,阳性率最高为(81.6%),其次依序为治疗后鼻咽癌(73.4%),免疫功能不全者(72.6%),淋巴瘤患者(68.0%),各病例组之间感染率比较,差异有统计学意义(χ2=11.235,P<0.05)。对EBV病毒载量进行分析,发现EBV总的感染者病毒载量中位数为360 copies/mL,其中初诊未治鼻咽癌患者中位病毒载量最高,为4 590 copies/mL,治疗后鼻咽癌患者中位病毒载量下降为430 copies/mL,免疫力低下者中位病毒载量为130 copies/mL,而淋巴瘤患者中位病毒载量840 copies/mL。见表1。

表1 510例疑似感染者EBV分布情况
2.2两种检测方法定性结果比较 qPCR和ddPCR分别检测同一血浆标本,以400 copies/mL 作为qPCR的临界值时,与ddPCR结果做比较,结果显示用qPCR检测的大多数EBV阳性患者(252/369)被漏检。通过回顾qPCR反应曲线,发现252个漏检标本中,有231个有典型的S型扩增曲线。见表2。

表2 两种检测方法定性结果比较(n)
2.3qPCR和ddPCR阳性检测结果相关性分析 按照试剂盒qPCR的临界值,分析qPCR结果≥400 copies/mL时,与ddPCR结果相关性呈中度相关(r=0.533,P<0.05)。qPCR结果<400 copies/mL时,与ddPCR结果相关性呈弱相关(r=0.299 5,P<0.05)。见图1。

注:A表示qPCR结果≥400 copies/mL时,与ddPCR的相关性;B表示qPCR结果<400 copies/mL,与ddPCR的相关性。
图1qPCR和ddPCR阳性检测结果相关性分析
2.4基于ddPCR结果尝试优化qPCR的临界值 以ddPCR检测结果为基准,根据ROC曲线每一点对应的灵敏度和特异度,选择适合的灵敏度和特异度,绘制ROC曲线,AUC=0.871。此时,得到在qPCR方法中EBV-DNA对应的临界值(qPCR)=10 copies/mL,灵敏度为0.824,特异度为0.780。利用优化后的临界值,重新判定EB阴性、阳性,在510例标本中,qPCR方法的灵敏度由0.317提高至0.943,且假阴性得到大幅度降低,从0.683降为0.057。见图2、表3。

图2 qPCR的ROC曲线
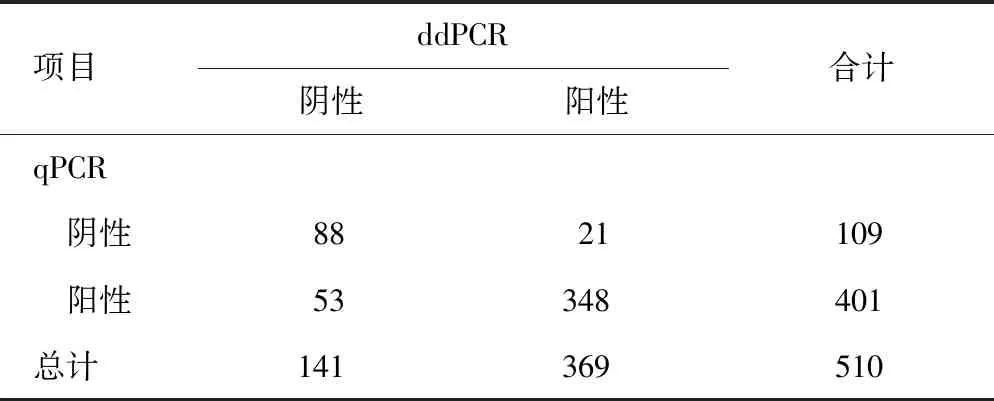
表3 两种检测方法定性结果比较(n)
3 讨 论
EBV感染对人体免疫功能影响甚大,与机体许多疾病发生机制相关,且EBV是第1个被证实与癌症发生相关的病毒,由EBV感染导致的胃癌、鼻咽癌等癌症患者死亡逐年增加[6-7]。而EBV-DNA载量检测不仅是EBV感染存在的直接证据,也可评估服用免疫抑制剂治疗自身免疫性疾病或监测移植后患者的治疗效果,或辅助诊断淋巴瘤和鼻咽癌及判断预后,因此早期发现EBV感染对阻止恶性疾病进程有至关重要的意义。但实际工作中,成人EBV感染的病理表现复杂,早期诊断较为困难。且临床实践中EBV-DNA载量大多非常低,qPCR方法灵敏度难以满足临床需求,作为EBV筛检指标漏检率高,可能为临床诊断带来困扰。故本研究采用了ddPCR和qPCR两种方法同时检测510例血浆标本病毒DNA载量,探讨不同地区各疾病组之间病毒载量间差异性,最终为西南地区EB感染临床诊断与实验室结果不符的问题提供解决思路。
本研究基于EBV的上述特点用ddPCR方法检测了EBV感染相关疾病免疫功能不全者、淋巴瘤患者、初诊未治鼻咽癌患者及治疗后鼻咽癌患者血浆中EBV-DNA水平。510例疑似EBV感染者的EBV中位数载量为360 copies/mL,与其他低发区相比,宁夏地区EBV感染者EBV-DNA载量为5.01×103copies/mL[8],山西地区EBV感染的病毒中位数载量为3 356 copies/mL[9],西南地区EBV感染者EBV-DNA载量远远低于其他低发区,结果显示EBV-DNA载量高低与低发区无关。其中初诊未治鼻咽癌患者中位病毒载量为4 590 copies/mL,治疗后鼻咽癌患者中位病毒载量下降为430 copies/mL,免疫力低下者中位病毒载量为130 copies/mL,而淋巴瘤患者中位病毒载量为840 copies/mL,杨雀飞等[10]研究得出鼻咽癌患者EBV-DNA载量为4 250 copies/mL;喻晶等[11]研究得出,鼻咽癌患者EBV-DNA载量为1.1×106copies/mL,淋巴瘤患者EBV-DNA数值为6.9×103copies/mL,自身免疫疾病患者EBV-DNA数值为630 copies/mL,将西南地区各疾病组与高发区EBV-DNA载量相比,显示西南地区EBV感染各疾病组的EBV-DNA载量均低,且疾病组载量规律相同。国内外文献对于EBV阳性检测率报道在70%~90%,中位拷贝数为103~104copies/mL[12-14],将不同地区结果对比发现,本院检测出的EBV-DNA水平明显较低。
实验室使用试剂盒临界值:400 copies/mL定性EBV感染。qPCR检测EBV感染以400 copies/mL为界值,≥400 copies/mL时,ddPCR与qPCR的EBV-DNA测定水平值呈中度相关(r=0.533,P<0.05),<400 copies/mL时ddPCR与qPCR的EBV-DNA测定水平值度呈弱相关(r=0.299 5,P<0.05)。此结果证明载量在400 copies/mL以下不能准确检测,有漏检情况,此临界值不能满足EBV-DNA低载量水平的检测,也证明了目前临床qPCR检测手段无法准确为临床在EBV感染提供有效的证据,但由于目前国际上还没有采用统一的检测标准,无法确立统一的临界值作为阳性参考值,这可能会影响检测中的灵敏度和特异度[15],所以西南地区低水平的EBV-DNA的检测可能需要更为灵敏的方法去检测。
qPCR方法是目前临床EBV-DNA常用的筛检方式,qPCR要求目的基因拷贝数相对较高,对目的基因做出相对定量分析[16],本研究中,ddPCR和qPCR两种方法的定性结果比较后发现,qPCR漏检率高达68.3%,在漏检的252例标本中,231例标本有明显扩增曲线,推断患者有EBV感染,说明在西南地区qPCR方法筛检低水平载量的EBV-DNA,情况不理想,因而需要寻找更为灵敏的方法去检测。近来,ddPCR发展迅速,用ddPCR检测血浆能实现对EBV-DNA的绝对定量,ddPCR由Bio-Rad公司于2011年推出[17],该技术在传统的PCR扩增前对样品进行微滴化处理,而后进行PCR扩增,根据泊松分布原理及阳性微滴的个数与比例,可得出靶分子的起始拷贝数或水平,是一种核酸分子绝对定量技术,其检测敏感性高达0.001%,而ddPCR不仅兼具qPCR优点,无需建立标准曲线,更不受扩增效率的影响,有研究利用逆转录和ddPCR技术灵敏度高和精确性强的特点测定甲流病毒中的去离子颗粒[18-19],而有许多研究证实ddPCR可作为EBV-DNA检测的金标准,即可实现对EBV-DNA的绝对定量,尤其是微量标本的绝对定量[20],TAKUYA[21]根据ddPCR检测EBV的BamH1-W片段拷贝数计算EBV-DNA载量,并设定EBV-DNA载量的截止值。
根据目前状况,可针对临床实验室普遍使用的EBV-DNA检测的qPCR法进行优化,适当提高qPCR方法的灵敏度,优化其临界值,降低其漏检率,高度有效地筛检EBV感染,更好地指导临床诊断。但在此研究中,尝试对qPCR进行优化,以ddPCR结果为金标准,绘制qPCR的ROC曲线,AUC 0.871,找到新的临界值(qPCR)=10 copies/mL,灵敏度82.4%,特异度78.0%。用新的临界值进行验证,结果显示对于极低EBV-DNA载量,qPCR存在假阳性可能,且假阳性为37.5%,在这个临界值下,检验效能虽得到大幅度提高,但特异度降低,所以还是寻找灵敏度更高的方法更为可靠,比如ddPCR。
4 结 论
西南地区临床实践中EBV载量大多非常低,常规qPCR方法灵敏度难以满足临床需求,采用ddPCR方法检测EBV-DNA载量能为临床诊断EBV感染提供更有利的支持。
