山楂叶多酚的纯化及其抗氧化特性与组分分析
2020-03-02巫永华刘恩岐张建萍陈尚龙陈安徽邵颖
巫永华,刘恩岐,张建萍,陈尚龙,陈安徽,邵颖
(徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州, 221008)
山楂作为一种重要的药用植物资源被收录于《中国药典》[1]和欧洲许多国家的药典[2]中。研究表明不仅山楂果,山楂叶提取物也表现出良好的抗氧化[3]、抗炎、镇痛[4]、调节免疫功能[5]和预防动脉粥样硬化、冠心病[6]、调血脂[7]、降血糖[8]等改善心脑血管系统等方面的生理活性,这些功效与其所含有的原花青素、黄酮、酚酸等成分密切相关。课题组前期研究发现山楂叶中含有一定量的多酚物质,其多酚粗提液具有较好的抗氧化活性[9],但由于多酚粗提液含有较多的多糖、蛋白质等杂质,会影响其生理活性评价的准确性,因此有必要对其进行分离纯化,以获得纯度较高的多酚物质,并评价其生理功能。
大孔吸附树脂具有良好的化学稳定性和吸附选择性,同时还有吸附量大、操作条件温和、简单、安全、不易受酸碱和杂质的影响、可再生、使用周期长,有利于大规模生产等优点,被广泛用于天然活性化合物的分离纯化[10-11]。近年来,大孔吸附树脂纯化多酚类物质已有大量的报道[12-16],并取得了较好的效果。但用于山楂叶多酚的纯化鲜有报道,本文探讨大孔吸附树脂对山楂叶粗多酚的纯化效果,分析纯化后山楂叶多酚的抗氧化和多酚组成成分,为山楂叶多酚类物质的进一步研究和在功能性食品、药品中利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
山楂叶,10月上旬采摘;纤维素酶(1 800 U/mg)、果胶酶(1 000 U/mg)、SP-825、XAD-2、AB-8和D101树脂,上海源叶生物科技有限公司;KBr(光谱纯),美国PIKE公司;DPPH,Sigma公司;其余试剂均为分析纯。
1.2 仪器与设备
R206旋转蒸发仪,上海申生科技有限公司;HH-1恒流泵,上海嘉鹏科技有限公司;BSZ-100自动部分收集器,上海沪西分析仪器厂;TU-1810紫外分光光度计,北京普析通用有限公司;L550离心机,湖南湘仪离心机仪器有限公司;1260Ⅱ高效液相色谱仪,美国安捷伦科技有限公司;Nicolet iS10傅里叶红外光谱仪,美国Thermo fisher公司。
1.3 山楂叶粗多酚的制备
参照课题组优化的方法制备山楂叶多酚[9]。将新鲜的山楂叶于放置于60 ℃鼓风干燥箱中干燥24 h,粉碎后过50目筛。取适量山楂叶粉,加入5倍的石油醚,室温搅拌24 h,静置分层后下层再加入适量石油醚,重复以上操作3次进行脱脂脱蜡。准确称取脱脂山楂叶粉100 g,加入质量浓度为0.20 mg/mL的复合酶(纤维素酶与果胶酶质量比为1∶1)的水溶液4 000 mL,在40 ℃,pH 4.5下酶解2 h,过滤,收集滤液。滤渣中加入70%乙醇400 mL,于50 ℃下浸提2 h,抽滤,合并上述提取液,加无水乙醇至醇浓度为80%,4 ℃过夜,离心,上清液减压浓缩,冷冻干燥后得到山楂叶粗多酚粉,置于-20 ℃下保存,备用。
1.4 大孔树脂纯化山楂叶粗多酚
1.4.1 大孔树脂的预处理
取一定量的SP-825,D101,AB-8,XDA-2树脂,用无水乙醇处理24 h后用蒸馏水冲洗至无醇味,用5% NaOH处理8 h后,蒸馏水洗至中性,再用1 mol/L HCl处理8 h后,用纯水洗至中性,抽滤,备用。
1.4.2 最佳树脂的筛选
通过静态吸附、解吸试验筛选出对山楂叶多酚分离性能最佳的树脂。称取经预处理的4种树脂各5.00 g,各加入100 mL质量浓度为1.6 mg/mL的山楂叶多酚粗提液,在25℃、120 r/min下水浴振荡,每隔1 h吸取1 mL上清液,测其多酚含量,至吸光值无明显变化为止。倒去上清液后,加入50%的乙醇溶液100 mL,25℃、120 r/min水浴振荡,每隔1 h吸取1 mL上清液,测其多酚含量,至吸光值无明显变化为止。按公式(1)和(2)计算不同树脂的吸附率和解吸率:

(1)

(2)
式中:C0,初始多酚质量浓度,μg/mL;C1,吸附平衡后上清液的多酚浓度,μg/mL;C2,解吸后乙醇洗脱液中的多酚质量浓度,μg/mL。
1.4.3 AB-8大孔树脂静态吸附-解吸试验
1.4.3.1 样液pH的确定
分别称取处理好的树脂2.00 g于5个锥形瓶中,加入50 mL一定质量浓度的山楂叶多酚样液,调pH值为4.0、4.5、5.0、5.5、6.0,于25℃下120 r/min振荡吸附8 h,测定上清液中多酚含量,考察样液pH值对树脂吸附性能的影响
1.4.3.2 样液初始浓度的确定
称取处理好的树脂2.00 g于5个锥形瓶中,分别加入50 mL质量浓度为57.14、64.27、71.43、78.57、85.71 μg/mL的山楂叶多酚粗提液,在最优pH及25℃、120 r/min下振荡吸附8 h,测定上清液中多酚含量,考察样液初始浓度对树脂吸附性能的影响。
1.4.3.3 洗脱剂浓度的确定
在最佳上样pH和浓度条件下进行吸附,吸附饱和后,分别用体积分数为60%、70%、80%、90%、100%的乙醇作为洗脱剂,在洗脱液料比为25∶1(乙醇溶液∶大孔吸附树脂,mL∶g),25℃、120 r/min下振荡解吸2 h,测定上清液中多酚含量,考察洗脱剂浓度对AB-8大孔树脂解吸性能的影响。
1.4.4 AB-8大孔树脂动态吸附-解吸试验
1.4.4.1 上样流速的选择
将预处理好的AB-8大孔树脂装入玻璃层析柱(1.5 cm×26 cm)中,沉降30 min,在最佳pH和浓度条件下,将山楂叶多酚提取液分别以0.5、1.0、1.5 mL/min的流速上柱,按3 mL每管收集流出液,并测定各管流出液的总酚含量。
1.4.4.2 洗脱流速的选择
吸附液全部流过后,再用蒸馏水过柱,将吸附后的树脂洗至流出液为无色时,使用最优浓度的乙醇,分别以0.4、0.6、1 mL/min的洗脱速度对其进行洗脱,按3mL每管收集流出液,并测定各管流出液的总酚含量。
1.5 总酚含量的测定
总酚含量的测定参照陈安徽等[9]报道的方法。以没食子酸为标准品,绘制标准曲线,获得的回归方程为y=0.091 9x+0.030 8,R2=0.999 3,相关性良好。测定样品中多酚含量时,移取样液1 mL于25 mL棕色容量瓶中,按照标准曲线的方法进行操作,并根据回归方程计算出样液中的多酚含量。
1.6 山楂叶多酚抗氧化活性分析
试验以总还原力、Fe2+离子螯合能力、DPPH·和·OH清除能力为指标,参照陈安徽等[9]报道的方法测定分析山楂叶多酚纯化前和纯化后的抗氧化活性。
1.7 山楂叶多酚的组分分析
分别用称取20 mg的没食子酸、儿茶素、绿原酸、咖啡酸、表儿茶素、阿魏酸、芦丁、槲皮素、山奈酚和熊果酸,用甲醇溶解,配成质量浓度为0.5 mg/mL的单一标准液,各取120 μL混合配成10种物质的混合标准品,分别用0.22 μm 滤膜过滤后用于HPLC检测。样品用甲醇溶解后,用0.22 μm滤膜过滤后检测。
分析条件:采用安捷伦1260ⅡHPLC 系统,二极管阵列(DAD)检测器,自动进样器进样,Agilent C18色谱柱(250 mm×4.6 mm,5 μm)。参考史斌斌[17]的方法,并根据预试验结果稍作修改,流动向 A为0.8%乙酸,B为色谱甲醇,柱温 28 ℃,进样量 20 μL,流速 0.9 mL/min。流动相洗脱方法见表1所示:
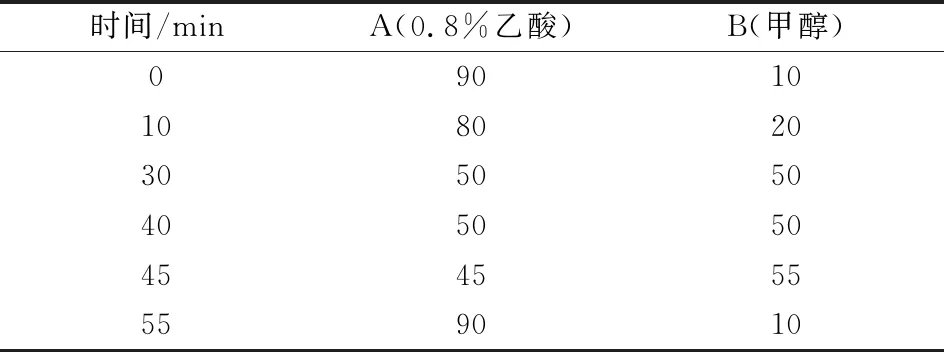
表1 流动相梯度洗脱方法
1.8 山楂叶多酚的FTIR分析
参考旷慧[18]的方法,取山楂叶多酚纯化物1~2 mg与200 mg烘干后的光谱纯KBr混合均匀,研磨至粒度小于2 μm的粉末。用压片机压成均匀透明的薄片,在波长4 000~400 cm-1扫描,获得FTIR图。
2 结果与分析
2.1 大孔树脂分离纯化山楂叶多酚的试验结果
2.1.1 树脂种类及静态吸附、解吸时间的确定
不同的树脂由于其物理和化学特性不同,会表现出对目标物的吸附特性不一样。试验选择的4种树脂对山楂多酚提取物的吸附效果见图1。总体而言,4种树脂对山楂叶多酚都具有较好的吸附效果,均达到了97%以上,但相比较而言,AB-8的吸附效果较好。从吸附时间对吸附率来看,4种树脂在试验条件下吸附8 h即可待到吸附平衡。故选择8 h为最佳吸附时间。

图1 树脂种类和吸附时间对吸附率的影响

图2 树脂种类和解吸时间对解吸率的影响
吸附平衡后,采用50%的乙醇进行解吸,由图2可知,解吸率在前2 h时内迅速增加,达到72%以上,之后趋于平稳,表明解吸2 h即可达到良好的解吸效果;4种树脂中SP-825的解吸效果最好,其次是AB-8,但二者的解吸率没有显著差异。
树脂对目标物的吸附和解吸效果都好时才能最大限度的纯化回收多酚物质。综合吸附和解吸试验结果,AB-8树脂对山楂叶多酚的纯化效率最好,故选择AB-8为最佳树脂进行后续研究。
2.1.2 AB-8树脂静态吸附-解吸条件的确定
2.1.2.1 样液pH的选择
样液pH不同会改变溶液的溶解度,进而影响树脂的吸附效果,山楂叶多酚粗提液的酸碱值会对树脂吸附作用的影响见图3。由图3可知,AB-8树脂对山楂叶多酚的吸附效果在pH为4.5时,吸附率最高。因此,选定pH值为4.5作为纯化时样液的最佳酸碱环境。不同酸碱度会改变溶液中目标成分的存在形式,改变溶液极性,从而影响其与大孔吸附树脂间的分子作用力,而山楂叶多酚含有一定的酚羟基结构,呈弱酸性,在酸性条件下比较稳定,也利于大孔树脂对多酚的吸附[12,19]。

图3 pH值对吸附率的影响
2.1.2.2 上样浓度的选择
起始上样浓度的不同会导致单位体积多酚分子与树脂接触数量不同而呈现不同的吸附效果,试验结果见图4。由图4可以看出,吸附率随着上样浓度的增大呈现的趋势是先增加后减小,并在质量浓度为64.29 μg/mL时吸附率最大,这可能是由于浓度增加有利于增大多酚分子与树脂的接触面积以提高吸附率,但是浓度过高时黏度会比较大,不利于其他分子与树脂接触、阻碍分子的扩散且增加了杂质对树脂的竞争,且易产生沉淀,堵塞树脂,造成多酚吸附率下降;而过低的浓度会有部分树脂未达到吸附饱和[20]。因此,选定质量浓度为64.29 μg/mL时作为纯化时样液初始上样浓度。

图4 上样浓度对吸附率的影响
2.1.2.3 洗脱剂浓度的选择
试验选择不同体积分数的乙醇进行解吸,试验结果见图5。由图5可以看出,解吸率随着乙醇体积分数的增大先急剧上升再急剧下降,当乙醇体积分数是70%时解吸率最大。这可能与山楂叶多酚的主要组成成分的极性相关,但乙醇体积分数小于70%时,多酚与树脂间形成的氢键不能被破坏,多酚无法洗脱下来,而高浓度乙醇的极性与山楂叶多酚的极性差距较大,解吸率会降低[21];也有认为高浓度乙醇中水分含量较少,使一些水溶性酚类物质无法被洗脱下来,导致解吸率降低[22]。因此,选定体积分数为70%的乙醇作为解吸时的洗脱剂。试验结果与何婷采用AB-8树脂纯化龙眼核多酚的结果一致[23]。
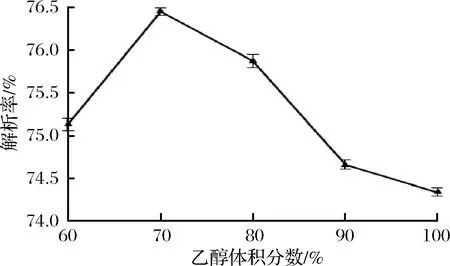
图5 乙醇体积分数对解吸率的影响
2.1.3 AB-8树脂动态吸附-解吸试验结果
2.1.3.1 上样流速对树脂吸附效果的影响
动态吸附过程中流速是影响树脂吸附率的主要因素,当流出液多酚含量为上样液多酚含量的1/10时,被认为是泄漏点,当出现泄漏点时停止上样,被认为是吸附的最佳状态[24]。上样流速对AB-8树脂吸附效果的影响试验结果见图6。随着上样液体积的增加,不同上样流速时流出液中多酚的含量逐渐增大。当流速为0.5 mL/min时,上样29 mL左右达到树脂吸附泄漏点;流速为1 mL/min时,上样13 mL左右达到树脂吸附泄漏点;流速为1.5 mL/min时,上样10 mL左右达到树脂吸附泄漏点;有报道认为上样流速过快时,目标物与大孔树脂不能充分接触、吸附,使部分目标物直接流出柱子,过早出现泄漏点,导致树脂吸附效果不高[12]。而流速越慢,虽有利于树脂对山楂叶酚类物质的吸附,但泄漏点越迟使得生产周期偏长。综合分析,本试验确定上样的最佳流速是1 mL/min。此流速条件下最佳上样量应为13 mL。

图6 上样流速对吸附率的影响
2.1.3.2 洗脱速度对树脂解吸效果的影响
洗脱流速对多酚解吸效果的结果见图7。当洗脱流速为0.4 mL/min和0.6 mL/min时得到的峰形相对较窄,且拖尾状况不明显,当洗脱流速为1 mL/min时得到的洗脱峰会有较严重的拖尾现象。有报道认为洗脱流速过慢,则解吸时间延长,且在流动过程中被洗脱的多酚可能会被重新吸附,两相间会重新建立动态平衡,降低解吸量;若洗脱流速过快,则会导致洗脱剂与树脂的接触时间短,无法充分解吸出来,降低解吸率[13]。综合考虑,试验确定洗脱的最佳流速是0.6 mL/min。此流速条件下最佳洗脱体积应为30 mL。在此条件下洗脱下来的多酚回收率为78.25%,纯化前后多酚的纯度由(15.72±1.86)%,提高到了(80.93±2.32)%,提高了4.15倍。

图7 洗脱流速对解吸率的影响
2.2 山楂叶多酚的抗氧化试验结果
2.2.1 清除DPPH·能力的试验结果
清除DPPH·的活性与抑制过氧化能力正相关,可用于评价自然植物的清除自由基效果。山楂叶多酚纯化前后对DPPH·的清除效果见图8,由图8可以看出,在试验浓度内,随着多酚溶液浓度的增大,清除率也在不断上升,纯化后的山楂叶多酚在质量浓度为2.16 μg/mL时,清除率已经达到89.99%;由表1可知,山楂叶多酚纯化前后对DPPH·的IC50值分别为(1.28±0.14) μg/mL和(0.78±0.09) μg/mL,经纯化后清除效果显著高于纯化前的粗多酚(P<0.05),纯化后的山楂叶多酚具有更强的清DPPH·的能力。
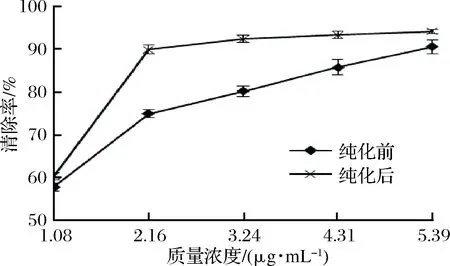
图8 清除DPPH·自由基能力的试验结果
2.2.2 总还原能力试验结果
图9是不同浓度的山楂叶多酚纯化前后的总还原能力试验结果。由图9和表1可知,山楂叶多酚具有较强的总还原能力,具有较好的量效关系,纯化前后的IC50值分别为(3.66±0.18) μg/mL和(2.12±0.23) μg/mL,纯化后的总还原能力显著高于纯化前的粗多酚(P<0.05)。

图9 总还原能力的测定结果
2.2.3 螯合Fe2+能力的试验结果
螯合Fe2+是指螯合剂分子将Fe21包合到其内部,整体变成稳定的化合物以阻碍亚铁离子起作用,从而起到抗氧化的效果。由图10可知,随着多酚溶液质量浓度的增大,对Fe2+螯合率不断提高,表现出良好的剂量-效果关系;由表1可知,山楂叶多酚纯化前后螯合Fe2+的IC50值分别为(55.58±1.24) μg/mL和(34.13±1.02) μg/mL。纯化后的螯合效果显著高于纯化前的(P<0.05)效果。有报道认为茶多酚的酚羟基极易与金属离子螯合[25],提示山楂叶多酚具有酚羟基结构,能阻止金属离子对自由基连锁反应的催化作用。
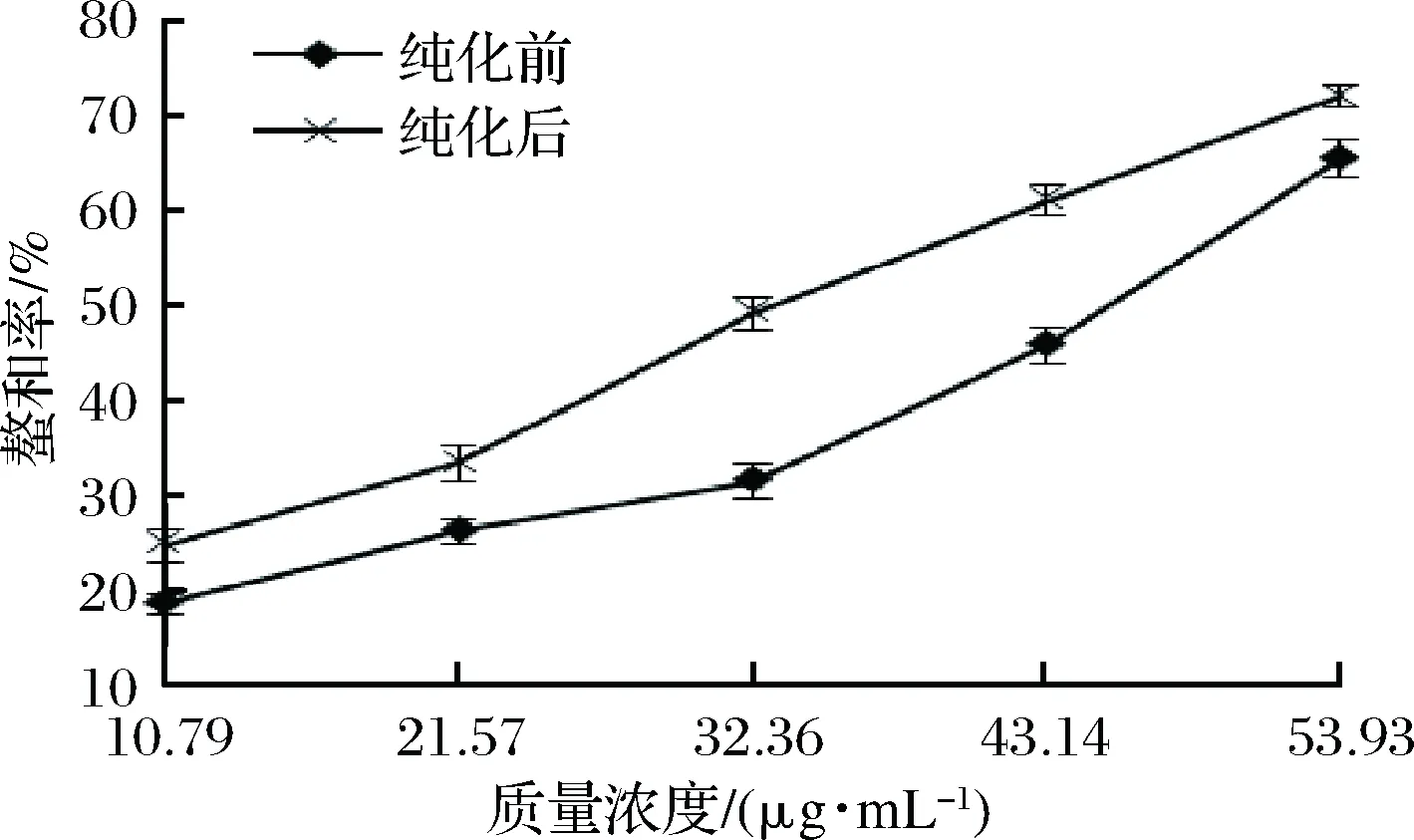
图10 螯合Fe2+离子能力的测定结果
2.2.4 清除·OH能力的试验结果
·OH是活性最强的一种自由基,具有极强的氧化性,使红细胞受损,引发细胞病变。由图11可知,随着溶液浓度的增大,纯化前后的山楂叶多酚的对·OH的清除能力不断提高,具有良好的剂量-效果关系;在多酚的质量浓度为5.39 μg/mL时,山楂叶多酚对·OH的清除率分别为56.21%和26.56%;由表2可知,山楂叶多酚纯化后清除·OH的IC50值为(4.49±0.16) μg/mL,表明纯化后的山楂叶多酚具有更好的清除·OH作用。
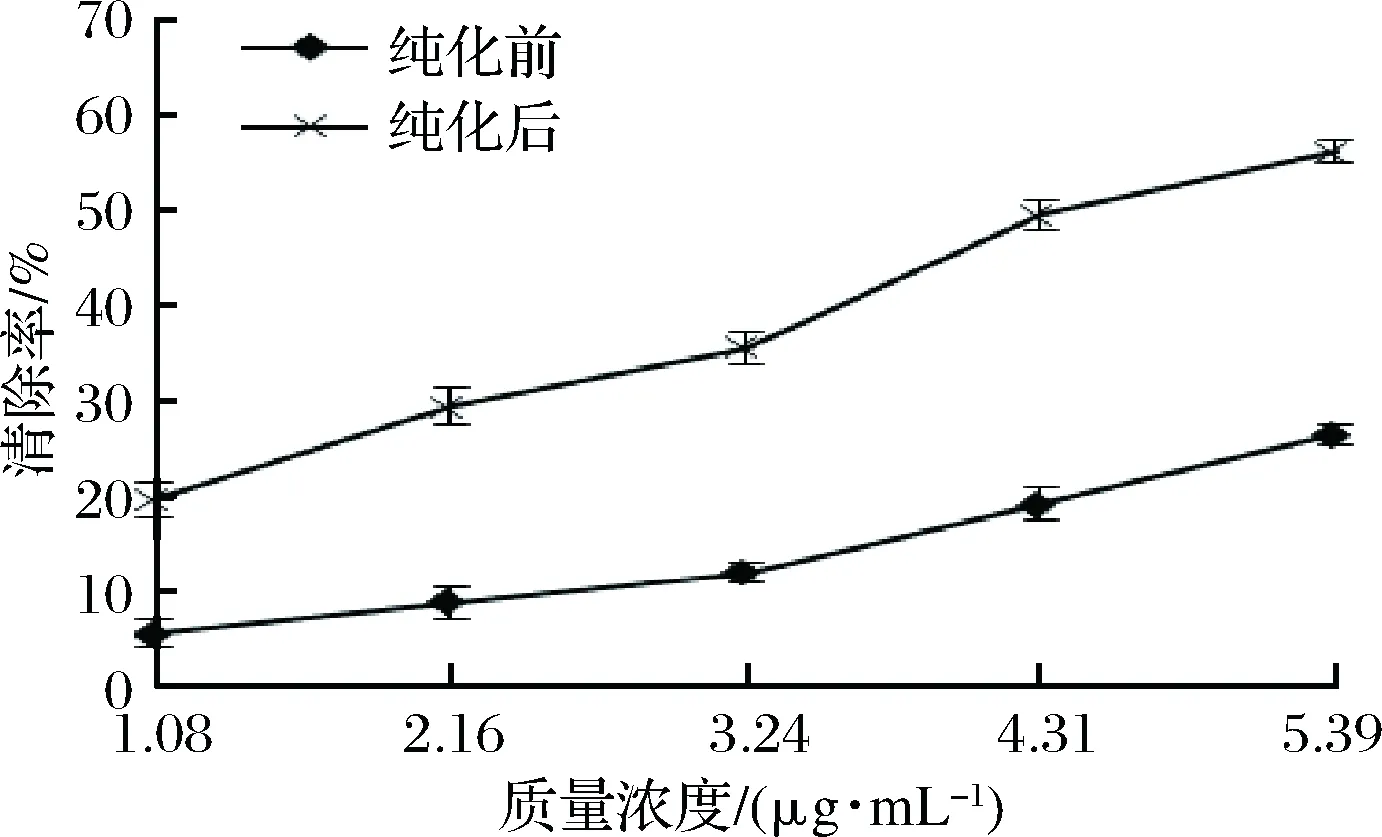
图11 清除·OH能力的测定结果
表2是山楂叶多酚纯化前后纯度和对不同抗氧化体系的抗氧化能力的比较。山楂叶多酚具有较好的DPPH·、·OH清除能力、螯合Fe2+能力和总还原力,提示山楂叶多酚具有很强的抗氧化活性,同时,经过AB-8树脂纯化后,山楂叶多酚的纯度和对各体系的抗氧化能力显著高于未纯化的粗提液(P<0.05)。蒋孟君等[26]研究表明,经大孔树脂纯化后玫瑰花多酚的抗氧化活性有所提高,与本研究结果一致,可能是由于大孔树脂对多酚类物质起到了纯化和富集的作用。也有报道认为植物多酚的抗氧化能力与总酚含量密切关系,另外分子质量越大其抗氧化活性也增强,还与酚羟基的数量和所在的位置有很大的关系[27]。

表2 山楂叶多酚对体外不同反应体系抗氧化能力的比较(IC50值)
注:同一指标不同字母上标表示显著差异。“-”表示不能计算。
2.3 山楂叶多酚纯化物的红外光谱分析结果

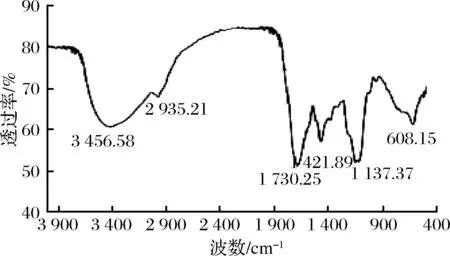
图12 山楂叶多酚纯化物的红外光谱图
2.4 山楂叶多酚组成及含量分析
分别确定每种标准品的出峰时间,并以10种单体酚为混标,采用 HPLC-DAD 法测定山楂叶多酚纯化物的组成,同时对其含量进行分析。由图13和表3可知,山楂叶多酚纯化物检测出了绿源酸,表儿茶素,阿魏酸,芦丁和熊果酸5种单酚物质,其中含量最高的是熊果酸,为(61.38±2.32) μg/mL。贾亚楠[2]也报道山楂叶中含有较高的绿原酸,表儿茶素和碳苷黄酮成分。弓威[31]从山楂叶中鉴定出了槲皮素,熊果酸和槲皮素3-O-β-D-葡萄糖苷等成分。

1-没食子酸;2-儿茶素;3-绿源酸;4-咖啡酸;5-表儿茶素;6-阿魏酸;7-芦丁;8-槲皮素;9-山奈酚;10-熊果酸;a-标准品;b-样品

表3 山楂叶多酚纯化后单体酚种类及含量
3 结论
植物多酚作为一种重要的次生代谢产物,具有多种生理生化功能,但要评价其生理功能就必须要获得高纯度的多酚组分,试验研究了大孔吸附树脂对山楂叶多酚的纯化工艺,结果表明,在4种树脂中,AB-8树脂对山楂叶多酚的纯化效果较好,其最佳的纯化工艺为样液初始pH 4.5、初始质量浓度为0.064 mg/mL、上样流速为1.5 mL/min、洗脱剂乙醇体积分数为70%和洗脱流速为0.6 mL/min,在此条件下,山楂叶多酚的回收率为78.25%,纯化前后多酚的纯度由(15.72±1.86)%,提高到了(80.93±2.32)%,提高了4.15倍。体外抗氧化活性试验表明,山楂叶多酚表现出较好的抗氧化能力,其粗提液和纯化液对DPPH·清除能力的IC50值分别为(1.28±0.14) μg/mL和(0.78±0.09) μg/mL;对Fe2+螯合能力的IC50值分别为(55.58±1.24) μg/mL和(34.13±1.02) μg/mL;总还原能力的IC50值分别为(3.66±0.18) μg/mL和为(2.12±0.23) μg/mL;纯化后对·OH清除能力的IC50值为(4.49±0.16) μg/mL;表明经纯化后山楂叶多酚的抗氧化能力较纯化前有了显著提高。红外光谱分析显示其具有多酚和黄酮的特征峰;HPLC分析表明山楂叶多酚中含有绿源酸,表儿茶素,阿魏酸,芦丁和熊果酸5种单酚物质,结果表明山楂叶多酚具有较高的开发和应用价值。但是本研究仅仅通过10种标准品来鉴定山楂叶的酚类物质组成,未对其进行对其进行更进一步的纯化以制备出单体组分,并通过HPLC-MS、核磁共振等手段进行鉴定。
