基于网络药理学和分子对接技术研究人参皂苷Rg1治疗阿尔茨海默病的分子生物学机制
2020-03-01盛望王瑾茜殷淑婷李旭华胡国恒谢丽华
盛望,王瑾茜,殷淑婷,2,李旭华,胡国恒,2,谢丽华,2*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
阿尔茨海默病(Alzheimer's disease,AD)是一种以认知障碍、行为异常、神经精神症状为主要临床表现的进行性发展的神经系统退行性疾病。世界阿尔茨海默病2018年报告全球约有5 000万人患有痴呆,且患病人数将逐年上升,预计至2050年,患病人数将增至1.52亿;而全球社会与该疾病相关的治疗费用每年约1万亿美元,预计到2030年将翻一倍[1]。其病因病机复杂且尚不明确,现代研究表明,年龄、性别、遗传因素等为AD的主要发病原因[2],其发病机制假说主要有基因遗传学说、胆碱能学说、自由基学说、Aβ淀粉样蛋白学说、炎症和免疫学说、氧化应激学说、Tau蛋白异常磷酸化假说等[3-4]。目前治疗手段以改善临床症状为主,临床主要予以胆碱酶抑制剂(ChEI)、N-甲基-D天冬氨酸(NMDA)受体拮抗剂、淀粉样前体蛋白B位点分裂酶(BACE)抑制剂等改善患者认知功能,但不能有效的逆转或阻止病情进展[4]。因此探寻或开发能有效防治AD的药物研究具有重要意义。人参“补气,固脱,生津,安神,益智”[5],人参皂苷Rg1是人参的主要药效成分之一,陈红淑等[6]研究发现,人参皂苷Rg1可通过有效提高细胞活力,抑制LC3-Ⅱ和Beclin-1蛋白表达,从而抑制Aβ诱导的细胞自噬性死亡发挥神经保护作用。李乃静等[7]研究表明,人参皂苷Rg1不仅可减少AD小鼠海马组织的Aβ沉积,改善AD小鼠的认知功能,还可通过影响次黄嘌呤、二氢鞘胺醇、十六碳黄嘌呤等水平调节脑代谢,以防治AD。可见,人参皂苷Rg1在防治AD方面具有重要的研究价值。
本研究通过对人参皂苷Rg1作用靶点和AD相关的疾病靶点进行筛选汇总,得出人参皂苷Rg1作用于AD的作用交联靶点,通过网络药理学和分子对接方法,从靶点、信号通路的角度研究人参皂苷Rg1治疗AD的作用机制,为进一步阐明其治疗AD的药理作用及机制提供依据。
1 研究方法
1.1 人参皂苷Rg1作用靶点的预测
利用中药系统药理学数据库和分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)查找人参皂苷Rg1化学结构式,并保存其mol2格式文件。将TCMSP数据库中下载的人参皂苷Rg1分子结构以mol2格式输入PharmMapper Server平台(http://lilab-ecust.cn/pharmmapper/index.html)预测其作用靶点,设置人类蛋白靶点作为药效团映射,并设定返回靶点数为300,得到人参皂苷Rg1相关的靶点名称、基因名称、Uniprot ID、匹配值(fit score)等结果,录入Uniprot(https://www.uniprot.org/)数据库中检索,选择物种为“Homo sapiens”,删除重复、非人源与不规范的靶点,校正为其官方名称并摘录其标准基因名,最终得到人参皂苷Rg1活性成分的作用靶点。
1.2 人参皂苷Rg1作用靶点蛋白互作(PPI)网络的构建
将1.1预测靶点导入STRING11.0数据库(https://string-db.org),限定研究物种为“Homo sapiens”,最低相互作用域值设为highest confidence≥0.9,其他参数保持默认设置,从而获得蛋白互作信息。将从STRING11.0数据库导出的文件中node1、node2和Combined score信息导入Cytoscape3.6.1软件进行可视化分析,使用Network Analyzer功能对靶点进行分析,节点面积大小及颜色深浅代表度(Degree)值的大小,并得到网络分析结果。
1.3 人参皂苷Rg1作用AD相关靶点的收集及PPI网络构建
以“阿尔茨海默病(Alzheimer's disease)”作为检索词,通过GeneCards数据库(https://www.genecards.org/)、CTD数据库(https://ctdbase.org/)查找与AD相关靶点,每个数据库选择相关度前300的靶点作为慢性胃炎疾病靶点进行研究,合并2个数据库,去除重复基因和假阳性基因,将所得AD相关靶点与人参皂苷Rg1活性成分作用靶点通过VENNY2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)得出共同靶点,即为人参皂苷Rg1治疗AD的作用靶点。将共同靶点导入STRING11.0数据库,选择研究物种为“Homo sapiens”,最低相互作用域值设为highest confidence≥0.4,获得靶点联系网络图,将该图进一步导入Cytoscape3.6.1软件构建PPI网络。
1.4 人参皂苷Rg1作用AD的GO富集分析与通路注释分析
将人参皂苷Rg1治疗AD的作用靶点以Gene Symbol的格式导入DAVID 6.8数据库(https://david.ncifcrf.gov/),分别选择生物过程(biological process,BP)、分子功能(molecular function, MF)和细胞成分(cellular component, CC)进行基因本体(GO)富集分析,选择KEGG进行靶点基因通路注释分析,并且使用GraphPad Prism 8软件将GO富集分析满足PValue<0.05的结果做成可视化条形图。使用Omicshare(https://www.omicshare.com/)将KEGG分析满足PValue<0.05的结果制成可视化气泡图。
1.5 人参皂苷Rg1与其作用AD靶点之间分子对接验证
利用RCSB PDB数据库(http://www.rcsb.org/)查找筛选出的45个靶点的晶体结构,利用ZINC数据库(http://zinc.docking.org/)查找筛选出的人参皂苷Rg1的Mol2结构式,将活性成分的Mol2结构式与PDB ID形式的靶点导入AutoDock软件,对活性成分和靶标蛋白进行虚拟分子对接分析。结合能小于0说明配体与受体可自发结合,目前对活性分子筛选尚无统一标准,根据文献报道[8],这里选取结合能≤-5kJ/mol的成分作为人参皂苷Rg1治疗AD的有效成分评价标准。
2 结果
2.1 人参皂苷Rg1潜在靶点信息
根据PharmMapper Server数据库查找人参皂苷Rg1靶点,删除重复靶点及经Uniprot数据库校正后得到潜在靶点284个及其对应的标准的基因名,其中highest confidence≥0.9靶点有203个。人参皂苷Rg1靶点相互作用见图1,其中,节点颜色越深对应面积越大,代表度值越大。度值表示该靶点与其他作用靶点的关联个数,度值越大表明该靶点在网络中的作用越重要,度值排名前10的靶点分别为MAPK1、SRC、PIK3R1、AKT1、RXRA、HRAS、GRB2、MAPK14、PTPN11、HSP90AA1,且均可作用于20个以上的靶点,说明这些靶点在人参皂苷Rg1作用网络中具有重要作用,关系网络中节点详细信息见表1(仅列靶点度值的前30个靶点)。
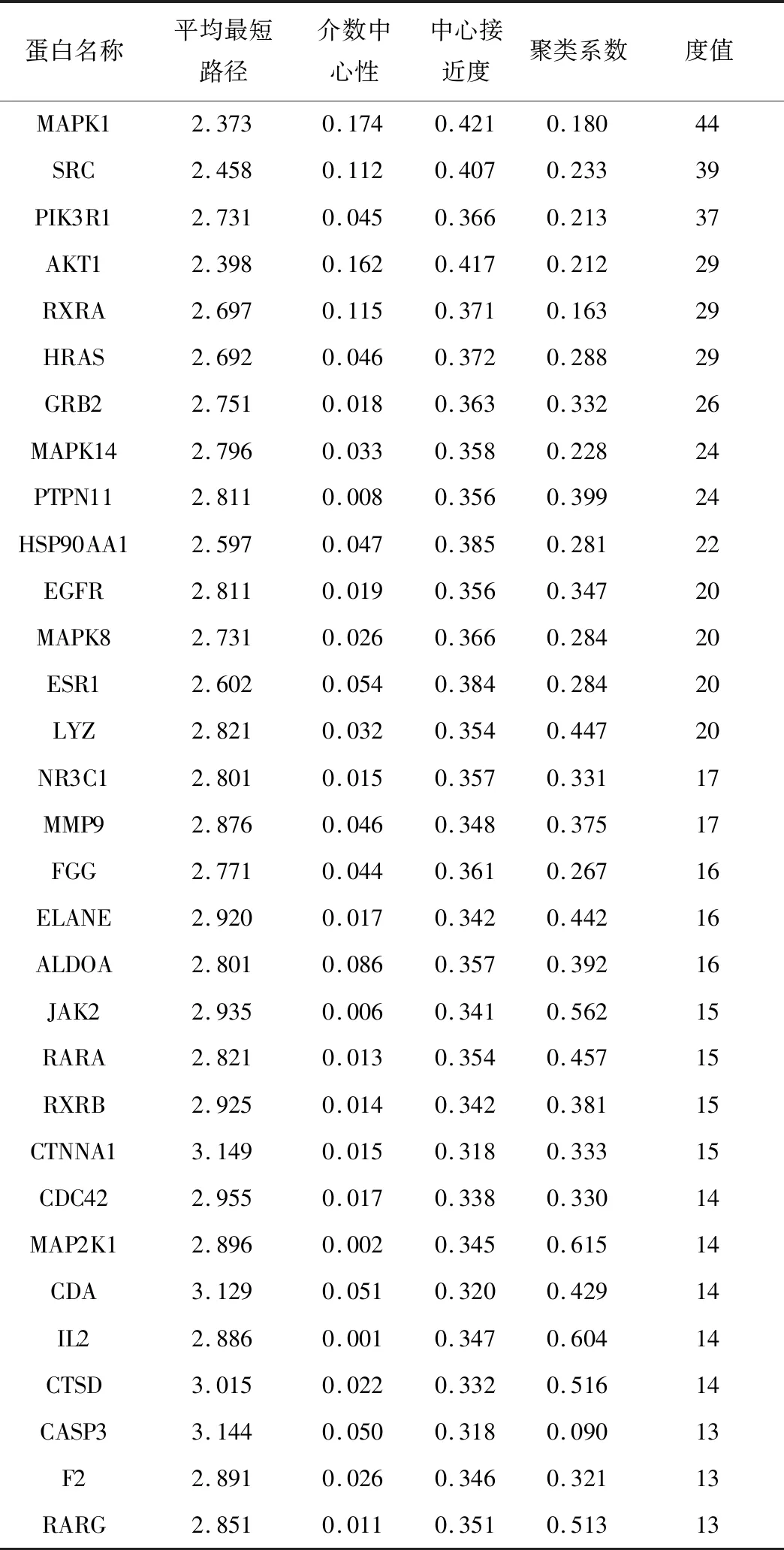
表1 人参皂苷Rg1蛋白互作拓扑学分析(度值排序前30个靶点)
图1 人参皂苷Rg1蛋白互作网络
2.2 AD相关靶点数据库构建及对比分析
在GeneCards、CTD数据库共筛选31 274个靶点,根据相关度每个数据库取前300个靶点组建AD相关靶点数据库,VENNY2.1软件从AD相关靶点与人参皂苷Rg1作用靶点两组数据中共得到45个共同靶点作为人参皂苷Rg1治疗AD的作用靶点。人参皂苷Rg1与AD相关发病机制靶点韦恩图,见图2。人参皂苷Rg1对AD作用靶点的PPI网络关系,见图3。人参皂苷Rg1对AD作用靶点的蛋白互作网络的拓扑学分析,见表2。经Network Analyzer分析网络拓扑学属性发现,该PPI网络中聚类系数为0.683,平均节点度为17.644,平均最短路径1.07~2.23,介数中心性在0~0.13。该45个共同靶点是人参皂苷Rg1与疾病作用的关键分子基础,并在关系网络中体现了较好的联通特性。其中,ALB、AKT1、MAPK1、CASP3、EGFR、MAPK8、MMP9、HSP90AA1、SRC、ESR1、MAPK14均可与25个及以上靶点相互联系,提示这些靶点可能是人参皂苷Rg1治疗AD的重要靶点。
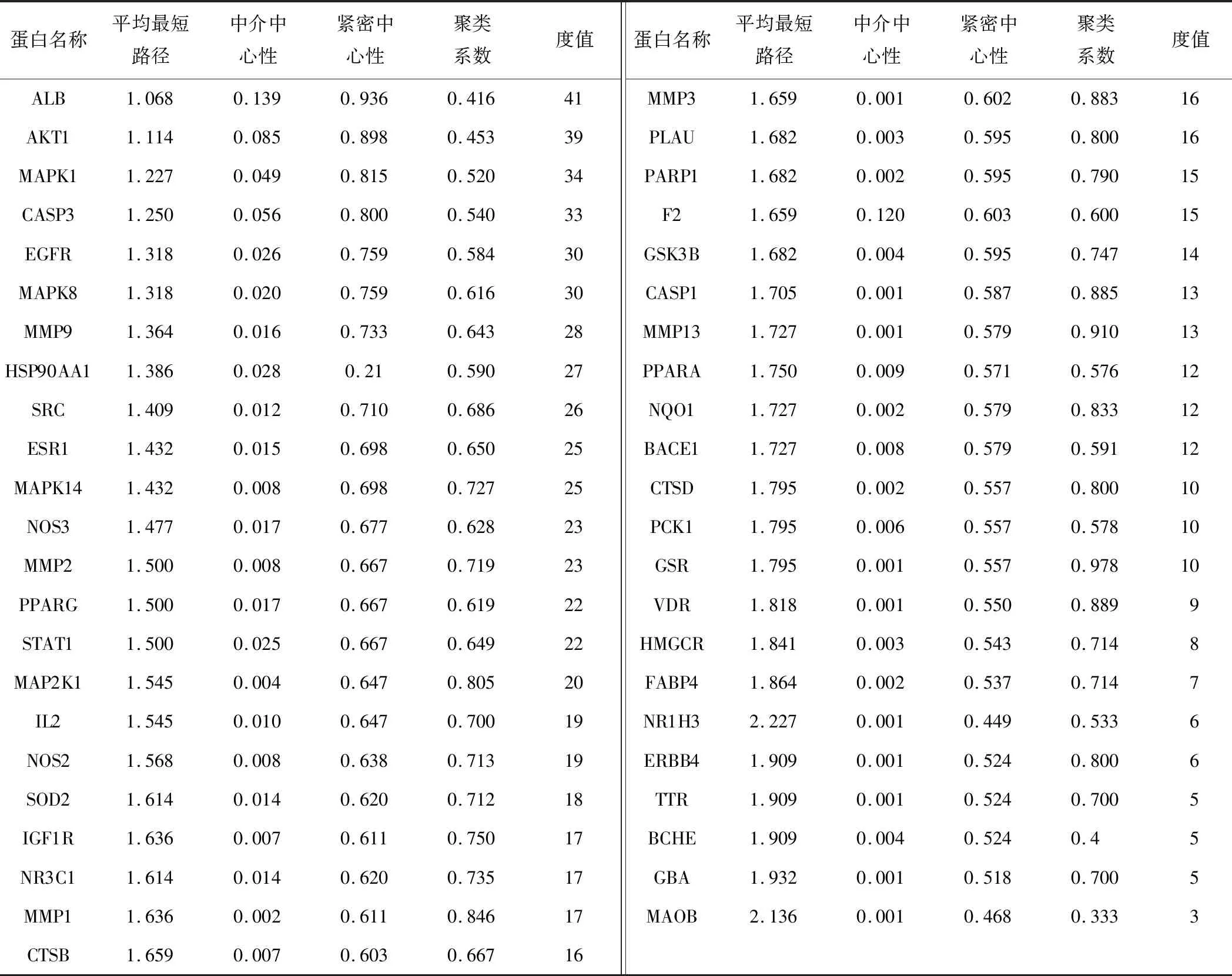
表2 人参皂苷Rg1对AD作用靶点的拓扑学分析
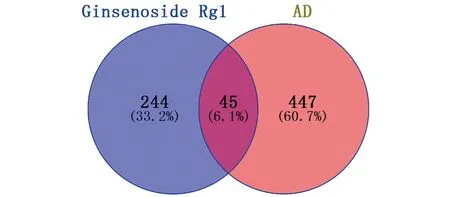
图2 人参皂苷Rg1靶点与AD相关发病机制靶点韦恩图
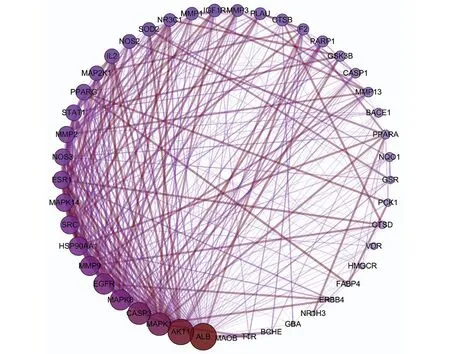
图3 人参皂苷Rg1对AD作用靶点的PPI网络关系
2.3 人参皂苷Rg1对AD作用靶点的GO富集分析与通路注释分析
根据1.4中的分析方法,GO富集分析在生物过程、分子功能、细胞成分三个方面,分别得到42个条目,24个条目,14个条目,分别取前10个条目做成可视化条形图,如图4。KEGG通路注释分析共分析出78条信号转导通路,将前20条通路做成可视化气泡图,如图5,其中涉及10条通路与AD相关,分别是Estrogen signaling pathway(雌激素信号通路)、Prolactin signaling pathway(催乳素信号通路)、ErbB signaling pathway(跨膜酪氨酸激酶信号通路)、FoxO signaling pathway(FoxO信号通路)、TNF signaling pathway(肿瘤坏死因子信号通路)、GnRH signaling pathway(促性腺激素释放激素信号通路)、HIF-1 signaling pathway(缺氧诱导因子-1)、VEGF signaling pathway(血管内皮生长因子信号通路)、PPAR signaling pathway(过氧化物酶体增殖物激活受体信号通路)、Insulin resistance(胰岛素抵抗)。
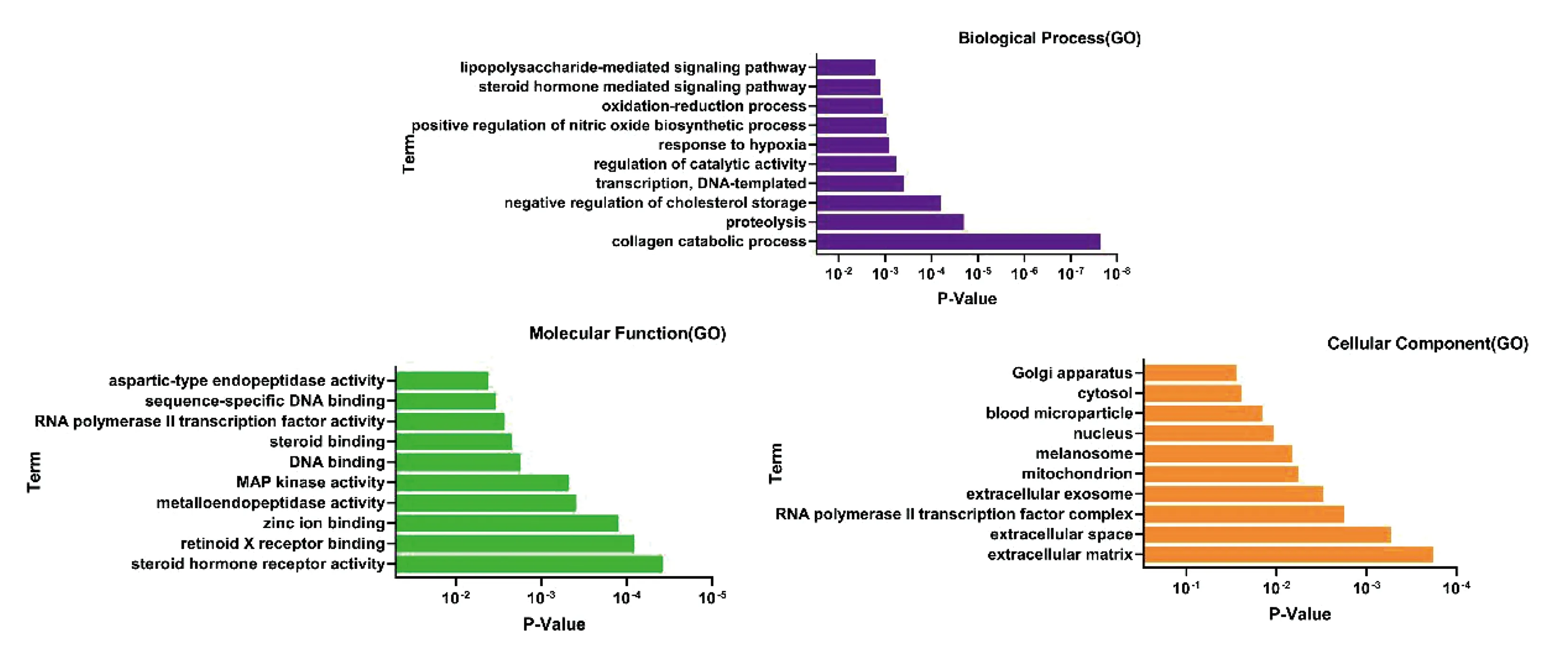
图4 人参皂苷Rg1对AD作用靶点的GO富集分析
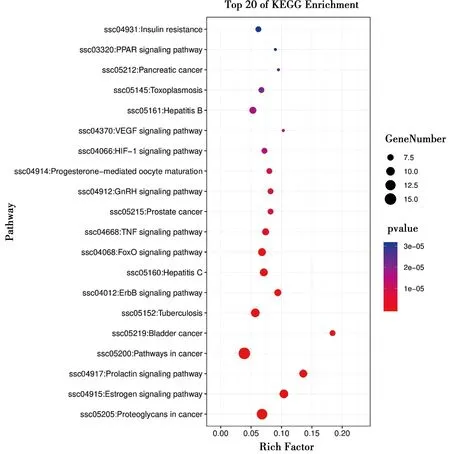
图5 人参皂苷Rg1对AD作用靶点的KEGG分析气泡图
3 分子对接结果
应用AutoDock软件对筛选出的人参皂苷Rg1与其作用AD的45个靶点进行对接,一般认为配体与受体的结合能越低,其结合构象越稳定,发生的作用可能性越大,本研究中,与人参皂苷Rg1结合能最低的蛋白分别为CTSB(结合能为-38.53 kJ/mol)、BCHE(结合能为-33.47 kJ/mol)、AKT1(结合能为-28.16 kJ/mol)。以-5 kJ/mol为评价标准,可知人参皂苷Rg1与CTSB、BCHE、AKT1、MMP3、EGFR、IL2、TTR、CTSD、NQO1、PPARG等41个靶点结合能均小于-5 kJ/mol,提示人参皂苷Rg1与预测的AD作用靶点有较好的结合活性。具体见表3,人参皂苷Rg1与结合能前6靶点的结合模式见图6。
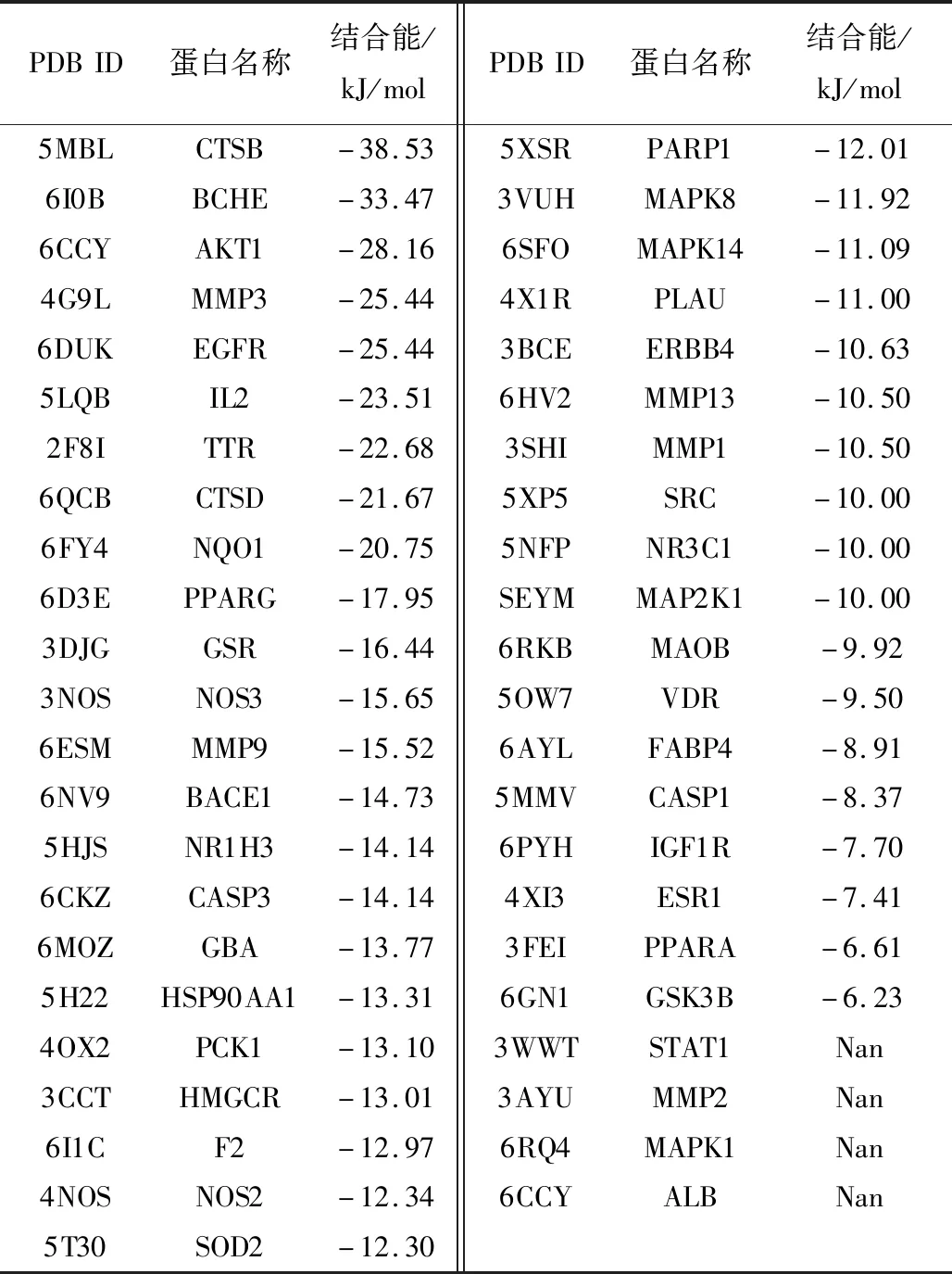
表3 人参皂苷Rg1对AD作用靶点分子对接结果
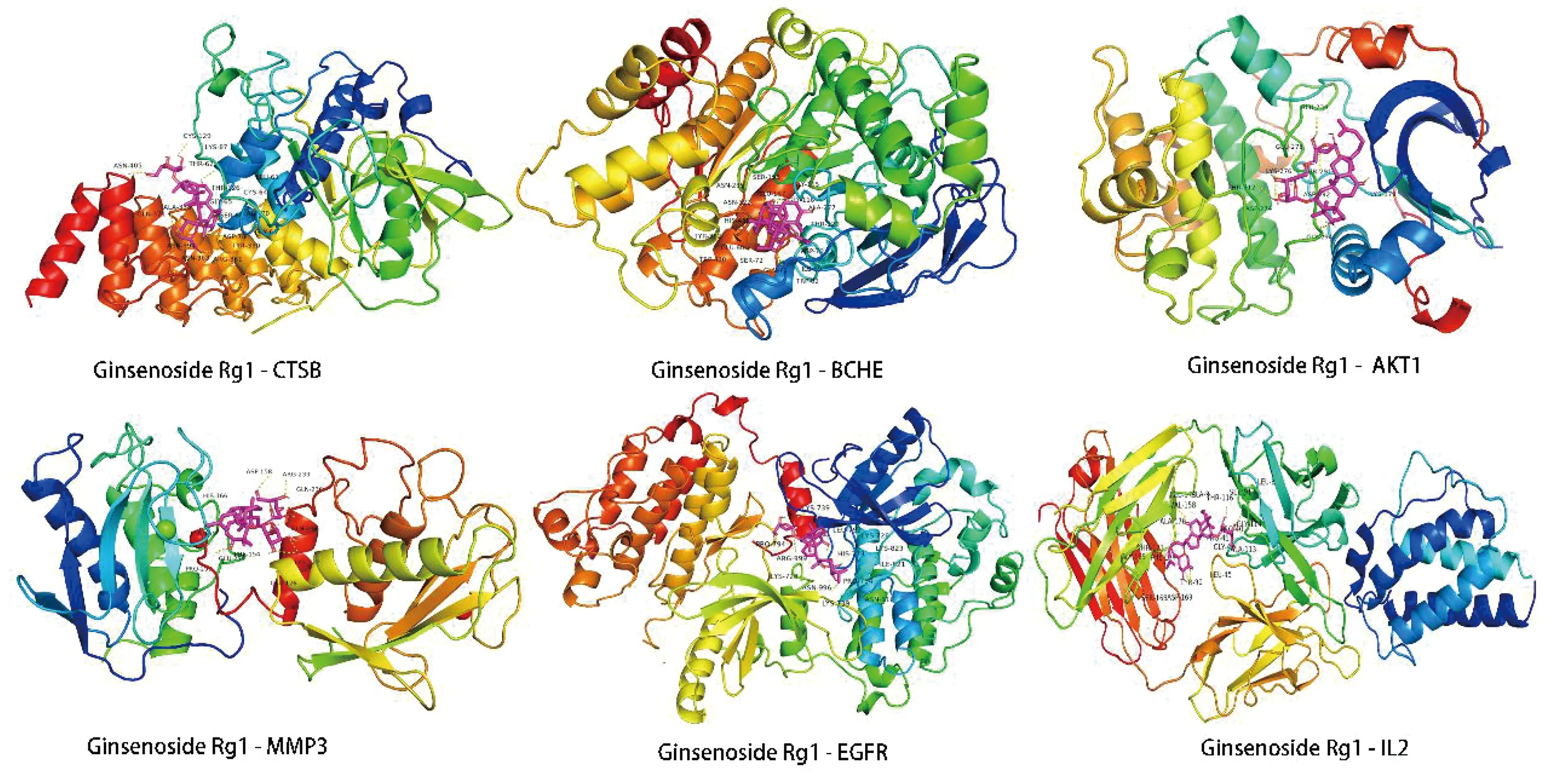
图6 人参皂苷Rg1与部分靶点分子对接模式
4 讨论
根据图1人参皂苷Rg1蛋白互作网络显示,通过筛选后得到284个人参皂苷Rg1潜在的靶点,其中highest confidence≥0.9靶点有203个,图3显示人参皂苷Rg1作用AD的靶点有45个。根据图4人参皂苷Rg1对AD作用靶点的GO富集分析发现,与细胞自噬相关的靶点有PPARG、STAT1、PPARA,其中,PPARA/α 是过氧化物酶体增殖物激活受体(PPAR)的一种转录因子,主要调节脂肪酸的代谢,Rongcan Luo等[9]研究发现PPARA激动剂有助于降低阿尔茨海默病模型小鼠海马和皮质组织中的β-淀粉样蛋白(Aβ)水平,促进小胶质细胞和星形胶质细胞向Aβ斑块附近募集以增强自噬反应,改善小鼠记忆力和焦虑症状。与血脂调节有关的靶点包括ESR1、NR3C1、NR1H3、PPARA、PPARG,Avik Roy等[10]通过他汀类药物与PPARA配体结合域结合后发现可激活PPARA介导的cAMP反应元件结合蛋白(CREB)的转录,以增加神经营养因子的表达,上调神经营养蛋白,改善阿尔茨海默病模型小鼠的神经营养功能及记忆力。与tau蛋白过度磷酸化相关的靶点有MAPK1、MAPK14、GSK3B,丝裂原激活蛋白激酶(MAPK)是一类丝氨酸/苏氨酸蛋白激酶,参与细胞的增殖、分化、凋亡等生物过程[11],p38MAPK的定位和激活与tau磷酸化呈正相关,其抑制作用是通过抑制p38抑制神经元细胞中的Tau病理学、降低Aβ诱导的神经毒性的化合物以对Aβ诱导的神经元损伤起到神经保护作用、抑制小胶质细胞和星形胶质细胞中的p38MAPK途径减少神经炎症、抑制p38改善神经突触可塑性等途径减轻AD症状[12]。此外,通过GO富集分析可知,与脑代谢有关的靶点包括MMP9、CTSB、MMP2、MMP13、MMP1,与炎性反应有关的靶点有PPARA、IL2、NR1H3,与氧化应激有关的靶点NOS3、SOD2、NOS2,与细胞凋亡相关的靶点有IGF1R、CASP3、ALB、GSK3B、MMP9、SRC,与昼夜节律性相关的靶点有PPARA、PPARG、GSK3B、NOS2。
如图5所示,对人参皂苷Rg1作用AD的45个靶点进行KEGG通路注释分析。得到10条通路与AD相关。雌激素为一种性激素,已有研究表明,机体内雌激素水平与AD的发病率有明显有关[13]。雌激素可通过调控ERs转录因子启动基因转导,减少Aβ生成,增加Aβ降解、抑制tau蛋白累积及异常磷酸化或激活MAPK信号通路等途径发挥神经元保护作用,在防治AD方面具有一定前景[14]。PPARs由PPARα、PPARβ和PPARγ三种亚型组成,是调节靶基因表达的核内受体转录因子超家族成员之一,Lourenco等研究表明, PPARγ激活后可直接与类视黄醇X受体(RXR)结合促进RXR蛋白的基因转录表达以调节小胶质细胞功能,增强对Aβ的吸收,亦可调节PPAR基因表达激活ERK/MAPK信号转导以促进小胶质细胞吸收Aβ,此外,还可通过提高胰岛素敏感性,减轻炎症反应等途径改善AD认知功能[15]。血管内皮生长因子(VEGF)具有促进血管内皮细胞增殖、神经营养和保护神经元的作用,广泛参与在神经系统疾病的发病过程[16]。研究表明,VEGF可通过促进血管生成、保护血管完整性以抑制Aβ诱导的内皮细胞凋亡,从而改善AD模型的记忆行为[17]。此外,VEGF还可通过关联PI3K/AKT信号通路、HIF-1α、FoxO3a等途径抑制Aβ诱导的细胞凋亡、抑制tau蛋白过度磷酸化、抑制内皮细胞凋亡、保护神经元[18]。VEGF信号通路与ErbB信号通路相互交叉,属VEGF超家族家员之一的神经调节蛋白-1(Nrg1)可通过与ErbB蛋白受体酪氨酸激酶结合进行多种生物学过程。上调Nrg1-ErbB信号通路可通过抑制氧化应激、减轻细胞凋亡、抵抗Aβ的积累等途径在AD的发病过程中起到保护神经元的作用[19]。
本研究基于网络药理学对人参皂苷Rg1在治疗AD的作用机制进行探讨,发现人参皂苷Rg1可能通过作用于CTSB、BCHE、AKT1、MMP3、EGFR、IL2等45个与AD相关的潜在靶点,调节细胞自噬、保护神经元、营养神经、抑制细胞凋亡、减少炎症反应、抗氧化应激、改善脑代谢等多种途径以减少Aβ的积累、抑制tau蛋白累积及异常磷酸化、减轻内皮细胞及神经元损伤发挥改善AD症状的作用。而分子对接结果提示人参皂苷Rg1与其作用AD的靶点结合活性较好,为本研究预测的真实性提供科学依据。
