三维超分辨荧光和形貌显微镜联用系统的研制
2020-02-29周露露蔡明军王慧利王宏达
周露露 蔡明军 王慧利 王宏达


摘 要 搭建了一种联用超分辨荧光和三维形貌显微成像系统(Correlative super-resolution fluorescence and three-dimensional topography imaging microscopy),以聚合纤维状肌动蛋白(F-actin)为例,评价了此联用系统的性能。实验结果表明,此联用仪器具有纳米级分辨率的三维形貌及具体成分的定位分布成像功能,可实现在形貌图中定位具体成分的功能,表明此联用仪器可应用于研究分析细胞骨架及细胞亚结构(如细胞膜蛋白质聚集体的组成和分布特性等)方面, 此联用系统在生命科学和材料科学等领域具有广泛的应用前景。
关键词 超分辨荧光显微镜;原子力显微镜;联用
1 引 言
原子力显微镜(Atomic force microscopy, AFM)通过检测针尖和样品间微弱的相互作用力获取样品表面的各类信息[1],是研究生物样品的有力工具,具有独特的优势,如高分辨率(X、Y轴侧向分辨率为纳米级,Z轴垂直分辨率高达0.1 nm),无需对样品进行固定染色处理,可以在溶液或近似生理环境中对生物样品成像。然而,AFM因缺乏特异性标记,难以提供分子种类的信息。超分辨荧光显微镜(Super-resolution fluorescence microscopy, SRM)[2,3]是一类光学成像技术的总称,根据成像原理可分为两类:一类是基于特殊强度分布照明光场的超分辨显微成像,如受激发射损耗显微镜(Stimulated-emission depletion, STED)[4]和结构光照明显微镜(Structure illumination microscopy, SIM)[5]; 另一类是基于单分子定位技术成像的超分辨率荧光显微成像,如光激活定位显微镜(Photoactivated localization microscopy, PALM)[6]和直接随机光学重构显微镜(Stochastic optical reconstruction microscopy, dSTORM)[7]。SRM突破了传统光学显微镜的光学衍射极限,其成像分辨率低至10 nm,为生物样品的研究提供了有利力的分析手段。此外,超分辨成像技术可通过结合多色标记方法实现对多种成分的同时定位,可用于研究分析不同成分间的相互作用[8]。然而,SRM在三维形貌成像和Z轴垂直分辨率方面仍有明显不足。
虽然AFM和SRM均是先进的单分子成像技术,为单分子水平研究提供了强有力的技术支撑,但这两种成像技术均存在自身的局限性,无法用于更复杂的生物学体系,如直接观察研究细胞膜上的蛋白聚集体的组成成分及这些成分间的相互作用关系等。近年来,为了克服单个仪器的技术限制,获取有关样品的更综合全面信息,研究者致力于两种及两种以上仪器间联用系统的研发[9,10]。由于AFM和SRM成像技术均能够在单分子水平及生理条件下实现对生物样品的成像,而且SRM可弥补AFM缺乏特异性标记的固有缺点,联用AFM-SRM的显微镜成为仪器研发的热点领域。Diaspro研究组搭建了AFM-STED及AFM-STORM联用显微镜,并对细胞上的微管进行了联用成像[11,12]; Fang研究组将AFM和STED联用,实现了对细胞丝状伪足同步采集AFM和STED图像[13]; Odermatt等搭建了AFM-PALM联用系统并用于活细胞成像[14]。这些研究结果表明,AFM和SRM的联用有助于获取更综合和互补的信息,从而能够更加深入地获取样品信息。近年来,本研究组分别利用AFM和dSTORM成像技术对细胞膜的组织结构进行了研究[15~18],但由于AFM和SRM各自的局限性,一些复杂的细胞膜相关问题(如膜蛋白聚集体的组成成分及聚集体中成分间的相互作用关系等)无法通过单独的AFM或SRM成像技术解决。
为实现在细胞膜形貌图中对多种蛋白分子的精确定位,进而实现对膜蛋白聚集体的具体组成成分和成分间相互作用关系的研究,选择分辨率最高的超分辨荧光显微镜dSTORM和AFM搭建联用显微镜。本研究构建了三维超分辨荧光和形貌显微镜联用系统,可以实现两种成像技术对同一样品的联用成像,并优化了仪器结构,通过对体外聚合纤维状肌动蛋白(F-actin)的联用成像,考察了此联用仪器的性能。本研究为后续利用AFM-dSTORM联用显微镜在单分子水平及近似生理环境的条件下同时将多种蛋白分子的精确定位与整体的细胞膜形貌关联,进而定量研究细胞膜上的蛋白聚集体提供了技术支撑。
2 实验部分
2.1 仪器与试剂
自行搭建的三维超分辨荧光和形貌显微镜联用系统; 5500扫描探针显微镜(美国Agilent公司); Ti-E倒置光学显微镜(日本Nikon公司); DNP-S型AFM探针(美国Bruker公司); CFI Apo TIRF 100×物镜(日本Nikon公司); iXon Ultra 888型EMCCD相机(英国Andor公司); MDL-Ⅲ-405 nm-100 mW半导体激光器、MRL-FN-639 nm-500 mW固态激光器、MGL-FN-532 nm-500 mW固态激光器(长春新产业光电技术有限公司); AOTFnC-400.650声光调谐滤波器(法国AA Opto Electronic公司); ZT405/488/532/640rpc-XT二向色镜、ZET532/640m发射滤光片、ET700/75m带通滤光片(美国Chroma公司); FF01-559/34带通滤光片(美国Semrock公司)。
HCl(36%~38%)、MgCl2(北京化工厂); 3-氨基丙基三乙氧基硅烷(3-Aminopropyltriethoxysilane, APTES)、N,N-二异丙基乙胺(N,N-diisopropylethylamine)、戊二醛(25%)、NaBH4、EGTA、咪唑、葡萄糖、葡萄糖氧化酶(190 units/mg)、過氧化氢酶(12000 units/mg)、 β-巯基乙醇(美国Sigma Aldrich公司); 牛血清白蛋白(BSA)、Tris碱(美国Genview公司); Alexa647标记的鬼笔环肽(美国Invitrogen公司); 肌动蛋白聚合试剂盒(BK003,美国Cytoskeleton公司); 除特定标注的试剂外,其余试剂纯度均大于98%。
2.2 实验方法
2.2.1 肌动蛋白(Actin)的聚合 根据试剂盒中的说明书,将游离球状肌动蛋白(G-actin)在体外聚合, 形成纤维状肌动蛋白(F-actin)。首先将1 mg Actin冻干粉溶解于100 μL无菌水中,并等分为20份, 20℃保存备用。取一支Actin等分试样,加入45 μL常规肌动蛋白缓冲液稀释至1 mg/mL,最后加入5 μL 10×肌动蛋白聚合缓冲液,在室温下反应2 h,获得F-actin储备液。储备液可在4℃下稳定保存1个月。
2.2.2 聚合纤维状肌动蛋白(F-actin)的联用成像 用缓冲液A(2 mmol/L MgCl2, 1 mmol/L EGTA, 20 mmol/L 咪唑-HCl, pH 7.6)将F-actin稀释至10 μg/mL。取200 μL稀释液,在APTES修饰的盖玻片上沉积5 min,并用缓冲液A清洗; 用2%(w/V)戊二醛固定15 min; 用新制备的0.1%(w/V)NaBH4处理样品7 min,减少由戊二醛固定产生的背景荧光。将盖玻片安装在联用仪器的样品池中,加入缓冲液A,进行AFM成像。成像后,取下样品池,先用4%(w/V)BSA封闭样品15 min,再用Alexa647标记的鬼笔环肽在室温下避光特异性标记F-actin 1 h,接着用缓冲液A清洗,最后, 在样品池中加入dSTORM成像缓冲液(50 mmol/L Tris-HCl(pH 7.5)、 10 mmol/L NaCl,10%(w/V)葡萄糖、0.5 mg/mL葡萄糖氧化酶、40 μg/mL过氧化氢酶和1%(V/V)β-巯基乙醇),并对相同区域进行dSTORM成像。
2.2.3 AFM和dSTORM圖像间的匹配 参考文献[14]的方法,通过对dSTORM的原始坐标点进行仿射变换(平移、缩放、旋转和剪切), 实现AFM和dSTORM图像之间的配准,采用自行编辑的MATLAB程序优化仿射变换参数及图像配准。
3 结果与讨论
3.1 联用仪器装置
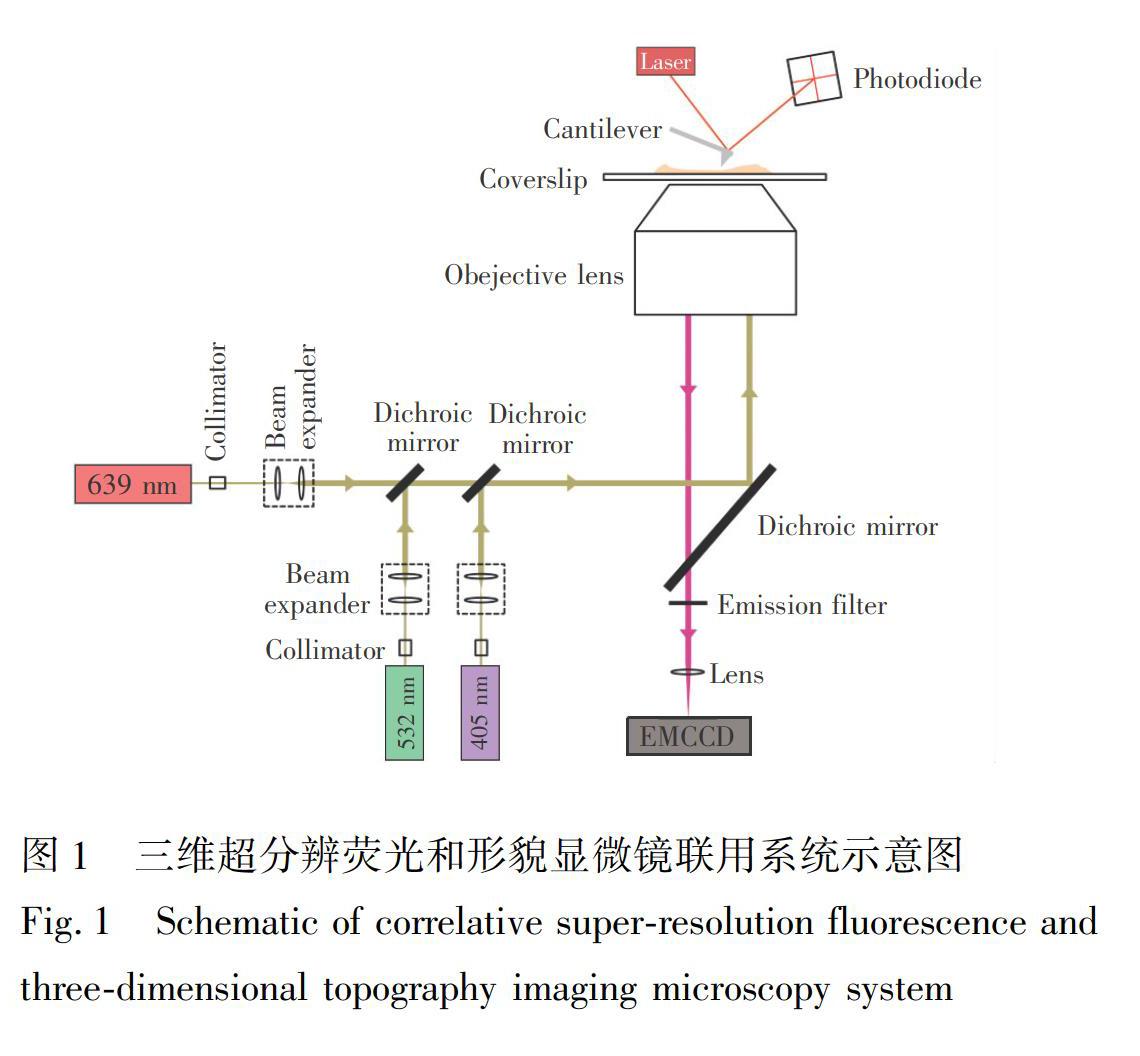
三维超分辨荧光和形貌显微镜是由一台原子力显微镜AFM 5500和一台倒置光学显微镜Ti-E组合搭建而成,如图1所示。对于AFM成像模块,利用Si3N4探针DNP-S中的D针(弹性常数为0.06 N/m)在AAC(Acoustic AC)模式下对生物样品在溶液中成像,以实现在近似生理条件下对生物样品的无损高分辨成像。dSTORM成像模块主要由1台倒置光学显微镜Ti-E配有100倍TIRF物镜(数值孔径为1.49)、3台激光器(639、 532、 405 nm)、1个声光调谐滤波器(用于调节激光的开关与强度)、1个EMCCD相机及相应的二向色镜、滤光片、透镜构成。为进行dSTORM成像,首先需更换相应滤光片:二向色镜ZT405/488/532/640rpc-XT、发射滤光片ZET532/640m、带通滤光片ET700/75m(针对639 nm激发通道)和FF01-559/34(针对532 nm激发通道)以及设置采集参数(曝光时间20 ms,EM增益300,图片采集帧数10000),之后用639 nm或532 nm激光(~2 kW/cm2)激发样品, 并同时用405 nm激光(0~1 W/cm2)激活荧光基团。此外,为实现对样品的相同区域进行AFM和dSTORM成像,需调节dSTORM光路,使其与AFM探针的针尖相匹配。
AFM成像时,用PicoView 1.12软件(美国Agilent公司)采集512 × 512像素的原始数据,并用Gwyddion软件[19]处理分析,以获取矩阵数据。dSTORM成像时,用Micromanager软件采集原始图片序列,并对其用ThunderSTORM软件[20]处理,以获取所有合格定位点的信息(如坐标、不确定度)。将原始AFM矩阵数据和dSTORM定位点数据导入MATLAB配准程序中,实现AFM和dSTORM图像间的精细匹配。
3.2 聚合纤维状肌动蛋白的联用成像
为了考察三维超分辨荧光和形貌显微镜联用仪器的性能,采用G-actin在体外聚合形成的F-actin为测试样品,进行联用成像。如图2A所示,左侧图像为AFM形貌图,显示了一些纤维状凸起物及一些球形颗粒。根据文献[21]中报道的肌动蛋白结构,推测这些纤维状凸起物和球形颗粒分别为聚合F-actin和游离G-actin。此外,从AFM图像(如图2A左图)中观察到具有不同高度及宽度的纤维状凸起物,推测这是由于F-actin的聚合程度不同引起的。为测定AFM-dSTORM联用系统中的AFM成像模式能否提供高分辨图像,本研究选择宽度细小的低聚F-actin(如图2A左图中的白色箭头)及粒径小的游离G-actin(如图2A左图中的蓝色箭头)进行高度及半峰全宽的测定,并与文献[21]中报道的肌动蛋白尺寸进行比较, 以确定AFM成像的分辨率。通过对箭头处低聚F-actin和游离G-actin进行高度分布分析及高斯分布拟合,获得的低聚F-actin的高度及半峰全宽为10和30 nm(图2B上图),游离G-actin的高度及半峰全宽为7 和16 nm(图2B下图)。对比文献[21]中报道的单个G-actin直径(5.5 nm)及单聚F-actin直径(8 nm),发现箭头处的G-actin和F-actin的半峰全宽虽然由于AFM探针针尖的加宽效应而大于文献中报道的肌动蛋白尺寸,但测定的高度与文献[12]中肌动蛋白尺寸相符,因此,本联用系统中的AFM成像可实现对肌动蛋白的高分辨成像。图2C左侧图像为dSTORM图像,显示了特异性标记蛋白F-actin的分布,右侧图像为放大图,更清晰地揭示了F-actin的分布及聚合程度。为测定联用系统中的dSTORM成像分辨率,选择宽度细小的低聚F-actin区域(如图2C右图中的白色线条),并对其荧光强度分布进行高斯拟合,以测定F-actin的半峰全宽。如图2D所示,dSTORM图中所测得的低聚F-actin的半峰全宽为20~30 nm,比单聚F-actin的直径(8 nm)大,表明联用系统中的dSTORM成像可达到约20 nm的分辨率,与文献[14, 22]中报道的dSTORM分辨率(20 nm)相当。上述结果表明,搭建的联用仪器可实现dSTORM的超分辨荧光成像。
为了将具体蛋白F-actin的分布精确定位到对应的三维形貌图中,需将形貌图中肌动蛋白的结构与基底区分。如图2A所示,通过设置阈值(基底的高度),可区分基底和肌动蛋白结构。为方便后续图像匹配优化,将小于等于阈值的高度值定义为0,即h=0代表基底; 将大于阈值的高度值减去阈值,即h值代表肌动蛋白的高度,且h>0代表肌动蛋白的结构。将提取的肌动蛋白三维结构与具体蛋白F-actin的分布导入MATLAB配准程序中,并根据AFM和dSTORM图中F-actin的结构,优化仿射变换参数以实现精确定位。如图3A所示,左侧图像为AFM形貌图,通过阈值扣除法将F-actin结构(红色区域)与基底(黑色区域)分割出来; 中间图像为经仿射变换后的dSTORM图像,展示了特异性标记蛋白F-actin的空间分布; 右侧图像为AFM形貌图和经仿射变换后的dSTORM图像间的叠加图,显示出具体蛋白F-actin在形貌图中的定位分布情况, 表明利用dSTORM成像得到的特异性标记蛋白F-actin的分布与AFM形貌图中的纤维状结构重叠,证明AFM-dSTORM联用显微镜能够将特定蛋白分子精确定位到AFM形貌图中。为进一步定量分析AFM和dSTORM图间的匹配效果, 通过比较dSTORM定位点出现在基底处(h=0)以及F-actin处(h>0)的几率来确定以及优化这两种图像间的重叠程度,即比较h=0及h > 0处的dSTORM定位点密度。如图3B所示,h > 0处的dSTORM定位点密度为2353 μ2,而h=0处的dSTORM定位点密度只有318 μm2,表明dSTORM定位点出现在F-actin处的几率大于出现在基底处,即證明AFM和dSTORM图像间的重叠程度很好。综上,此联用仪器可实现在单分子水平上对具体成分的空间分布和整体形貌间的关联分析。
4 结 论
搭建了三维超分辨荧光和形貌显微镜联用系统,用聚合纤维状肌动蛋白(F-actin)作为典型的样品,证明此联用系统可以提供高分辨率的AFM形貌图和dSTORM重构图(水平分辨率约20 nm米,形貌图的垂直分辨率高达0.1 nm),也证实此联用系统能够在整体形貌图中精确定位具体蛋白的分布。此AFM-dSTORM联用系统为单分子水平研究解析细胞膜蛋白聚集体组分及其形成机理提供了新的分析手段。此外,此AFM-dSTORM联用系统也可应用于其它领域的研究,如材料精细结构和缺陷的分析以及生物活性分子与细胞的相互作用等。
References
1 Binnig G, Quate C F, Gerber C. Phys. Rev. Lett., 1986, 56(9): 930-933
2 Hell S W, Sahl S J, Bates M, Zhuang X, Heintzmann R, Booth M J, Bewersdorf J, Shtengel G, Hess H, Tinnefeld P, Honigmann A, Jakobs S, Testa I, Cognet L, Lounis B, Ewers H, Davis S J, Eggeling C, Klenerman D, Willig K I, Vicidomini G, Castello M, Diaspro A, Cordes T. J. Phys. D: Appl. Phys.,2015,48(44): 443001
3 Tam J, Merino D. J. Neurochem.,2015,135(4): 643-658
4 Hein B, Willig K I, Wurm C A, Westphal V, Jakobs S, Hell S W. Biophys. J.,2010,98(1): 158-163
5 Li D, Shao L, Chen B-C, Zhang X, Zhang M, Moses B, Milkie D E, Beach J R, Hammer J A, III, Pasham M, Kirchhausen T, Baird M A, Davidson M W, Xu P, Betzig E. Science,2015,349(6251): aab3500
6 Betzig E, Patterson G H, Sougrat R, Lindwasser O W, Olenych S, Bonifacino J S, Davidson M W, Lippincott-Schwartz J, Hess H F. Science,2006,313(5793): 1642-1645
7 Pan L, Yan R, Li W, Xu K. Cell Rep.,2018,22(5): 1151-1158
8 Bates M, Huang B, Dempsey G T, Zhuang X W. Science,2007,317(5845): 1749-1753
9 Hauser M, Wojcik M, Kim D, Mahmoudi M, Li W, Xu K. Chem. Rev.,2017,117(11): 7428-7456
10 Smith C. Nature,2012,492(7428): 293-297
11 Chacko J V, Zanacchi F C, Diaspro A. Cytoskeleton,2013,70(11): 729-740
12 Harke B, Chacko J V, Haschke H, Canale C, Diaspro A. Opt. Nanoscopy,2012,1(1): 1-6
