盐桥的构成及工作原理
2020-02-29王笃年特级教师
王笃年(特级教师)
问题1为什么要把单液电池发展为双液电池?
主要原因是单液电池不具有商品性.试想,把一个Zn-Cu-H2SO4单液电池摆在商店里待售,将是一种怎样的局面?即使在外电路断开的状态下,只要一天里没有卖出,锌电极就会反应掉大半.电池尚未用来发电,电池材料已经消耗得差不多了,还能够卖出去吗?双液电池就不同了,只要不接通电路,待售期间是基本不会损耗电池材料的.可以对照双液电池示意图对此结论加以理解.至于其他的一些“貌似合理”的解释,比如“双液电池比单液电池的电压稳定、电流持久”等,这些只是理论分析的结果.通过实际实验可以发现,构成材料接近的单液、双液两种电池一旦接通电路,除了双液电池输出电压略低于单液电池输出电压外(盐桥的存在导致内阻变大),在其他方面二者并无很大差异.
问题2盐桥中的电解质离子会不会耗尽?

“这样,盐桥内的离子岂不乱了?”的确,随着使用时间的延长,盐桥内不再单纯是原来溶解在琼胶里的电解质了,但这并不妨碍它起到平衡两极电势的作用,所以“乱了”又有什么关系呢?
问题3盐桥里的电解质一定要用KCl吗?换别的电解质行不行?
根据对问题2的分析可知,盐桥内使用什么电解质,并没有严格的规定.但有些教科书里说“K+与Cl-扩散速率差异小”,这个看似合理的解释,其实并没有什么科学道理.当然,在实用性电池里,为了尽可能减小电池的内电阻,电解质的选择还是非常重要的.
问题4用导线替代盐桥,电路中是否仍然会有电流?
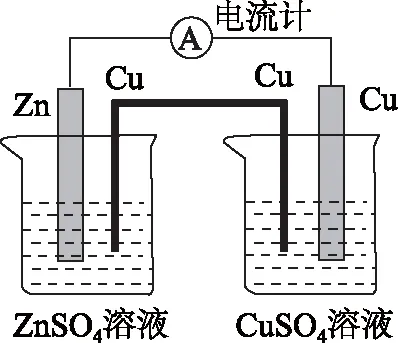
图1
实验的结果是,一般仍会有.让我们以铜锌电池为例,将盐桥更换为铜导线,如图1所示.分析如下:
将盐桥更换为Cu导线后,整个装置的性质发生了改变.左侧成为一个新的铜锌原电池——以锌的吸氧腐蚀为基础反应,负极是Zn,发生Zn-2e-=Zn2+的氧化反应;正极则发生O2+4e-+2H2O=4OH-的还原反应.而右侧则变为以铜为电极电解CuSO4溶液的电解池装置.左侧的铜为阳极,发生Cu-2e-=Cu2+的氧化反应,右侧为阴极,发生Cu2++2e-=Cu的还原反应.
实测的电流方向,与上述分析完全一致.将盐桥更换为Zn导线的情况,请大家自行画图分析.
问题5为什么实用电池里没有看到盐桥?
的确,实用电池里并不存在盐桥,因为盐桥被电阻小得多的“离子交换膜”代替了.请看如图2所示的两个装置.
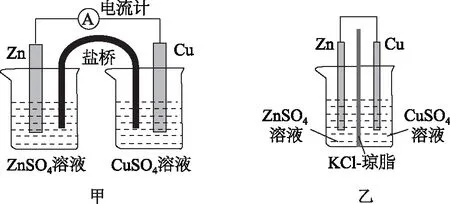
图2
这两个装置中,电极材料、电解质溶液种类和浓度分别对应一致,唯一不同之处就是左侧使用常规的盐桥,而右侧只使用薄薄一层含KCl的琼胶(与左侧盐桥内成分完全一致)分隔开正、负两极.
根据物理学原理可知,左侧电池的内阻远大于右侧.这样,在电池电动势相同的情况下,左侧电池的输出电压就低于右侧.人们当然不希望浪费电池的电动势,所以就设法缩短“盐桥”、降低电池内阻.最终盐桥越来越薄,演变为离子交换膜.早期的实用电池用的是强度较大的牛皮纸,现在逐步被各种有机合成材料的薄膜替代了,这就是为什么我们在各种实用电池内看不到盐桥的原因.
