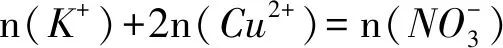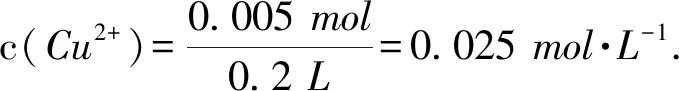“图象法”结合“电解复原”解决电化学的计算问题
2020-02-29杜博
杜 博
电化学的计算是学生高三复习的一大难题,一般情况下,教师习惯将常见的知识分门别类地帮学生整理好,将电解方程式分别归纳整理,有些教师意识到可以用数形结合来解决具体问题.笔者在这里介绍一种使用数形结合的思路,对于高三年级复习电解有一定的帮助.
1 模型建构
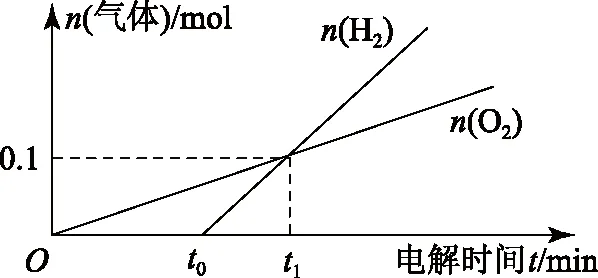
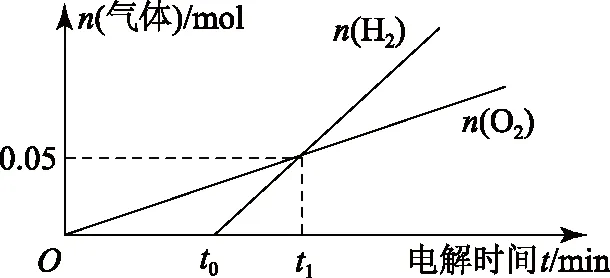
提出问题:用惰性电极电解一定体积1mol·L-1的CuSO4溶液,画出两电极生成气体的物质的量和通电时间之间的关系.
阳极:随着电解过程的进行,一直是水中OH-放电,电极反应方程式为4OH--4e-=O2↑+2H2O;促进水的电离平衡H2OH++OH-,在阳极生成H+.
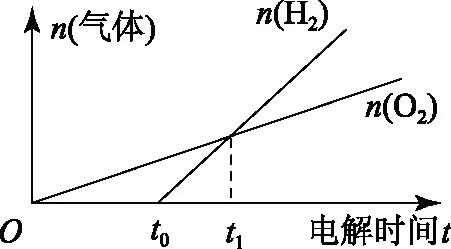
图1
阴极:随着放电过程的进行,Cu2+浓度逐渐下降到零(这里只讨论理论情形,实际情况要复杂得多),随后溶液中H+开始放电,发生反应2H++e-=H2↑.由于转移相同电子时,生成氢气的量要多于生成氧气的量,可作出如图1所示的图象.
在t1时刻,生成的氢气和氧气相等,此时生成的单质n(Cu)∶n(H2)∶n(O2)=1∶1∶1,按照物料守恒,即可用Cu(OH)2或者n(CuO)∶n(H2O)=1∶1的混合物复原,此时转移电子的物质的量n(e-)=4n(O2)=2[n(Cu)+n(H2)].各个时刻情况讨论如表1所示.
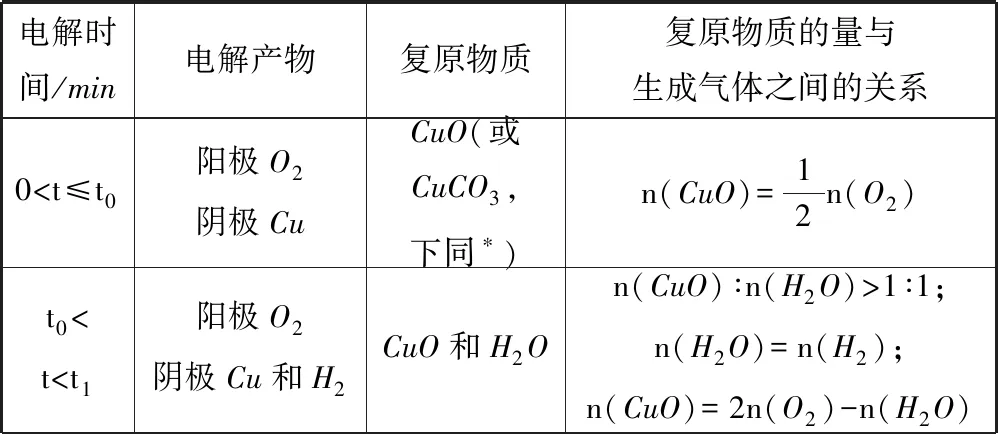
表1
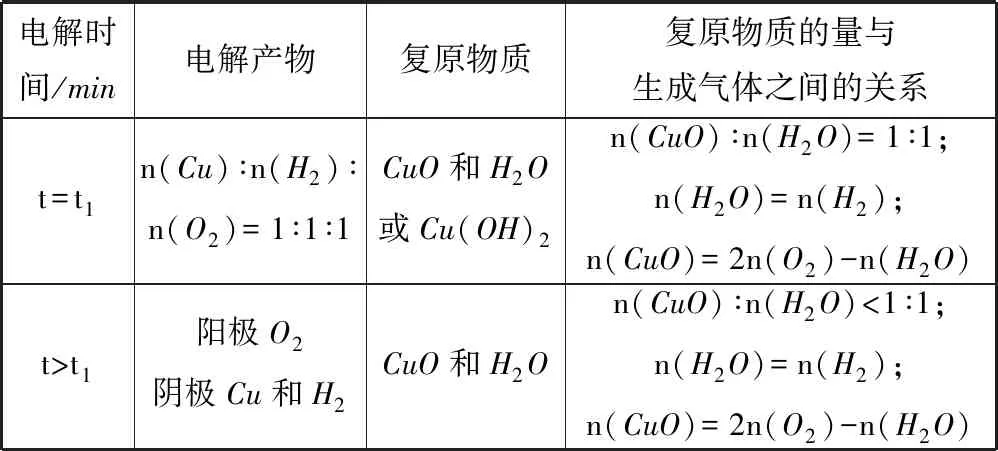
续表
可以画出下列直观分析图象:
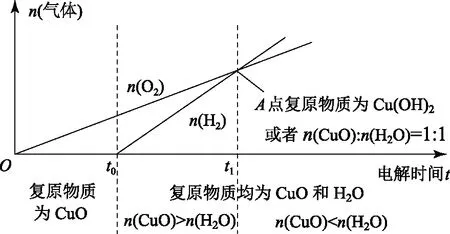
图2
在A点处有如下结论:
1)此时电极产物中,
n(Cu)∶n(H2)∶n(O2)=1∶1∶1;
2)复原物质可以只是Cu(OH)2或者按照n(CuO)∶n(H2O)=1∶1进行投料复原.
进行电解复原问题分析时,先分析两极生成气体的情况,将需要还原溶液的物质写成n(CuO)∶n(H2O)的形式,确定所给定的情况是位于哪个时间段.由于阳极产物单一,可以先确定阳极产物(氧气)的物质的量,据此计算整个过程中转移电子的物质的量.再依据电子守恒n(e-)=2n(Cu)+2n(H2)=4n(O2),计算含铜物质的量和氢气的物质的量.
注意:也可以用碳酸铜代替氧化铜,碳酸根离子反应后会释放二氧化碳,实际上只有一个氧原子能进入溶液中.
2 案例运用

A.CuSO4B.H2O
C.CuOD.CuSO4·5H2O


(1)原溶液的浓度为多少?
(2)电解过程中生成了标准状况下的气体体积共多少?
(3)电解过程中转移电子的物质的量为多少?

(2)在t0 (3)转移电子的物质的量,可直接由第(2)问生成的氧气直接求得,即n(e-)=n(O2)=0.15×4mol=0.6mol,也可按照复原物质的情况求解,即 n(e-)=2n(Cu)+2n(H2)=2n(CuO)+2n(H2O)= A. 原混合溶液中c(K+)为0.2mol·L-1 B. 上述电解过程中共转移0.2mol电子 C. 电解得到Cu的物质的量为0.05mol D. 电解后溶液中c(H+)为0.2mol·L-1 图3 图4 图5 复原类问题可以作为一个工具帮助学生以较快的速度解决电化学中的一些计算问题,运用守恒和数形结的思想,体现化学学科的核心素养.
0.2mol×2+0.1mol×2=0.6mol.