雌激素依赖性子宫病变中脂联素及炎性因子的表达*
2020-02-29孟凡萍郝坡
孟凡萍, 郝坡
1重庆三峡中心医院检验科(重庆 404000); 2重庆三峡医药高等专科学校医学技术学院(重庆 404020)
雌激素依赖性子宫病变包括子宫内膜异位症(endometriosis,EMS)、子宫肌瘤(uterine myoma,UM)以及子宫内膜癌(endometrial cancer,EMC)等。雌激素对于子宫病变是一种促进因素,研究指出,在激素依赖性肿瘤,如乳腺癌、子宫内膜癌、前列腺癌等疾病中,有胰岛素抵抗的存在[1-3],脂联素(adiponectin,APN)的表达也是降低的[4-6],这说明胰岛素抵抗以及APN在这些疾病中起一定作用,随着研究的深入,学者们逐渐注意到胰岛素抵抗与肿瘤的关系也极为密切,但是病因和发病机制尚不清楚。我们在长期的工作中发现,子宫内膜癌、前列腺癌的患者外周血APN和炎性因子水平明显低于正常,因此结合国内外文献报道,我们设计并实施了该研究,旨在通过检测上述3种雌激素依赖性子宫病变患者的BMI、HOMA-IR和APN、炎性因子,来探讨雌激素依赖性子宫病变——子宫内膜癌(EMC)、子宫内膜异位症(EMS)、子宫肌瘤(UM)患者的机体胰岛素抵抗和APN及炎性因子表达之间的相关性,以及上述指标表达水平变化的意义,以寻求此类疾病发病机制的切入点。
1 资料与方法
1.1 一般资料 本研究选取自2015年1月至2018年12月于本院门诊、住院患者及我院体检中心就诊的新发子宫疾病患者,共110例,其中子宫内膜癌40例[EMC组,年龄(35.1±10.3)岁]、子宫内膜异位症30例[EMS组,年龄(37.8±9.9)岁]、子宫肌瘤40例[UM组,年龄(38.1±10.4)岁],诊断依据为《卫生部临床诊断路径》,以上3组患者均作为观察组,另以30例同期体检的健康妇女作为对照组(NC组),年龄24~50岁,平均(32.8±7.3)岁。所有实验者半年内均未服用激素类药物,均排除内分泌科疾病,不合并其他激素依赖性疾病。本研究用到的全自动生化分析仪及配套血糖、C反应蛋白(CRP)试剂购自德国cobas公司,电化学分析仪及配套胰岛素检测试剂购自日本sysmex公司,流式细胞分析仪及配套肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、γ干扰素(IFN-γ)试剂购自美国BD公司,APN检测ELISA试剂盒购自上海生工,酶免测定仪为华东电子公司产品,微量加样枪为eppendorf公司产品。本研究获得重庆三峡中心医院伦理委员会批准。
1.2 方法
1.2.1 标本采集 所有入选实验对象均于清晨空腹采集肘静脉血4 mL,以3 000 r/min离心10 min,取血清,及时检测空腹血糖(fasting glucose,FG)、空腹胰岛素(fasting insulin,FIN)及炎性因子CRP、TNF-α、IL-6、IFN-γ水平。并分别另取500 μL分装并冻存至-80℃,待做APN检测。所有入选对象都由专人测量其身高和体重,数值精确到小数点后一位。
1.2.2 测定方法 所有患者在入组前完成以下检查:(1)用体质指数(body mass index,BMI)来评估受试者的肥胖程度,BMI=体重(kg)/身高(m)2,数值保留到小数点后2位。(2)用稳态模型评估法来评价个体的胰岛素抵抗水平,胰岛素抵抗指数(HOMA-IR)=空腹血糖水平(FPG,mmol/L)×空腹胰岛素水平(FINS,mIU/L)/22.5,数值精确到小数点后2位。(3)FG、FINS、CRP的检测:取自受试者的标本均离心后上机,按照《卫生部临床检验标准操作规程》操作。(4)TNF-α、IL-6、IFN-γ的检测:标本均离心后取血清,按照美国BD公司《人细胞因子检测试剂》的操作规程进行检测。(5)APN的检测:所有受试者的冻存标本室温溶解后离心,用双抗体夹心ELISA法检测,按照操作说明进行,在酶标仪450 nm波长处测量吸光度(OD)值,以标准浓度作横坐标,OD值作纵坐标,绘制标准曲线,以标本的OD值计算相应APN的浓度。(6)用Pearson相关分析BMI、HOMA-IR分别与APN、TNF-α、IL-6、IFN-γ的相关性。

2 结果
2.1 各组间BMI参数 BMI是衡量人胖瘦程度的指标,各组BMI见表1、图1,与NC组比较,EMC组和UM组患者的BMI均显著升高,但EMS组却显著降低(P<0.05),EMC组和UM组超重百分比和肥胖百分比均显著高于NC组,而EMS组则显著低于NC组。说明子宫内膜癌和子宫肌瘤患者比对照人群普遍偏胖,而子宫内膜异位症患者则普遍偏瘦。
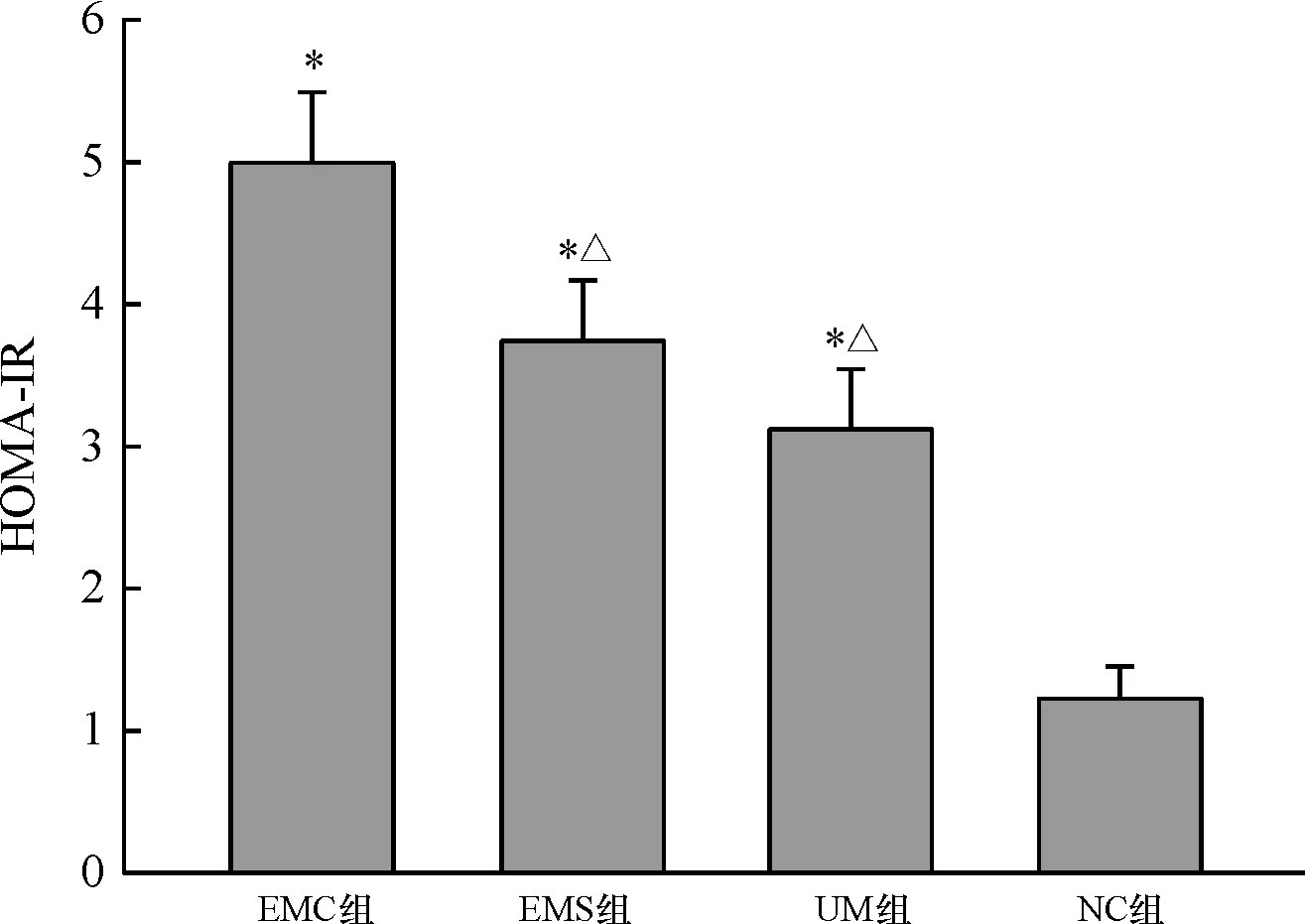
2.2 各组间胰岛素抵抗程度 与NC组比较,各观察组患者的HOMA-IR均显著升高(P<0.05),而EMC组又显著高于其他两个观察组(P<0.05),说明3种雌激素依赖性子宫病变的个体均存在胰岛素抵抗,而子宫内膜癌患者胰岛素抵抗最严重,各组HOMA-IR比较见表2、图2。
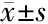

组别体重(kg)身高(m)BMI(kg/m2)超重百分比(%)肥胖百分比(%)EMC组69.02±2.591.57±0.1228±1.11∗11.69∗5.24∗EMS组51.76±2.141.57±0.1621±1.07∗△0.00∗0.00∗UM组62.41±2.711.58±0.0725±1.15∗△7.663.48NC组57.42±2.331.58±0.1123±0.813.201.80
注:*与NC组比较P<0.05; △与EMC组比较P<0.05
注:*与NC组比较P<0.05; △与EMC组比较P<0.05
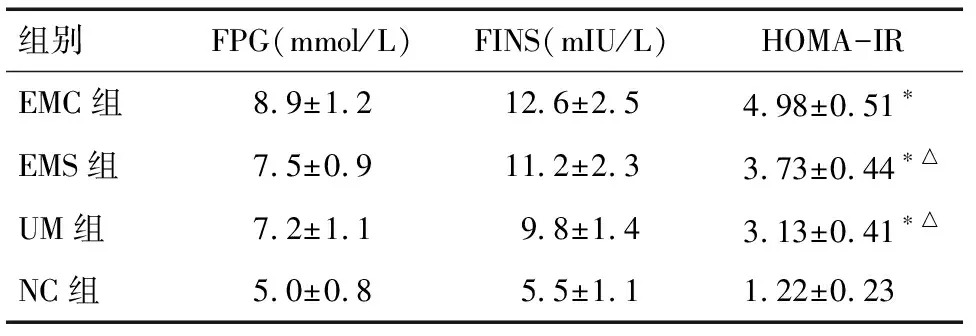
组别FPG(mmol/L)FINS(mIU/L)HOMA-IREMC组8.9±1.212.6±2.54.98±0.51∗EMS组7.5±0.911.2±2.33.73±0.44∗△UM组7.2±1.19.8±1.43.13±0.41∗△NC组5.0±0.85.5±1.11.22±0.23
注:*与NC组比较P<0.05; △与EMC组比较P<0.05
2.3 各组间炎性因子水平 与NC组比较,各观察组患者的炎性因子均显著升高(P<0.05),而EMC组又显著高于其他两个观察组(P<0.05),见表3。
注:*与NC组比较P<0.05; △与EMC组比较P<0.05
图2各组HOMA-IR值
说明三种雌激素依赖性子宫病变的个体体内四种炎性因子均升高,而子宫内膜癌患者升高最严重,见图3。
2.4 各组APN表达水平 各观察组患者的APN均明显低于NC组(P<0.05),EMC组最低。说明在雌激素依赖性子宫病变中,APN素起着重要作用,且病情越严重的个体,APN表达越低。见表4、图4。
2.5 BMI、HOMA-IR分别与APN、TNF-α、IL-6、IFN-γ的相关性分析 EMS组BMI与APN呈正相关但无统计学意义(r=0.632,P=0.091),而EMC组和UM组合并后BMI与APN则呈负相关(r=-0.569,P=0.025),3组BMI、HOMA-IR与CRP、TNF-α、IL-6和IFN-γ均呈正相关,HOMA-IR与APN呈负相关,见表5。


组别CRPTNF-αIL-6IFN-γEMC组8.69±3.56∗15.86±5.44∗10.47±3.25∗7.21±3.77∗EMS组2.85±2.02∗△5.12±2.16∗△4.98±2.17∗△3.52±1.97∗△UM组3.04±2.84∗△4.57±2.49∗△4.51±2.22∗△3.98±2.23∗△NC组0.38±0.190.26±0.180.18±0.110.33±0.09
注:*与NC组比较P<0.05; △与EMC组比较P<0.05
3 讨论
胰岛素抵抗是指一定剂量的胰岛素的生物学效应低于正常预计值的一种病理生理状态。随着研究的不断深入,学者们发现糖、脂肪代谢异常均与胰岛素抵抗有着密切联系,并且逐渐注意到胰岛素抵抗与肿瘤的关系也极为密切。
目前,胰岛素抵抗通用的诊断指标是采用正常血糖胰岛素钳夹技术测定葡萄糖代谢速率(GDR),GDR>9 mg/min被定义为胰岛素抵抗。国内则多采用空腹血浆胰岛素(FIN,μU/mL)与FBG(mmol/L)乘积的倒数作为判断标准,若该数值<1.0,则认为存在胰岛素抵抗。本研究采用稳态模型评估法来评价个体的胰岛素抵抗水平(HOMA-IR),在1985年由英国牛津大学Turner的科研小组首先提出,目前已成为广泛应用于临床的评价糖尿病患者胰岛素敏感性、胰岛素抵抗水平与胰岛β细胞功能的常用指标。HOMA-IR=FPG(mmol/L)×FINS(mIU/L)/22.5,正常个体的HOMA-IR指数为1。随着胰岛素抵抗水平的升高,HOMA-IR指数将高于1。肥胖个体存在胰岛素抵抗,本研究用BMI来评价肥胖程度,BMI是由19世纪中期的比利时通才凯特勒最先提出,成人的BMI数值正常为18.5~23.99 kg/m2,低于18.5 kg/m2则过轻,24~28 kg/m2为过重,28~32 kg/m2则为肥胖,高于32 kg/m2归为非常肥胖。

注:*与NC组比较P<0.05; △与EMC组比较P<0.05
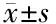
表4 各组APN表达水平
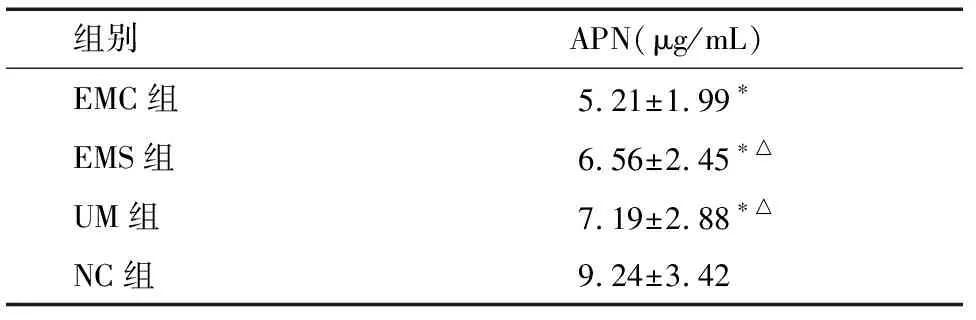
组别APN(μg/mL)EMC组5.21±1.99∗EMS组6.56±2.45∗△UM组7.19±2.88∗△NC组9.24±3.42
注:*与NC组比较P<0.05; △与EMC组比较P<0.05

注:*与NC组比较P<0.05; △与EMC组比较P<0.05
胰岛素抵抗并非单一因素所致,遗传因素、环境因素及行为因素均参与其中。炎症[7-9]、脂肪细胞内分泌就是其中的重要因素[10-12]。炎症因子与脂肪内分泌、氧化应激、免疫系统相互作用引起胰岛素抵抗。
脂肪细胞可分泌多种细胞因子,参与调节机体内分泌、代谢和炎症过程。APN既是一种重要的脂肪细胞因子成员,也是迄今所知的唯一一个与机体胰岛素抵抗呈反相关的脂肪细胞因子。它由脂肪细胞特异性分泌,是一种内源性的生物多肽。研究发现,APN与CRP和血浆纤维蛋白原呈负相关,可抑制巨噬细胞分泌TNF-α,降低炎症反应作用[13-14]。Takemura等[15]在研究中证实,APN在子宫内膜中发挥着抗炎症效应及能量平衡,这种效应可能与子宫内膜细胞的种植及内异症形成的病理生理机制有关。最新研究报道,子宫内膜癌患者外周血APN水平明显比对照组降低,且APN与内脂素水平呈正相关,实验组患者外周血内脂素/脂联素比值也显著高于对照组[16],且子宫内膜癌患者体内IL-6、CRP、TNF-α比对照组明显升高[17]。本研究显示,APN在雌激素依赖性子宫疾病如EMC、EMS、UM中表达降低,与炎性的表现相反,此结果与上述国内外研究一致。本研究结果显示,与健康对照组比较,3个观察组患者BMI、HOMA-IR、CRP、TNF-α、IL-6及IFN-γ水平均明显高于对照组(P<0.05),而3个观察组的APN则明显低于对照组(P<0.05)。其中EMC患者BMI、IR及血清炎症因子水平较EMS、UM患者均显著增加,而APN则显著降低(P<0.05)。Pearson相关分析结果显示,EMS组BMI与APN呈正相关但无统计学意义(r=0.632,P=0.091),而EMC组和UM组合并后BMI与APN则呈负相关(r=-0.569,P=0.025),3组BMI、HOMA-IR与CRP、TNF-α、IL-6和IFN-γ均呈正相关,HOMA-IR与APN呈负相关。本研究很好地验证了上述研究结果,雌激素依赖性子宫病变致使机体炎症因子升高,而增高的炎症因子又加重胰岛素抵抗,形成恶性循环,是此类疾病发病的重要因素。APN在此类疾病中处于低水平,上调APN可能会缓解雌激素依赖性子宫病变的胰岛素抵抗状态,从而为此类疾病的治疗提出了新思路,为今后的研究提出了新方向。
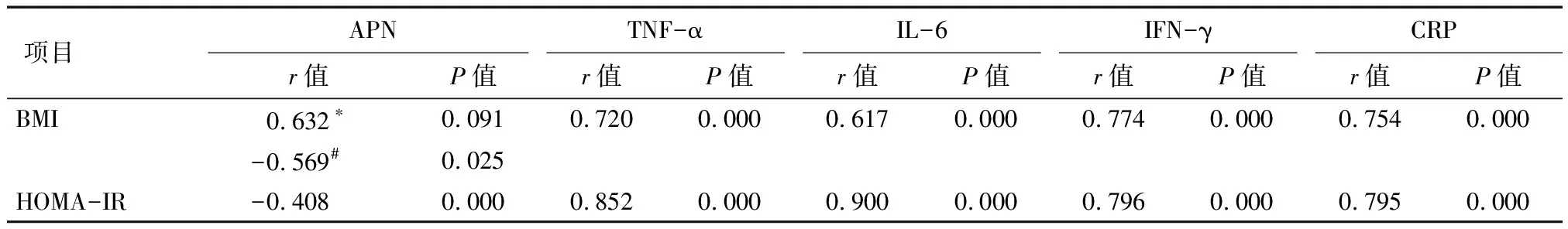
表5 各观察组BMI、HOMA-IR分别与APN,TNF-α、IL-6、IFN-γ的相关性分析
注:*EMS组; #EMC组与UM组合并
