青蒿素--环糊精包合物联合双硫仑抑制肠癌肝转移的体内活性研究
2020-02-29冯冰玉祖元刚魏亮吴比吴斌张东姜守刚
冯冰玉,祖元刚,魏亮,吴比,吴斌,张东,姜守刚※
(1.东北林业大学化学化工与资源利用学院,黑龙江 哈尔滨 150040;2.东北林业大学,森林植物生态学教育部重点实验室,黑龙江 哈尔滨 150040;3.东北林业大学,生物资源利用国家地方联合工程实验室,黑龙江 哈尔滨 150040)
结肠癌是消化道最常见的恶性肿瘤之一,是一种严重危害人类健康的恶性肿瘤。结直肠癌最常见的转移部位是肝脏[1],约25%的患者确诊为结直肠癌时已出现肝转移,另有约50%的患者在术后3年内出现肝转移[2]。结肠癌的治疗手段有很多,如手术治疗、放射治疗、临床化疗等方法。其中,手术治疗适用于早期的结肠癌,癌细胞局部浸润范围小,且没有出现转移或者转移的数目和范围较小的情况,但是对于晚期的癌症,局部浸润则比较广泛,故不适用手术治疗。化疗是肠癌肝转移的主要治疗手段,但化疗的毒副作用大且易耐药。以5-氟尿嘧啶为基础的化疗是最常用的治疗方案,有50%的转移性肠癌对该治疗方案产生耐药,而耐药后急需有效的临床用药[3]。而近年来的研究表明,中药可以用于即不能接受手术,又无法进行放疗、化疗患者的治疗。
青蒿素是一种含过氧基团的倍半萜内酯化物,由我国中医研究院中药研究所于1971年从菊科植物黄花蒿(Artemisia annua)叶中提取分离得到[4]。青蒿素不仅对疟疾有很好的治疗效果,而且治疗抗原发肠癌也有效果[5],但无治疗肠癌肝转移的报道。研究表明,青蒿素及其衍生物能降低细胞内线粒体跨膜电位,使线粒体中的Ca2+流入细胞质,从而致使肿瘤细胞死亡[6]。本试验将青蒿素用-环糊精进行包合形成青蒿素-环糊精包合物,避免了强酸性胃液对青蒿素的破坏,青蒿素-环糊精包合物在结肠处释放青蒿素,再联合具有抗肠癌的双硫仑进行联合给药[7],研究其联合给药抑制肠癌肝转移方面的作用。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂 青蒿素、双硫仑、-环糊精、福尔马林固定液(上海源叶生物科技公司);清洁级BABL/c小鼠(哈尔滨医科大学附属二院动物中心);奥沙利铂(江苏恒瑞医药股份有限公司);结肠癌CT26.WT细胞(北京协和医院细胞中心);RPMI 1640 培养基、青链霉素混合液(HyClone公司);胰蛋白酶(Sigma公司);优级胎牛血清(中国科学院天津灏洋生物)。
1.1.2 试验仪器 ALC-1104型分析天平(北京赛多利斯仪器系统有限公司);DK-8D型电热恒温水槽(上海森信实验仪器有限公司);FLC-3 型生物洁净工作台(北京东联哈儿仪器制造有限公司);YXQ-LS-75SII型立式压力蒸汽灭菌器(上海博讯实业有限公司);22R型高速离心机(德国Heraeus sepatech 公司);Eclipse TS100 型培养倒立显微镜(Nikon 公司);E191IR 型CO2细胞培养箱(美国西蒙有限公司);紫外线杀菌灯车(江阴市飞扬器械有限公司);Zf11-01 型洁净动物饲养柜(东北林业大学植物药工程研究中心设计监制)。
1.2 试验方法
1.2.2 青蒿素标准曲线的建立 分别称取已配制好的青蒿素母液 0.2、0.4、0.6、0.8、1.0、1.2、1.4mL于 10mL容量瓶内,依次加入95%的乙醇1.8、1.6、1.4、1.2、1.0、0.8、0.6 mL,再分别加入 0.2%的NaOH 溶液 8.0 mL 定容至10.0 mL,配制成浓度为0.02、0.04、0.06、0.08、0.10、0.12、0.14 mg/mL 的标准溶液。在 50 ℃水浴加热30 min 后流水冷却至室温,测定吸光度,绘制标准曲线。
1.2.3 小鼠结肠癌CT26.WT 细胞悬液的制备 将小鼠结肠癌CT26.WT细胞培养在RPMI 1640 培养液(含10%胎牛血清+1%青链霉素)中,置于37 ℃、5% CO2的细胞培养箱中培养。取对数生长期的细胞,加入1 mL 消化液(0.05%胰酶+0.02%EDTA)进行消化,吹打均匀后离心(2 000 r/min,离心时间10 min),将上清液轻轻缓慢地移走,加入适量的生理盐水稀释剩下的细胞沉淀物,制成单细胞悬液,用细胞计数板进行计数,并调节细胞浓度至1 106个/mL。细胞悬液制备完成置于无菌的条件下备用。
1.2.4 肠癌肝转移模型的建立 采用脾脏种植法构建小鼠肠癌肝转移模型[9]。将BABL/c 小鼠首先进行称重并记录,配制15%乌拉坦溶液,采用腹腔注射的方法对小鼠进行麻醉处理,观察到小鼠没有痛觉,角膜反射开始表现出迟钝,呼吸均匀而深沉时表明小鼠麻醉深度适宜,可以开始进行造模。对小鼠进行常规消毒后,于小鼠左侧背部剃毛,对剃毛处进行局部清洗和皮肤消毒后,将小鼠固定在手术台,于左侧背部进行约1.0 cm 的斜切口,待脾脏暴露后,将脾脏下极轻轻地提出腹腔,用1mL无菌注射器(30 号针头)吸取0.1mL CT26.WT 单细胞悬液(1 106个/mL),于脾上极被膜下缓慢进针5 mm,缓慢注入CT26.WT 细胞,见被膜肿胀变白时暂停注射,待脾脏回血恢复正常时接着进行注射,注射时间约5 min,注射完毕缓慢拔出针头,并用消毒棉签压迫针眼止血约2~3 min,将脾脏纳回,用手术缝合线逐层关腹,待小鼠度过麻醉时间,恢复清醒后进行常规饲养,自由进食进水。
1.2.5 分组及给药 选取一定数量周龄4~6 周、体重18~20 g 的雄性BABL/c小鼠,采用上述造模方法进行造模,将小鼠随机分成3 组,每组6 只,分为空白组(生理盐水)、给药组(青蒿素--环糊精包合物联合双硫仑)、阳性对照组(奥沙利铂)。空白组和阳性对照组采用腹腔注射的方式给药,给药组采用灌胃的方式进行给药,连续给药7 d,每5 d 对小鼠进行称重,用重复测量法分析药物对各组小鼠体重的影响,观察小鼠的状态,记录和分析小鼠的生存期。
1.2.6 病理学检查 通过对结肠癌肝转移的 BABL/c小鼠进行病理分析,来判断药物对于转移的抑制情况。每组随机选取一只小鼠,在给药10 d 后处死,取出完整的肝脏,用生理盐水将其清洗干净,并用4%的多聚甲醛溶液将其固定12~14 h,经过脱水、透明、石蜡包埋、切片、HE染色及封固一系列操作,在显微镜下进行病理学观察和分析。
2 结果与分析
2.1 青蒿素--环糊精包合物的红外光谱图
从青蒿素的谱图(图1A)可以看出,主要特征吸收峰在 1 738 cm-1的 C=O 的伸缩振动,1 116 cm-1的C—O—C 的伸缩振动,724 cm-1的O—O 的伸缩振动,2 870~3 000 cm-1的 C—H 伸缩振动。从-环糊精的谱图(图1B)可以看出,主要在3 400 cm-1有—OH的弯曲振动,2 937 cm-1有甲基、亚甲基C—H 的伸缩振动,1 417 和1 295 cm-1的—OH 平面弯曲振动等较强吸收峰。而青蒿素与-环糊精物理混合的谱图(图1C)可以看出青蒿素的主要吸收峰还在,只是在其基础上叠加了-环糊精的吸收峰。比较青蒿素与-环糊精物理混合(图1C)与青蒿素包合物(图1D)的红外光谱图可以发现2 个谱图明显不同,表明青蒿素进入-环糊精疏水腔内,主客体间相互作用,在范德华力、色散力、静电作用力以及氢键等因素的影响下,没有形成新的化学键,因此,可以看到谱图中客体的峰形有所变宽,峰强度减弱,且有一些较弱的吸收峰消失,由于没有新键的形成,所以,包合物中吸收峰的位移不大,且无新峰出现,说明已形成较稳定的包合物。
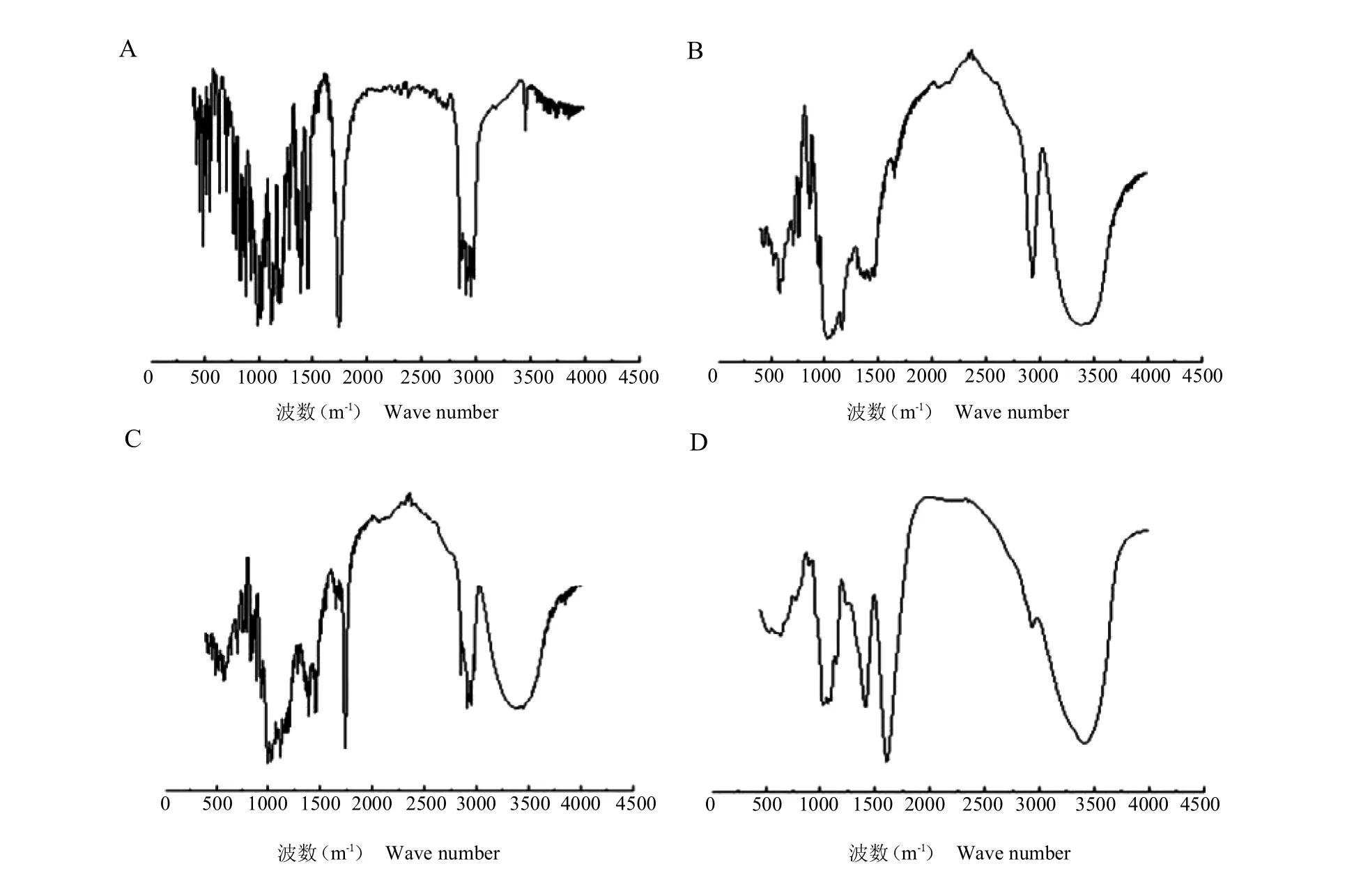
图1 青蒿素(A)、-环糊精(B)、青蒿素与-环糊精物理混合(C)、青蒿素包合物(D)的红外光谱图Fig.1 Infrared spectra of artemisinin(A),-cyclodextrin(B),physical mixing of artemisinin and -cyclodextrin(C)and artemisinin inclusion complex(D)
2.2 青蒿素包合物载药量的测定
根据“1.2.1”的方法测出不同浓度青蒿素的吸光度,以浓度为横坐标、吸光度为纵坐标绘制青蒿素的标准曲线,得标准方程为Y=1.085X+1.1491(R2=0.99653)。根据标准方程计算包合物的载药量为 17.0%±0.4%(n=3)。
2.3 肠癌肝转移模型的建立
观察小鼠在接种CT26.WT细胞后的生活状态,于接种后第1 天,明显可以观察到小鼠的活动减少,进食进水量减少。第2 天起,小鼠的精神状态慢慢恢复,活动如常,进食进水量恢复正常。接种后10 d 左右,小鼠出现体态逐渐消瘦,摄食量减少,精神状态不佳,可于腹部触及肿块。接种后15 d 左右,小鼠明显消瘦,行动迟缓,精神状态萎靡不振。将自然死亡的小鼠肝脏完整剖出,可见肝脏广泛分布着灰白色肿瘤组织。由此可见,已成功建立了小鼠结肠癌肝转移模型。
2.4 模型小鼠体重变化情况分析
接种前的小鼠均活动正常,自由进食进水,精神状态比较活泼。分别在接种当天,接种后第1 天、第5天、第10 天、第15 天测定并记录小鼠的体重,小鼠体重变化结果如图2 所示。从图2 可以看出,各组小鼠的体重在接种后第1 天均出现了减轻的情况,空白组和给药组的小鼠体重自接种后第2 天起开始逐渐增加;而阳性对照组小鼠的体重则是自接种后第1 天至第5 天小鼠的体重均呈现下降的趋势,从第6 天起小鼠的体重才逐渐上升,最后阳性对照组小鼠的体重低于其他两组小鼠的体重,说明奥沙利铂毒副作用高于其他两组。

图2 模型小鼠的体重变化Fig.2 Weight changes of model mice
2.5 模型小鼠生存期分析
自小鼠接种后,每天观察小鼠的生存状态,精神状态并记录生存期。对各组的小鼠采用 SPSS 17.0 软件中Kaplan-Meier法进行生存期分析,生存曲线如图3 所示。分析结果显示,空白组、给药组、阳性对照组平均生存期分别为(19.16±2.03)、(28.33±3.68)、(33.83±2.27)d。因此,给药组的生存期显著长于空白组,说明青蒿素--环糊精联合双硫仑给药可作为治疗结肠癌肝转移的二线临床备选药物。

图3 模型小鼠的生存期曲线Fig.3 Survival time curve of model mice
2.6 模型小鼠肝脏标本观察
于接种后10 d 处死小鼠,完整剖出其肝脏,肝脏标本如图4 所示。从图4 可以看出,空白对照组,肝脏表面分布着较多的大小不一的肿瘤结节,部分肝脏组织被肿瘤结节所代替[10];给药组,肝脏有着较少的肿瘤结节分布,其数量远少于空白对照组;奥沙利铂阳性对照组,其表面几乎没有转移的肿瘤结节。结果表明,联合用药具有显著的抑制结肠癌肝转移的活性。

图4 模型小鼠肝脏标本Fig.4 Liver specimens from model mice
2.7 病理学观察结果
对模型小鼠的肝脏进行HE染色,并做病理分析,在放大倍数为100 倍的显微镜下观察,其结果如图5所示。图5A 为空白对照组,箭头所指a 处为正常的细胞,箭头所指b处细胞核质比显著增高,体现出了团聚现象,说明肿瘤细胞复制剧烈[11]。图5B 为联合给药组,可以看到转移瘤的细胞数量明显减少,并且肿瘤细胞团聚现象没有图A 那样密集,说明联合给药在一定程度上抑制了肿瘤细胞的转移。图5C 为奥沙利铂组,其中肿瘤细胞的核质比与正常细胞相差不大,抑制了肿瘤细胞的复制。
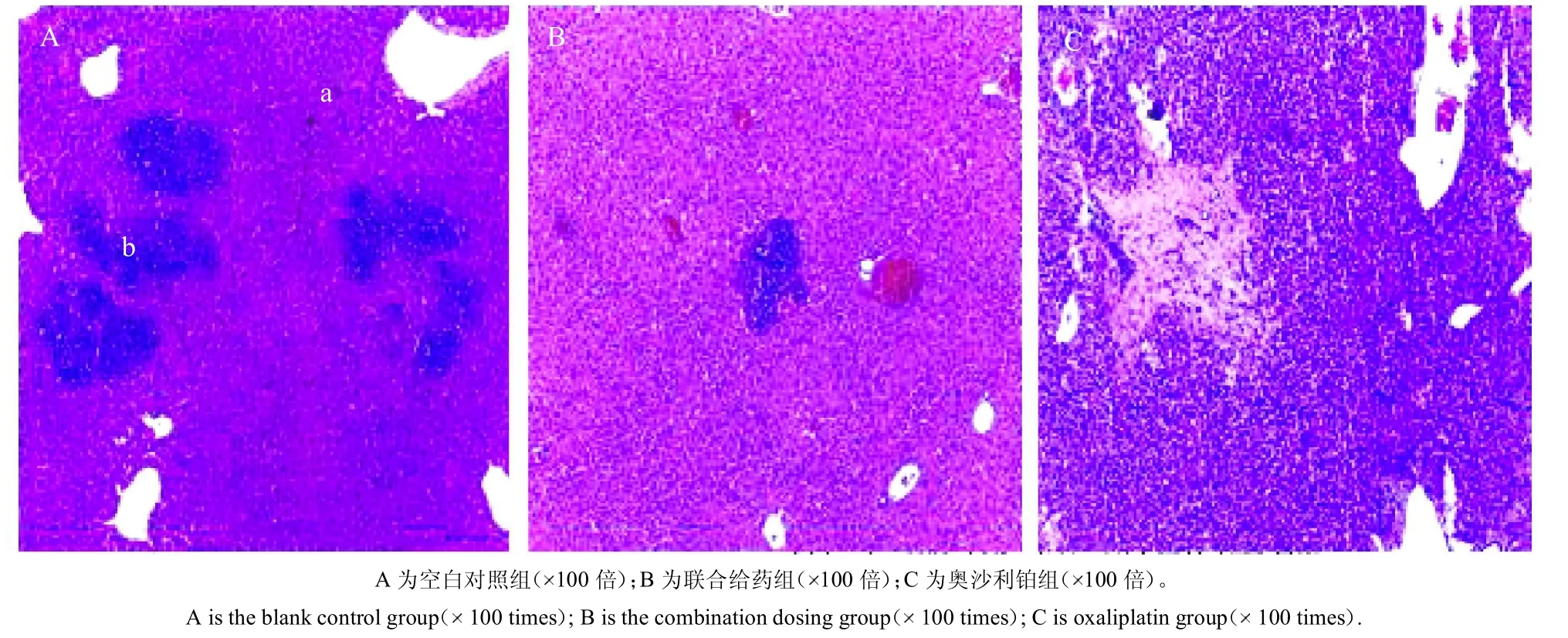
图5 模型小鼠肝脏HE 染色后切片图像Fig.5 Slice images of model mouse liver after HE staining
3 结论
通过建立肠癌肝转移模型,比较联合给药组平均生存期、肝组织切片肿瘤转移数和病理肿瘤细胞复制等试验,发现不论青蒿素还是青蒿素--环糊精包合物给药抑制肠癌肝转移效果不显著,可能是因为青蒿素治疗肿瘤的主要机理是其过氧基团与肿瘤中过量的铁二价离子反应生成氧自由基而杀伤肿瘤细胞[12]。但由于铁主要储存在肝[13],即使肠癌肿瘤细胞比正常的肠细胞中铁二价离子浓度高,但当其肝转移后,不论青蒿素还是青蒿素--环糊精包合物都不具有肠癌的靶向性,达不到有效的治疗浓度,所以,抑制肠癌肝转移效果不显著。考虑到即使与具有抗肠癌的双硫仑联合给药,其生存期也短于阳性对照组,有必要把青蒿素装载到肿瘤靶向性载体中,提高其抗肠癌肝转移活性。
