趋化因子fractalkine通过NF-κB信号通路调控足细胞损伤及凋亡的研究
2020-02-28马敬雪黄丹巩奇明卢俊玲尤燕舞
马敬雪 黄丹 巩奇明 卢俊玲 尤燕舞


【摘要】 目的 探討趋化因子fractalkine(FKN)对小鼠足细胞炎症因子分泌的影响及机制、对nephrin表达的影响及其在足细胞凋亡中的可能机制。
方法 培养小鼠足细胞,将细胞分为:①对照组;②rmFKN干预组;③rmFKN+SC514(抑制剂)组。采用流式细胞术检测各组中足细胞的凋亡率。用蛋白质印迹法(Western blot)检测足细胞nephrin、白介素6(IL6)、肿瘤坏死因子α(TNFα)、细胞核内核因子κB(NFκB)、Bax、Bcl2及细胞色素C(Cytochrome C,Cytc)蛋白表达水平。
结果 凋亡结果显示,各组细胞培养48 h后,与对照组相比,rmFKN+SC514组凋亡率差异无统计学意义(P>0.05),rmFKN 组凋亡率升高,而rmFKN组与rmFKN+SC514组相比凋亡率升高,差异均有统计学意义(P<0.05)。Western blot结果显示,与对照组相比,rmFKN组nephrin的表达水平下调,rmFKN 组IL6、TNFα分泌增多,NFκB p65、Bax、Cytc表达水平上调,Bcl2表达水平下调,差异均有统计学意义(P<0.05)。与rmFKN组相比,rmFKN+SC514组IL6、TNFα蛋白分泌减少,NFκB p65表达水平下调,差异有统计学意义(P<0.05)。
结论 ①rmFKN可抑制足细胞nephrin的表达;②rmFKN可以促进足细胞IL6、TNFα的产生和分泌,NFκB的活化可能是其潜在机制;③rmFKN促进足细胞的凋亡,其作用可能通过NFκB信号通路调节Cytc的表达及Bax/Bcl2平衡有关。
【关键词】 rmFKN;核因子κB;肿瘤坏死因子α;白介素6;nephrin;凋亡
中图分类号:R692 文献标志码:A DOI:10.3969/j.issn.10031383.2020.01.004
【Abstract】 Objective To investigate the effect of fractalkine(FKN) on the secretion of inflammatory factors,the expression of nephrin and the possible mechanism of apoptosis in podocyte.
Methods Podocytes were cultured and randomly divided into three groups:control group,rmFKN group and rmFKN+SC514 (Inhibitor of NFκB p65) group.Podocyte apoptosis was detected by flow cytometry.The expression of nephrin,interleukin6(IL6),tumor necrosis factorα(TNFα),nuclear kernel factorκB(NFκB),Bax,Bcl2,and Cytc were detected by western blot.
Results The results of flow cytometry showed that there was no significant difference in the apoptosis rate of rmFKN+SC514 group compared with the control group (P>0.05),and the apoptosis rate of rmFKN group was higher than that of rmFKN + SC514 group (P<0.05).Western blot showed that compared with the control group,the expression level of nephrin decreased,the secretion of IL6 and TNFα increased,the expression level of NFκB p65,Bax and Cytc increased,and the expression level of Bcl2 decreased in rmFKN group (P<0.05).Compared with the rmFKN group,the secretion of IL6,TNFα and the expression level of NFκ B p65 were decreased in the rmFKN+SC514 group (P<0.05).
Conclusion ①FKN can inhibit the expression of nephrin;②FKN can promote the production and secretion of IL6 and TNFα in potocyte,which may be associated with activation of the NFκB signaling pathway;③FKN can promote the apoptosis of podocytes,which may be related to the regulation of Cytc expression and the balance of Bax/Bcl2 by activating NFκB signaling pathway.
【Key words】 fractalkine;NFκB;TNFα;IL6;nephrin; apoptosis
足细胞是高度分化的肾小球脏层上皮细胞,包裹在肾小球毛细血管周围,对维持肾小球的结构和功能起着重要作用。足细胞的破坏可能导致肾小球滤过功能受损[1]。研究表明足细胞的损伤或丢失是各种形式的肾小球疾病和慢性肾脏疾病最常见的早期临床表现[2],所以深入研究足细胞损伤及凋亡机制对肾小球疾病的预防、诊断与治疗十分重要。趋化因子fractalkine(FKN),又被称作CX3CL1,是CX3C类趋化因子超家族中唯一的成员[3]。FKN在动脉粥样硬化[4]、肿瘤[5~6]、肾脏疾病包括狼疮性肾炎[7~8]等多种疾病中发挥着重要作用,但是FKN在足细胞损伤及凋亡中的作用尚不清楚。该研究以小鼠足细胞为研究对象,探讨FKN对足细胞核因子κB(NFκB)活化、其特异性蛋白nephrin表达及凋亡的影响,以初步证实FKN在足细胞损伤及凋亡中的作用及可能机制。
1 材料与方法
1.1 材料
小鼠足细胞株(MPC5)购于上海复旦大学细胞中心,冻存于右江民族医学院科学实验中心,RPMI1640细胞培养基、胎牛血清(Gibco生物公司),重组小鼠rmFKN(R&D,美国),SC514(Selleck,美国),凋亡检测试剂盒购自于美国BD公司,兔抗IL6、TNFα一抗兔抗(Santa Cruz Biotechnology,美国),NFκB p65一抗(Cell Signaling Technology,美国),兔抗nephrin一抗(Abcam,美国),鼠抗GAPDH一抗(Proteintech,美国),兔抗Bax一抗、兔抗Bcl2一抗购自于Abcame公司;鼠抗Cytc一抗购于碧云天。羊抗鼠、羊抗兔IgG 抗体(二抗)(碧云天,中国)。蛋白酶抑制剂混合物(康为世纪,北京),BCA蛋白定量试剂盒(碧云天,中国)。
1.2 实验方法
1.2.1 足细胞培养
足细胞按照参考文献培养及诱导分化[9]。细胞在10%胎牛血清的RPMI1640培养液,于37℃,5% CO2环境中传代培养。2~3天换液1次。细胞融合至80%左右消化传代,14天左右分化成熟后用于相关实验。
1.2.2 rmFKN处理及分组
细胞传代后,以1×105个细胞种于6孔板中,待各组细胞融合至60%~70%后用含1%胎牛血清的 RPMI1640 培养液同步化24 h将细胞分为3组,每组3个复孔。①对照组:足细胞置于37℃、5%CO2培养箱中培养。②rmFKN组:在足细胞培养液中加入rmFKN,终浓度为10 ng/mL[10],37℃、5%CO2培养箱中培养。③rmFKN+SC514组:在足细胞培养液中加入SC514,终浓度为30 μM[11],作用1 h后加入rmFKN,终浓度为10 ng/mL,37℃、5%CO2培养箱中培养。
1.2.3 Western blot法检测蛋白表达
干预足细胞适当时间后收集各组足细胞,提取总蛋白。以二喹啉甲酸法测定蛋白浓度,取30~50 μg蛋白加入5×SDS上样缓冲液煮沸变性后,于十二烷基硫酸钠聚丙烯酰胺凝胶电泳,300 mA恒流湿转至PVDF膜,封闭液室温封闭1 h,分别加入一抗稀释液稀释的nephrin(1∶500)、NFκB p65(1∶500)、IL6(1∶500)、TNFα(1∶500)、Bax(1∶500)、Bcl2(1∶500)、Cytc(1∶500)、GAPDH(1∶2000)抗体,4℃孵育过夜,洗涤3次,加入相应的抗兔或鼠IgGHRP二抗,室温孵育1 h,洗涤3次,增强化学发光(ECL)显影,利用Image J软件进行半定量分析,以目的条带与同个样品GAPDH灰度值的比值表示相对光密度值。重复试验3次。
1.2.4 流式细胞术检测细胞凋亡
足细胞按照前面分组培养48 h后收集各孔上清液于离心管中备用,然后再将各组细胞用4℃ PBS 清洗 2 次,胰酶消化后与前述上清液共同制成单细胞悬液,调整细胞密度为1×106个/mL,取 100 μL 细胞悬液加入 5 μL AnnexinVFITC 和 5 μL PI 溶液混匀,室温避光孵育 15 min,加入 400 μL PBS,流式细胞仪进行检测。重复试验3次。
1.3 统计学方法
采用SPSS 23.0统计软件进行数据分析,所有数据均进行正态分布和方差齐性检验。服从正态分布的数据以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间采用单因素方差分析。每个实验组重复3次。检验水准:α=0.05,双侧检验。
2 结果
2.1 rmFKN对各组足细胞nephrin蛋白表达的影响
用rmFKN干预足细胞后,用Western blot检测各组细胞nephrin表达水平。结果表明,rmFKN可诱导足细胞的nephrin表达下调,nephrin与内参GAPDH灰度值之比(0.89±0.04)与正常对照组的灰度值之比(1.44±0.02)差异有统计学意义(P<0.05)。见图 1。
2.2 Western blot检测各组足细胞IL6、TNFα的表达
用rmFKN干预足细胞后,用Western blot检测各组细胞IL6、TNFα蛋白的表达水平。结果表明,rmFKN可诱导足细胞中的IL6、TNFα表达上调,rmFKN 组、对照组IL6与内参GAPDH的灰度值之比分别为(0.85±0.04)、(0.42±0.05),差异有统计学意义(P<0.05);rmFKN 组、对照组TNFα与内参GAPDH的灰度值之比分别为分别为(0.95±0.04)、(0.49±0.03),差異有统计学意义(P<0.05)。然而,rmFKN+SC514组IL6、TNFα表达下调,灰度值之比分别为(0.46±0.05)、(0.51±0.04),与rmFKN组相比,差异有统计学意义(P<0.05)。见图2。
2.3 Western blot检测各组足细胞核内NFκB p65水平
Western blot检测结果表明,rmFKN可诱导足细胞NFκB p65表达上调,NFκB p65与内参GAPDH的灰度值之比(0.90±0.03),与对照组(0.52±0.01)比较,差异有统计学意义(P<0.05)。然而, rmFKN+SC514 组NFκB p65(0.60±0.03)的表达下调,与rmFKN组灰度值之比差异有统计学意义(P<0.05)。见图 3。
2.4 FKN通过活化NFκB促进足细胞凋亡
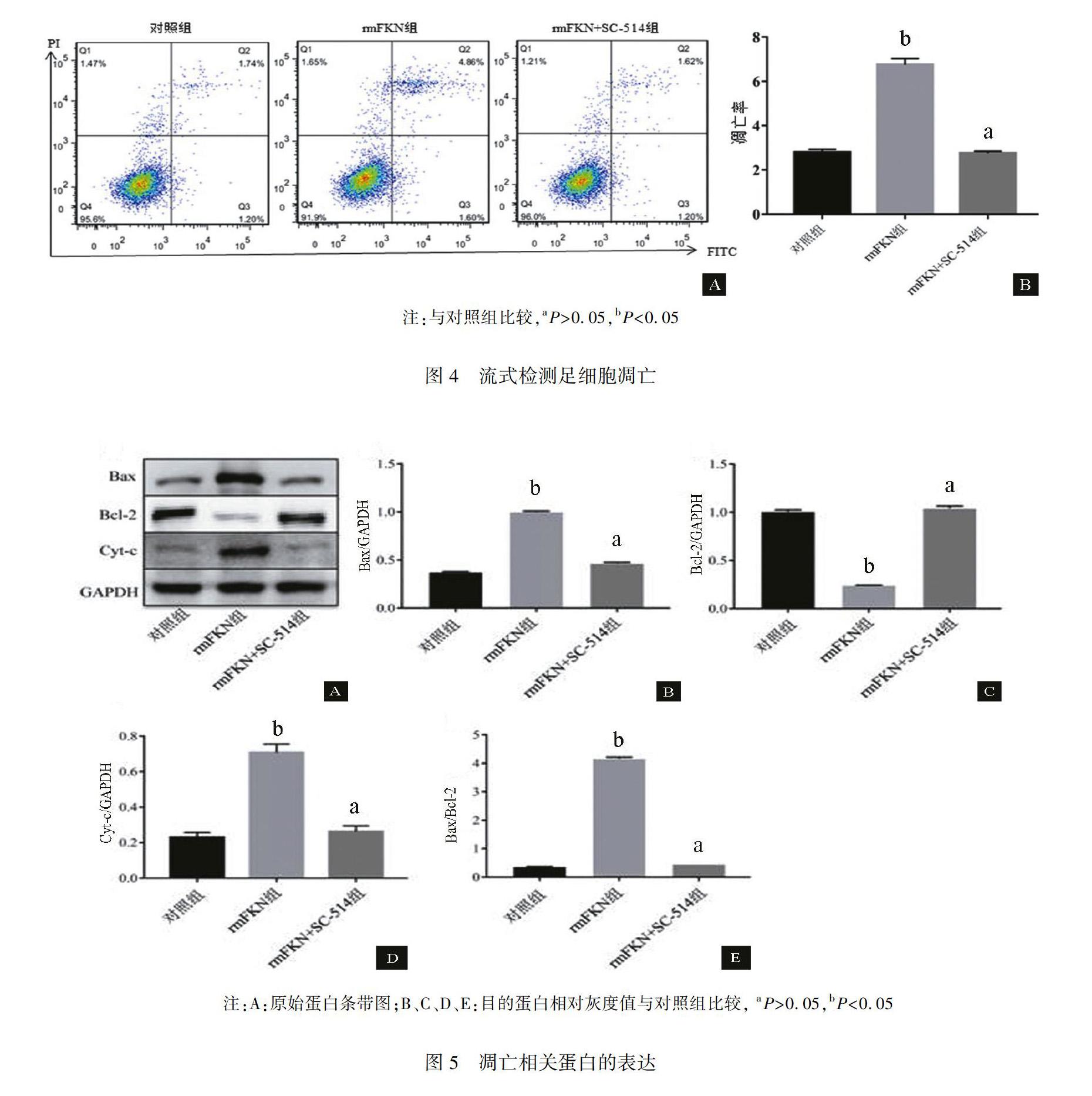
凋亡结果显示,各组细胞培养48 h后,rmFKN+SC514组的凋亡率(2.76±0.09)%与对照组(2.80±0.13)%比较,差异无统计学意义(P>0.05)。而rmFKN 组凋亡率为(6.75±0.28)%,与对照组及rmFKN +SC514组比较,差异均有统计学意义(P<0.05)。见图 4。
2.5 rmFKN对足细胞Cytc、Bax及Bcl2表达的影响
Western blot检测显示,rmFKN干预足细胞后,rmFKN组Cytc及Bax表达上调,与内参GAPDH的灰度值之比分别为(0.71±0.05)及(0.99±0.01),与正常对照组(0.23±0.03)及(0.37±0.01)比较,差异有统计学意义(P<0.05)。然而rmFKN组的Bcl2表达下调,与内参GAPDH的灰度值之比为(0.24±0.00),与正常对照组(1.01±0.02)比较,差异有统计学意义(P<0.05)。对照组与rmFKN+SC514组相比,Cytc、Bax及Bcl2表达差异均无统计学意义(P>0.05)。见图 5。
3 讨论
足细胞是肾小球的特化上皮细胞,已知是肾小球疾病损伤的关键部位[12]。其数量减少或功能障碍将导致肾小球滤过功能损伤和相关肾脏疾病的发生。因此,足细胞凋亡被认为是肾小球疾病发展的一个十分重要的早期标志。炎症是机体对于损伤因子的自我防御反应,其过程包括局部组织变质、血管内液体成分和细胞成分渗出以及组织细胞的增生。其中涉及多种细胞及因子参与。炎症过程非常复杂,在大多数慢性疾病中起着重要作用,并且对人体、组织、细胞带来巨大损害。研究发现,各种炎症因子在足细胞的聚集是引起足细胞损伤的重要因素之一[12~15]。
Fractalkine(FKN)是CX3C类趋化因子超家族中唯一的成员,参与了趋化、细胞黏附、细胞生长的调节、炎症免疫应答等[16]。近年研究发现FKN参与了包括肾缺血再灌注损伤、肾间质纤维化、新月体肾炎的发生与发展[17~18]。我们前期的研究发现FKN在狼疮肾炎患者外周血及脂多糖诱导的肾小管上皮细胞损伤模型中的表达明显增高[7,11]。但是其具体机制特别是在诱导足细胞损伤中的机制仍不明确。IL6及TNFα是兩种重要的炎症介质。郑柳颖等[19]研究发现FKN可以诱导外周血单核细胞分泌TNFα,从而诱导炎症反应。本研究结果显示,与对照组相比,rmFKN刺激足细胞后明显上调IL6及TNFα蛋白的表达,提示刺激炎症反应可能是FKN促进足细胞损伤的机制之一。我们课题组最新的研究发现,利用脂多糖(Lipopolysaccharide,LPS)诱导小鼠足细胞损伤后FKN表达明显升高,且与足细胞增殖、凋亡等密切相关[20]。但是FKN参与足细胞凋亡的具体机制有待进一步探究。在本实验中我们通过使用rmFKN干预足细胞后,通过流式细胞术检测发现足细胞的凋亡率明显升高。这说明FKN可能在足细胞中发挥着促进凋亡并导致肾小球疾病发生的生物学活性。
为了进一步揭示rmFKN诱导IL6及TNFα分泌的机制,我们把目标聚焦到NFκB。NFκB在静息状态下以无活性的形式存在于胞浆中,当受到外界刺激时磷酸化的NFκB转移至细胞核并诱发多种生物学反应[21]。本研究发现,rmFKN可以激活NFκB并促进NFκB p65的核转移。NFκB与IL6及TNFα等炎症因子的产生与分泌关系密切。既往研究发现高糖、脂多糖等可以激活NFκB后上调IL6及TNFα的表达[22~23]。我们使用NFκB的抑制剂SC514预处理足细胞,结果发现SC514预处理明显抑制rmFKN诱导的IL6及TNFα产生。此外,SC514与rmFKN共同孵育足细胞后,其凋亡率明显下降,表明rmFKN可能通过活化NFκB通路促进足细胞炎症反应及凋亡。
Nephrin是定位于裂孔膜的足细胞特异性分子。多项研究表明nephrin在多种原发性和继发性肾小球疾病中表达降低或分布异常,进而导致肾小球滤过功能改变而出现蛋白尿[24~25]。FKN是否会影响nephrin的表达,至今未见报道。在本研究中,我们用rmFKN刺激足细胞后进一步观察nephrin表达的变化。结果显示,rmFKN能抑制nephrin的表达。这可能是FKN参与足细胞损伤的机制之一。
细胞凋亡受多种途径调控,其中线粒体途径是调控凋亡的重要途径之一。 Cytc是氧化呼吸链中基本成分之一,在线粒体凋亡途径中起着至关重要的作用[26]。当细胞受到外界刺激后,由线粒体释放到胞质中的Cytc可以介导Caspase的激活,进而发生级联反应参与凋亡的发生[27]。有研究表明,Bax/Bcl2比例增加可以导致Cytc从线粒体释放到细胞基质中[28],Bcl2家族蛋白包括促凋亡蛋白Bax和抗凋亡蛋白Bcl2位于线粒体外膜[29],这些蛋白的动态平衡决定着细胞生存[30]。为了探究Cytc及Bax/Bcl2平衡的变化是否参与了FKN介导的足细胞凋亡,在我们的研究中,用rmFKN干预足细胞后,用Western blot检测了Cytc的表达量,结果发现,rmFKN组中Cytc及Bax的表达量明显上调,Bcl2的表达量明显下调,Bax/Bcl2的比例升高,说明FKN介导足细胞凋亡可能与Cytc及Bax/Bcl2平衡变化相关。鉴于前面FKN与NFκB之间的相互关系在足细胞凋亡中的作用,我们进一步验证了NFκB与Cytc、Bax及Bcl2之间的关系,结果显示,用rmFKN与SC415共同孵育足细胞后Cytc及Bax表达水平明显下调,Bcl2的表达水平明显上调,Bax/Bcl2的比例降低。综上所述,FKN可能是通过NFκB信号通路调节Cytc的表达及Bax/Bcl2平衡进而参与足细胞凋亡的调控。
总之,本研究证实FKN可以抑制足细胞nephrin蛋白的表达,可能通过激活NFκB信号通路参与足细胞凋亡的过程,并初步揭示了FKN在调控足细胞炎症反应及凋亡中的作用,对于更深入地了解FKN在足细胞损伤及凋亡中的机制有着重要意义。通过抑制FKN/NFκB信号通路的激活,可以减轻炎症反应,抑制足细胞的凋亡,为由足细胞功能障碍导致的疾病的防治提供新的干预靶点。
参 考 文 献
[1]Vivarelli M,Massella L,Ruggiero B,et al.Minimal Change Disease[J].Clin J Am Soc Nephrol,2017,12(2):332345.
[2]Lal MA,Patrakka J.Understanding Podocyte Biology to Develop Novel Kidney Therapeutics[J].Front Endocrinol (Lausanne),2018,9:409.
[3]Koziolek MJ,Vasko R,Bramlage C,et al.The CX(3)Cchemokine fractalkine in kidney diseases[J].Mini Rev Med Chem,2009,9(10):12151228.
[4]Chandrasekar B,Mummidi S,Perla RP,et al.Fractalkine (CX3CL1) stimulated by nuclear factor kappaB (NFkappaB)dependent inflammatory signals induces aortic smooth muscle cell proliferation through an autocrine pathway[J].Biochem J,2003,373(Pt 2):547558.
[5]Wang H,Cai J,Du S,et al.Fractalkine/CX3CR1 induces apoptosis resistance and proliferation through the activation of the AKT/NFkappaB cascade in pancreatic cancer cells[J].Cell Biochem Funct,2017,35(6):315326.
[6]李海洋,黃李雅,吴阳,等.趋化因子Fractalkine通过调控AKT信号通路对人胰腺癌细胞株增殖侵袭能力的影响[J].宁夏医科大学学报,2017,39(3):243246.
[7]You Y,Qin Y,Lin X,et al.Upregulated fractalkine levels in Chinese patients with lupus nephritis[J].Cytokine,2018,104:2328.
[8]Feng L,Chen S,Garcia GE,et al.Prevention of crescentic glomerulonephritis by immunoneutralization of the fractalkine receptor CX3CR1 rapid communication[J].Kidney Int,1999,56(2):612620.
[9]Mundel P,Reiser J,Zúiga Mejía Borja A,et al.Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines[J].Exp Cell Res,1997,236(1):248258.
[10] OSullivan SA,Dev KK.The chemokine fractalkine (CX3CL1) attenuates H2O2induced demyelination in cerebellar slices[J].J Neuroinflammation,2017,14(1):159.
[11] You Y,Qin Y,Lin X,et al.Inhibition of LipopolysaccharideInduced Expression of FKN by Methylprednisolone via NFκB in Human Renal Tubular Epithelial Cells[J].Pulm Respir Med,2015,5(2):15.
[12] Wright RD,Beresford MW.Podocytes contribute,and respond,to the inflammatory environment in lupus nephritis[J].Am J Physiol Renal Physiol,2018.315(6):16831694.
[13] Zhang Y,Ma KL,Liu J,et al.Inflammatory stress exacerbates lipid accumulation and podocyte injuries in diabetic nephropathy[J].Acta Diabetol,2015,52(6):10451056.
[14] Ren Y,Wang D,Lu F,et al.Coptidis Rhizoma inhibits NLRP3 inflammasome activation and alleviates renal damage in early obesityrelated glomerulopathy[J].Phytomedicine,2018,49:5265.
[15] Yu J,Wu Y,Wang L,et al.mPGES1derived prostaglandin E2 stimulates Stat3 to promote podocyte apoptosis[J].Apoptosis,2017,22(11):14311440.
[16] Guo X,Pan Y,Xiao C,et al.Fractalkine stimulates cell growth and increases its expression via NFkappaB pathway in RAFLS[J].Int J Rheum Dis,2012,15(3):322329.
[17] Furuichi K,Gao JL,Murphy PM.Chemokine receptor CX3CR1 regulates renal interstitial fibrosis after ischemiareperfusion injury[J].Am J Pathol,2006,169(2):372387.
[18] Furuichi K,Wada T,Iwata Y,et al.Upregulation of fractalkine in human crescentic glomerulonephritis[J].Nephron,2001,87(4):314320.
[19] 鄭柳颖,孙健,雷明明,等.趋化因子FKN对外周血单核细胞NFκB和TNFα表达的影响及蛋白激酶C在其中的作用[J].大连医科大学学报,2008,30(4):310313.
[20] Senouthai S,Wang J,Fu D,et al.Fractalkine is Involved in LipopolysaccharideInduced Podocyte Injury through the Wnt/βCatenin Pathway in an Acute Kidney Injury Mouse Model[J].Inflammation,2019,42(4):12871330.
[21] Sun SC.The noncanonical NFkappaB pathway in immunity and inflammation[J].Nat Rev Immunol,2017,17(9):545558.
[22] 周佾龙,杨韶华,张弛,等.长链非编码基因MALAT1对LPS诱导的脓毒症大鼠免疫反应的调节作用及机制[J].四川大学学报(医学版),2018,49(6):865870,875.
[23] Panahi G,Pasalar P,Zare M,et al.High glucose induces inflammatory responses in HepG2 cells via the oxidative stressmediated activation of NFkappaB,and MAPK pathways in HepG2 cells[J].Arch Physiol Biochem,2018,124(5):468474.
[24] Patrakka J,Tryggvason K.Nephrina unique structural and signaling protein of the kidney filter[J].Trends Mol Med,2007,13(9):396403.
[25] WELSH GI,SALEEM MA.Nephrinsignature molecule of the glomerular podocyte?[J].J Pathol,2010,220(3):328337.
[26] 吴兰芳,杨爱珍,刘和,等.线粒体调控细胞凋亡的研究进展[J].中国农学通报,2010,26(8):6368.
[27] 王艳杰,邓雯,张鹏飞.细胞色素C与细胞凋亡研究进展[J].动物医学进展,2012,33(7):8992.
[28] Philchenkov A.Caspases:potential targets for regulating cell death [J].Journal of Cellular & Molecular Medicine,2007,8(4):432444.
[29] Krajewski S,Tanaka S,Takayama S,et al.Investigation of the Subcellular Distribution of the bcl2 Oncoprotein:Residence in the Nuclear Envelope,Endoplasmic Reticulum,and Outer Mitochondrial Membranes[J].Cancer Research,1993,53(19):47014714.
[30] Ola MS,Nawaz M,Ahsan H.Role of Bcl2 family proteins and caspases in the regulation of apoptosis[J].Molecular and Cellular Biochemisyty,2011,351(12):4158.
(收稿日期:2019-11-16 修回日期:2019-12-31)
(编辑:王琳葵 梁明佩)
