SB203580对LPS诱导的肺泡巨噬细胞NR8383促炎表型的影响
2020-02-28李桂荣沈忱悠杨振坤谈建新赵晶晶聂晓伟陈静瑜
李桂荣,沈忱悠,杨振坤,谈建新,赵晶晶,邹 健,聂晓伟,陈静瑜
肺泡巨噬细胞是肺组织中的天然免疫细胞,占肺组织常驻细胞的85%以上,具有分泌、吞噬、促炎、抗炎和组织修复的功能,是肺组织的第一道防御[1-4]。多样性和可塑性是巨噬细胞的显著特征,能够根据周围组织微环境的变化呈现不同的表型。巨噬细胞表型分类有两种:一种是经典的M1型,表型标志蛋白有iNOS、TNF-α、IL-12、IL-6等,是促炎的表型,释放促炎因子及介质,促进炎症的发展;另一种是可替代性的M2型,表型标志蛋白有精氨酸酶1(Arg1)、IL-10、发现于炎症分子区1(FIZZ1)等,是抗炎的表型,能够释放抑炎因子及介质,促进组织的修复。因此,肺泡巨噬细胞在肺组织炎症的生理发展过程中有关键的免疫调节作用[5-6]。在巨噬细胞活化的过程中,一些蛋白分子对其表型有关键的调控作用,如IRF5蛋白作为干扰素调节因子家族的一个重要成员,对炎症性的巨噬细胞表型有关键的调节作用。在M2型巨噬细胞中过表达IRF5导致M2型转化成M1型,在M1巨噬细胞中敲掉IRF5巨噬细胞,导致M1巨噬细胞转化成M2巨噬细胞[7]。p38MAPK信号途径是MAPK信号通路的关键分支之一,参与到细胞周期、细胞应激以及炎症等多种病理生理过程。p38MAPK在转录和翻译水平参与到炎症介质的合成,是抗炎治疗的靶标之一。SB203580能够特异性地抑制p38MAPK的磷酸化,抑制p38MAPK信号通路。本研究旨在探讨SB203580对肺泡巨噬细胞极化作用的影响。
1 资料与方法
1.1 一般资料:配制SDS-PAGE电泳胶的试剂有30%丙烯酰胺-甲叉双丙烯酰胺(30%Acr-Bis)、分离胶缓冲液、浓缩胶缓冲液、过硫酸铵、TEMED以及二抗(HRP标记的羊抗鼠二抗,HRP标记的羊抗兔二抗)均购自上海碧云天生物技术有限公司。抗体如IRF5、诱导型一氧化氮合酶(iNOS)、Arg1购自Abcam公司,内参抗体β-actin购自康为世纪生物公司。荧光二抗、含DAPI染料的防淬灭封片剂购自Invitrogen公司。胎牛血清、胰酶、双抗,购自BI公司,F-12K培养基购自Thermo公司。肺泡巨噬细胞NR8383购自复旦IBS细胞资源中心。
1.2 实验方法
1.2.1 炎症细胞模型的建立:从液氮中取出冻存肺泡巨噬细胞NR8383进行复苏,用含15%胎牛血清的培养基传代培养;细胞传至2~3代后铺6孔板,LPS刺激细胞,给药浓度2 μg/mL,形成炎症细胞模型;在SB203580抑制剂组,提前30 min给予SB203580,给药浓度50 μM,然后用LPS刺激。对照组给予与实验组相同体积的PBS。每个实验组设3个平行样,24 h后,收集细胞,用于后续实验。
1.2.2 Western blot实验:收集6孔板中的细胞,每孔给予150 μl 裂解液,置于冰上,裂解10 min,12 000 r/min,4 ℃离心,取上清液,得到裂解的细胞蛋白溶液。加入蛋白上样缓冲液,100 ℃煮沸5 min,SDS-PAGE电泳,70 V电压转膜2 h,5%牛奶室温封闭1 h,一抗IRF5、iNOS、p-NFκB p65、IκBα及内参β-actin分别孵育,4 ℃过夜。TBST洗涤3次后,在室温孵育HRP标记的二抗1.5 h,洗涤后ECL底物发光显色。G:Box 凝胶成像系统曝光,采集数据,Image J 软件对条带进行灰度分析,分别计算目标蛋白和内参蛋白β-actin的灰度值,目标蛋白与内参蛋白β-actin的比值作为各组实验依据。
1.2.3 细胞免疫荧光实验:细胞建模后,收集悬浮的肺泡巨噬细胞,PBS洗涤后重悬,调整细胞浓度1×106个/mL,取30 μl细胞悬液滴在载玻片上,风干后以4%多聚甲醛固定,用含0.2% TritonX100的PBS洗涤3次,10 min/次,5%的牛奶封闭30 min,在含有1% BSA的PBS溶液中孵育兔源一抗iNOS,4 ℃过夜。PBS洗涤3次,山羊抗兔的荧光二抗Alexa Flour 488室温孵育1 h,PBS洗涤3次,含DAPI染料的防淬灭封片剂封片。用莱卡共聚焦显微镜拍照。
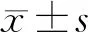
2 结果
2.1 SB203580对肺泡巨噬细胞中IRF5蛋白表达的影响:Western blot检测肺泡巨噬细胞中IRF5蛋白表达变化,LPS组中 IRF5蛋白与β-actin内参蛋白条带的灰度比值为0.496 3,对照组为0.395 4,SB203580处理组为0.305 7。用LPS刺激后,细胞中IRF5蛋白表达增加,蛋白条带灰度分析与对照组比较差异有统计学意义(P<0.05)。给予SB203580后,IRF5蛋白表达显著被抑制,蛋白条带灰度分析结果显示,与LPS刺激组比较差异有统计学意义(P<0.05),见图1(目录后)。
2.2 SB203580对肺泡巨噬细胞M1表型标志蛋白的影响:巨噬细胞M1表型的标志蛋白iNOS在LPS刺激后表达增加(与内参条带灰度比为0.8185),与对照组(与内参条带灰度比为0.0832)比较差异有统计学意义(P<0.05);给予抑制剂SB203580处理后(与内参条带灰度比为0.66)iNOS的表达下降,与LPS刺激组比较差异有统计学意义(P<0.05)。细胞免疫荧光实验显示在LPS处理后,细胞中iNOS的荧光强度增加;SB203580处理后,细胞中iNOS的荧光强度减弱。因此,SB203580抑制了肺泡巨噬细胞NR8383的促炎表型,见图2(目录后)。
2.3 SB203580对肺泡巨噬细胞中NFκB信号通路的影响:LPS刺激肺泡巨噬细胞后,NFκB信号通路被激活,p-NFκB p65高表达(与内参条带灰度比为1.222),与对照组(与内参条带灰度比为0.360 1)比较差异有统计学意义(P<0.05);给予SB203580后,抑制了LPS诱导的肺泡巨噬细胞中NFκB信号通路的激活,p-NFκB p65表达被抑制(与内参条带灰度比为0.679 7),与LPS刺激组比较差异有统计学意义(P<0.05)。
3 讨论
肺泡巨噬细胞是肺组织常驻细胞,在肺组织的稳态和各种肺部疾病的免疫防御中发挥重要的作用,如在急性呼吸窘迫综合征、慢性阻塞性肺疾病、囊性纤维化等疾病中发挥免疫调节作用[8-9]。多样性和可塑性是巨噬细胞的显著特征,在不同的环境下,肺泡巨噬细胞呈现出不同的表型,即经典的M1和可选择性的M2型,发挥不同的免疫调节作用。IFN-γ,TNF或Toll-like receptor(TLR)的配体刺激巨噬细胞,巨噬细胞呈现M1表型,释放促炎的因子,加剧组织的损伤;IL-4,IL-13或M-CSF刺激巨噬细胞呈现M2型,释放抗炎的因子,促进组织的修复。不同的微环境下,巨噬细胞呈现不同的表型,同时涉及各种蛋白的过表达及各种信号通路的激活。本研究在体外的肺泡巨噬细胞炎症模型中,给予p38MAPK信号通路的抑制剂SB203580,抑制了肺泡巨噬细胞的促炎表型;此外,SB203580还抑制了肺泡巨噬细胞中NFκB信号途径的激活,这说明在LPS诱导的肺泡巨噬细胞的炎症表型中,伴随着NFκB信号途径的激活。
IRF5是干扰素家族的一个重要成员,表达在很多细胞中,如巨噬细胞、树突细胞和B细胞[10]。IRF5在确定M1型炎症巨噬细胞中起到关键的调节作用,在人单核细胞和鼠骨髓细胞分化成炎症巨噬细胞期间,IRF5被诱导表达,转录调节促炎因子[7,11]。本研究中,LPS刺激肺泡巨噬细胞NR8383后,IRF5表达显著增加,M1巨噬细胞标志蛋白iNOS表达显著增加,给予p38MAPK抑制剂SB203580后,IRF5表达被抑制,iNOS表达显著下调,表明SB203580显著地抑制了肺泡巨噬细胞的促炎表型。
NFκB信号途径被认为典型的促进炎症反应的信号通路,能够上调促进炎症反应的细胞因子,趋化因子和黏附分子的表达,在肺部疾病的炎症反应中有关键的免疫调节作用[12-13]。在本研究中,LPS诱导的肺泡巨噬细胞炎症模型中,NFκB信号途径被激活,p-NFκB p65表达显著增加,给予SB203580后,p-NFκB p65表达下调,NFκB信号途径的激活被抑制。SB203580对肺泡巨噬细胞促炎表型的抑制作用可能依赖于NFκB信号途径激活。因此,SB203580具有通过抑制体内肺泡巨噬细胞的促炎表型,进而抑制细胞内促进炎症反应的NFκB信号通路的激活,达到治疗肺组织炎症疾病的目的。
总之,SB203580能够体外抑制诱导的肺泡巨噬细胞的促炎表型,同时也抑制NFκB信号途径的激活,这为临床通过抑制肺泡巨噬细胞的促炎表型降低肺组织炎症损伤提供实验依据和理论基础。
