人参中达玛烷型皂苷的化学转化产物结构和转化途径研究
2020-02-28王秋颖吴冬雪赵幻希孙秀丽刘淑莹
王秋颖,吴冬雪,赵幻希,李 雪,孙秀丽,修 洋*,刘淑莹,2*
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,吉林 长春 130022)
人参皂苷是人参(PanaxginsengC.A.Meyer)的主要活性成分。根据皂苷元的结构,人参皂苷被分为达玛烷型、齐墩果酸型和奥克梯隆型。达玛烷型皂苷的种类和含量均相对较高,是人参中最主要的一类皂苷。达玛烷型皂苷可分为原人参二醇(Protopanaxdiol,PPD)型,如人参皂苷Rb1、Rc、Rh2等和原人参三醇(Protopanaxtriol,PPT)型,如人参皂苷Re、Rg1、三七皂苷R1等[1-2]。目前发现的人参皂苷有100余种[3-4],大多具有抗肿瘤、抗炎、抗疲劳、免疫调节、保护中枢神经等良好的药理活性[5-8]。研究表明,人参皂苷抗肿瘤的活性与糖基数量有关,皂苷抗肿瘤的活性随糖基数量的减少而增加[9]。例如,稀有人参皂苷20(R)-Rg3、Rk1和Rg5具有抗癌[10-13]、增强免疫力等功效[14]。然而人参中单体皂苷含量较低,约占人参干重的4%[15],许多具有良好药理活性的稀有皂苷在人参中并不存在,只能通过转化等方法获得[16]。
人参皂苷的转化方法可以分为化学转化和生物转化[17-21]。生物转化大多采用各种酶转化制备稀有皂苷,虽具有较高的转化产物选择性,但转化时间通常较长、转化效率较低。Wan等[22]利用曲霉中的β-半乳糖苷酶在60 ℃下连续反应60 h,将原人参二醇型皂苷转化为稀有皂苷。然而,过长的反应时间并不利于方法的大规模应用。化学转化相比于生物转化具有更高的转化效率和更低的成本,是获得稀有人参皂苷的快速而有效的方法。杂多酸是P、Si等杂原子和Mo、W等配位原子通过氧原子配位桥联形成的一类含氧酸化合物[23-24],相对于矿物酸具有更强的质子酸性,在催化糖苷键水解、水合和脱水等反应时表现出更高的效率和选择性,并且便于回收利用[25-26],是转化中药有效成分的良好选择。本研究基于高效液相色谱-电喷雾-多级串联质谱(HPLC-ESI-MSn)技术,以12-磷钨酸(H3PW12O40·10H2O)为化学转化试剂,系统研究了3种达玛烷型皂苷(三七皂苷R1,人参皂苷Rd、20(S)-Rg3)化学转化的产物结构和相对含量,总结了人参中达玛烷型皂苷化学转化的主要途径和规律。
1 实验部分
1.1 试剂与仪器
Dionex Ultimate 3000高效液相色谱(配备四元泵、在线真空脱气机、自动进样器和柱温箱)、LTQ XL线性离子阱质谱仪、Thermo Syncronis C18色谱柱(100 mm × 2.1 mm,1.7 μm)(均购自Thermo Scientific公司),水浴恒温振荡器(上海百典仪器设备有限公司)。
人参皂苷20(S)-Rg3、20(R)-Rg3、Rk1、Rg5、Rd、三七皂苷R1对照品及12-磷钨酸(均购自上海源叶生物科技有限公司),色谱级甲醇、乙腈、甲酸(均购自Tedia公司),0.22 μm的水相微孔滤膜(天津津腾科技有限公司),超纯水(电阻率18.2 MΩ·cm)由Milli-Q纯水机(美国Merck Millipore公司)制备。其它试剂均为分析纯。
1.2 方法与条件
1.2.1 人参皂苷的化学转化反应配制1.44 mg/mL的12-磷钨酸水溶液2 mL,置于闪点瓶中。加入2.00 mg人参皂苷标准品,充分摇匀。将闪点瓶置于80 ℃的水浴摇床连续转化5 h,每隔30 min取出200 μL反应溶液置于1 mL容量瓶中,加水定容,过0.22 μm水相微孔滤膜后,待测。
1.2.2 色谱条件流动相:A为0.1%甲酸水,B为乙腈。梯度洗脱:0~5 min,75%~70%A;5~8 min,70%~64%A;8~15 min,64%~52%A;15~20 min,52%~30%A;20~25 min,30%~10%A;25~28 min,10%A;28~34 min,10%~75%A。流速:0.2 mL/min,柱温:35 ℃,进样量:1 μL。
1.2.3 质谱条件ESI离子源,负离子扫描模式,离子源毛细管温度:325 ℃,鞘气:241 kPa,辅助气:3 300 mL/min,吹扫气:1 000 mL/min,毛细管电压:-2 500 V。质谱采用全扫描和多级串联模式,两模式的质量范围分别为m/z100~2 000和m/z200~1 200。
1.3 碎片离子命名规则
采用Costello规则命名人参皂苷糖苷键断裂产生的碎片离子[27]。以Y、Z分别表示氧原子是、否保留在还原端,0、1分别表示糖基链自还原端起的第1个糖苷键和第2个糖苷键,α、β分别表示C20位糖基链和C3位(PPD型)或C6位(PPT型)糖基链,符号′和″分别表示另1条糖基链自还原端起的第1个糖苷键和第2个糖苷键。

图1 三七皂苷R1化学转化5 h产物的总离子流图
2 结果与讨论
2.1 PPT型皂苷R1的转化产物结构分析
利用HPLC-ESI-MSn对原人参三醇型皂苷R1的转化产物进行分离和分析,总离子流图如图1所示,共有9种转化产物,依次命名为峰1~9。
图1中峰1和2的基峰为m/z833.53,说明它们是1对同分异构体。对峰1和峰2的基峰进行串联质谱分析,得到m/z787.53的碎片离子。在负离子扫描模式下,人参皂苷易于结合甲酸根形成[M+HCOO]-离子,在串联质谱分析中脱除46 Da的甲酸形成[M-H]-离子。由此可以推断峰1和2的相对分子质量为788.53。进一步对[M-H]-离子进行二级串联质谱分析,结果如图2所示。
图2中观察到Y1β和Y0β两个主要碎片离子。Y1β离子与母离子有-132 Da的质量差异,是由母离子丢失1分子木糖所形成。Y0β离子则是由Y1β离子丢失1分子葡萄糖(162 Da)所形成,表明峰1和2的结构中存在1分子葡萄糖和1分子木糖,对应于反应物R1中C6位的糖基取代基结构。与原人参三醇型皂苷元的特征碎片离子m/z475.53相比,Y0β离子有+18.06 Da的质量差异,说明产物1和2是反应物R1脱除C20位糖基取代基后,在C24、C25位发生水合反应后的产物,由人参皂苷元的结构可以推断,水合反应遵循Markovnikov规则,即羟基加成在氢原子较少的C25位[28-29]。在C20位的手性碳原子产生的人参皂苷差向异构体中,20(S)型异构体的极性大于20(R)型,在C18反相色谱柱中先出峰。因此确定峰1和2分别为人参皂苷20(S)-25-OH-R2和20(R)-25-OH-R2。

图2 人参皂苷20(S)-25-OH-R2的[M-H]-离子m/z 787.53的二级串联质谱图
峰3的相对分子质量为770.53,对其[M-H]-离子进行串联质谱分析,结果如图3所示。两个主要碎片离子Y1β和Y0β分别由母离子丢失1分子木糖(132 Da)和Y1β离子丢失1分子葡萄糖(162 Da)所形成。在图3中还观察到m/z417.51离子,通过对Y0β离子进行三级串联质谱分析发现,m/z417.51是Y0β的子离子。两个离子的质量差异为58.02 Da,对应于连接了2个甲基的叔醇结构(C3H6O),由此推断m/z417.51是由Y0β丢失了C25位的叔醇结构所产生,说明峰3与峰1和2均发生了C24-C25位的水合反应。然而,峰3皂苷元离子的质荷比仍为475.53,说明其在C20位的羟基发生脱水反应(-18 Da),弥补了水合反应导致的质量增加,因此可推断峰3为人参皂苷25-OH-T5。

图3 人参皂苷25-OH-T5的[M-H]-离子m/z 769.53的二级串联质谱图
峰4、5、6、7是相对分子质量为770.53的同分异构体,与反应物R1的相对分子质量932.53相差162 Da。结合峰4和5的[M-H]-离子的串联质谱图(如图4),由Y1β和Y0β离子可以推断峰4、5、6、7是由反应物R1脱除C20位的葡萄糖取代基的产物。根据这4种产物的保留时间,推断峰4和5、峰6和7具有相似的皂苷元结构。图4中除了Y0β和Y1β离子之外,还有碎片离子m/z391.38。通过对Y0β离子进行三级串联质谱分析发现,m/z391.38离子是由Y0β离子中性丢失84.18 Da所产生。84.18 Da对应于皂苷元离子C20位的烯烃链(C6H12),因此可以推断皂苷元离子丢失C20位烯烃链产生m/z391.38的特征碎片离子,由此证明峰4和5的C24-C25位未发生水合反应,仅为反应物R1丢失1分子葡萄糖所形成的产物。因此将峰4和5分别归属为人参皂苷20(S)-R2和20(R)-R2。

图4 人参皂苷20(S)-R2的[M-H]-离子m/z 769.53的二级串联质谱图
在峰6和峰7的[M-H]-离子的串联质谱图(图5)中,除了Y0β和Y1β离子,同时出现了m/z391.38和m/z417.39离子。说明峰6和7的皂苷元离子可以同时产生58.01 Da和84.15 Da的中性丢失。由此推断峰6和7的皂苷元发生了环合反应,即C20位羟基与C24-C25位双键加成,形成含氧6元环结构。m/z391.38对应于C20-C22和C25位C—O键断裂产生的碎片离子;m/z417.39对应于C24-C25和C20位C—O键断裂产生的碎片离子。可以看出,在发生环合反应后,C20仍具有手性,即峰6和7为差向异构体。因此将峰6和7分别归属为人参皂苷20(S)-25-epoxy-R2和20(R)-25-epoxy-R2。

图5 人参皂苷20(S)-25-epoxy-R2的[M-H]-离子m/z 769.56的二级串联质谱图
峰8和9的相对分子质量为752.53,对其[M-H]-离子m/z751.56进行串联质谱分析可得到Y1β离子和Y0β离子,结果如图6所示。Y1β离子与母离子有-132.01 Da的质量差异,是由母离子丢失1分子木糖所形成。Y0β离子则是由Y1β离子丢失1分子葡萄糖(162.02 Da)所形成。Y0β离子与反应物R1皂苷元离子m/z475.53相差-18 Da,可以推断在C20位发生糖苷键断裂后又发生了脱水反应。因此将峰8和9分别归属为T5和3β,12β-二羟基-6α-(2-O-β-D-吡喃木糖基-β-D-吡喃葡糖氧基)达玛烷-20(22),24-二烯。

图6 人参皂苷T5的[M-H]-离子m/z 751.56的二级串联质谱图

图7 人参皂苷Rd化学转化5 h产物的总离子流图
2.2 PPD型人参皂苷的转化
Rd经过转化获得10种不同产物,总离子流图如图7所示。峰1和2的质谱图基峰为m/z847.55,对峰1和2的基峰离子进行串联质谱分析,得到m/z801.55的碎片离子。进一步对[M-H]-离子进行串联质谱分析(图8),可以观察到2个主要碎片离子Y1β、Y0β,分别是母离子丢失1分子葡萄糖(162.02 Da)和2分子葡萄糖(324.02 Da)的产物,说明峰1和2的结构中存在2分子葡萄糖取代基。在串联质谱图中还观察到碎片离子m/z419.51。通过对Y0β离子进行三级串联质谱分析发现,m/z419.51是Y0β的子离子。2个离子的质量差异为58.02 Da,对应于连接了2个甲基的叔醇结构(C3H6O),由此推断m/z419.51离子是由Y0β离子丢失了C25位的叔醇结构所产生。另一方面,Y0β离子与原人参二醇型皂苷元的特征结构m/z459.53相比有+18 Da的质量差异,推断峰1和2是反应物Rd脱除C20位糖基取代后,在C24、C25位发生水合作用后的转化产物,因此可判断峰1和2分别为人参皂苷20(S)-25-OH-Rg3和20(R)-25-OH-Rg3。

图8 人参皂苷20(S)-25-OH-Rg3的[M-H]-离子m/z 801.55的二级串联质谱图


图9 人参皂苷25-OH-Rk1(A)、20(S)-Rg3(B)和20(S)-25-epoxy-Rg3(C)的[M-H]-离子m/z 783.55的二级串联质谱图
峰3~8的相对分子质量均为784.55,与Rd的相对分子质量相差162 Da,结合峰3~8的[M-H]-离子的串联质谱图(图9),由Y1β和Y0β可以推断峰3~8是由反应物Rd在C20位发生糖苷键断裂后所生成的6个同分异构体。6种产物的保留时间相近,可以推断峰3和4、峰5和6、峰7和8具有相似的皂苷元结构。图9A中除了Y1β和Y0β离子之外,出现了特征碎片离子m/z401.34。三级串联质谱分析表明m/z401.34是Y0β中性丢失58.11 Da产生,由此推断峰3和4在C24-C25位发生水合反应。但皂苷元离子的质荷比仍为459.45,说明其在C20位的羟基还发生了脱水反应(-18 Da)。因此推断峰3和4分别为人参皂苷25-OH-Rk1和25-OH-Rg5。通过比对标准品可以确定,峰5和6分别为人参皂苷20(S)-Rg3和20(R)-Rg3。对峰7和8的[M-H]-离子进行串联质谱分析(图9C),同时出现了m/z375.41和m/z401.42离子,即峰7和8的皂苷元离子可以同时产生58.01 Da和84.02 Da的中性丢失,由此推断峰7和8的皂苷元发生了环合反应,确定峰7和8分别为人参皂苷20(S,25)-epoxy-Rg3和20(R,25)-epoxy-Rg3。
如图10所示,峰9和10的相对分子质量为766.55,对其[M-H]-离子m/z765.55进行串联质谱分析可得到Y1β和Y0β离子,Y0β与反应物Rd皂苷元离子m/z459.53相差-18.02 Da,由此推测峰9和10为Rd在C20位发生去糖基化反应后进一步发生脱水反应的产物,经标准品比对确定其分别为Rk1和Rg5。
利用相同的反应条件对20(S)-Rg3进行转化,得到10种与Rd相同的产物,即20(S)-25-OH-Rg3、20(R)-25-OH-Rg3、25-OH-Rk1、25-OH-Rg5、20(S)-Rg3、20(R)-Rg3、(20S,25)-epoxy-Rg3、(20R,25)-epoxy-Rg3、Rk1和Rg5。
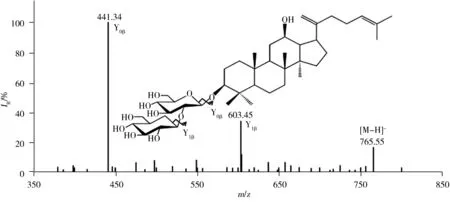
图10 人参皂苷Rk1的[M-H]-离子m/z 765.55的二级串联质谱图

图11 人参皂苷20(S)-Rg3和Rd转化的20(S)-25-OH-Rg3的峰面积
2.3 Rd和20(S)-Rg3化学转化产物的相对含量分析
采用HPLC-ESI-MSn质谱的选择离子扫描(SIM)模式对Rd和20(S)-Rg3的转化产物20(S)-25-OH-Rg3进行相对定量分析,产物的峰面积随反应时间的变化结果如图11所示。结果显示,在相同的反应条件下20(S)-Rg3转化得到的20(S)-25-OH-Rg3相对含量在各时间点均明显高于Rd,这是由于Rd转化为20(S)-25-OH-Rg3需先脱除C20位的葡萄糖取代基,与20(S)-Rg3相比反应更复杂,并且需要更高的反应能量。20(S)-25-OH-Rg3的相对含量在反应初始阶段逐渐升高,当达到一定浓度后又开始降低,这是因为20(S)-25-OH-Rg3可通过C20位的水合反应进一步生成转化产物25-OH-Rk1和25-OH-Rg5,直至达到反应平衡。由此可知,人参皂苷的多种化学转化途径中包含可逆反应,转化产物之间也可以发生互相转化。
进一步比较了20(S)-Rg3的转化产物R型与S型25-OH-Rg3在0~4 h内相对含量的变化规律,结果表明在转化初期的0.5 h内,只有S型产物生成,随后R型产物的相对含量逐渐增加。S型产物的含量在各时间点均明显高于R型,这是因为反应初始阶段20(S)-Rg3首先发生差向异构化反应生成20(R)-Rg3,随后20(R)-Rg3在C25位发生水合反应生成20(R)-25-OH-Rg3,而反应物20(S)-Rg3只需发生一步水合反应即可生成20(S)-25-OH-Rg3。
进一步考察了Rd转化产物20(S)-Rg3的相对含量随反应时间的变化趋势,结果显示,反应开始后0.5 h时20(S)-Rg3的相对含量达到最高,此后随反应时间的增加而逐渐下降,说明20(S)-Rg3是Rd其他转化产物的中间产物,由它生成其他多种稀有皂苷。由此证明,人参皂苷在化学转化时首先发生C20位脱糖的去糖基化反应,然后进行水合、脱水和环合等反应过程。
3 结 论
利用HPLC-ESI-MSn技术研究了3种达玛烷型人参皂苷在酸性环境下化学转化产物的结构和转化途径,多级串联质谱分析结果显示三七皂苷R1转化得到9种产物:20(S)-25-OH-R2、20(R)-25-OH-R2、25-OH-T5、20(S)-R2、20(R)-R2、20(S)-25-epoxy-R2、20(R)-25-epoxy-R2、T5、3β,12β-二羟基-6α-(2-O-β-D-吡喃木糖基-β-D-吡喃葡糖氧基)达玛烷-20(22),24-二烯;Rd和20(S)-Rg3转化得到10种产物:20(S)-25-OH-Rg3、20(R)-25-OH-Rg3、25-OH-Rk1、25-OH-Rg5、20(S)-Rg3、20(R)-Rg3、(20S,25)-epoxy-Rg3、(20R,25)-epoxy-Rg3、Rk1、Rg5。通过分析转化产物的相对含量,发现化学转化过程中首先发生C20位去糖基化反应,由去糖基化产物继续转化为其它产物,其它产物之间通过可逆反应相互转化,直至反应平衡。通过总结转化产物的结构特征,获得达玛烷型皂苷化学转化所发生的主要反应历程:①去糖基化反应:优先脱除C20位的糖基取代基;②差向异构化反应:由去糖基化后C20位手性碳原子的2种构型所形成;③水合反应:C24和C25位双键加成1个水分子,羟基加成在C25位;④脱水反应:C20的羟基与C21或C22位β氢原子发生清除反应,生成Δ20(21)和Δ20(22)的同分异构体;⑤环合反应:C20位羟基与C24和C25位双键加成,形成含氧六元环结构。此外,还观察到一些特征中性丢失,即皂苷元离子C24和C25断裂产生58 Da以及在C20和C22位断裂产生的84 Da,它们分别代表皂苷元的烯烃链发生了水合反应和烯烃链结构未发生变化。当2种中性丢失同时发生时,可以推断达玛烷型皂苷发生了环合反应。以上结果表明,磷钨酸产生的酸性环境可以有效地将达玛烷型皂苷转化为稀有皂苷,并且HPLC-ESI-MSn是皂苷转化产物结构和途径分析的有效方法。
