低剂量地西他滨联合低剂量化疗治疗骨髓增生异常综合征伴原始细胞过多的临床疗效
2020-02-27李梦琳王树娟王伟琼姜中兴刘延方
李梦琳,王树娟,王 冲,王伟琼,孙 慧,孙 玲,姜中兴,刘延方
郑州大学第一附属医院血液科 郑州 450052
骨髓增生异常综合征(myelodysplastic syndrome, MDS)是起源于造血干细胞的一组异质性髓系克隆性疾病,其伴原始细胞过多的亚型(MDS with excess blasts, MDS-EB)具有向急性髓系白血病(acute myeloid leukemia, AML)转化的高风险,预后差,生存时间短[1-2]。目前认为异基因造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是治愈MDS-EB的唯一方法[1,3]。去甲基化药物如地西他滨(decitabine, DAC)或阿扎胞苷能够延长部分患者生存期,既往报道[4-6]常规剂量DAC(20 mg·m-2·d-1)治疗MDS的完全缓解率低,达到完全缓解(complete remission, CR)需要3~4个疗程,骨髓抑制毒性严重,限制了该药的广泛应用。国产DAC的可及性为临床探讨不同剂量,尤其是低剂量DAC联合低剂量化疗治疗MDS-EB提供了可能。本研究分析了低剂量(≤15 mg·m-2·d-1)DAC单药或联合低剂量化疗方案治疗MDS-EB的临床疗效及不良反应等,旨在为临床安全应用DAC治疗不适合行HSCT的MDS-EB患者提供依据。
1 对象与方法
1.1研究对象收集郑州大学第一附属医院2016年4月至2018年12月初诊且接受低剂量DAC治疗的MDS-EB患者88例。纳入标准:①入院后均予血常规、血生化、骨髓细胞学、免疫表型等实验室检查,按WHO(2016)分型标准可明确诊断为MDS-EB(原始粒细胞>5%)。②接受低剂量DAC治疗至少1个疗程,并能对其疗效和不良反应进行评价。③均未行HSCT。所有患者均按MDS国际预后积分系统(international prognostic staging system, IPSS)进行预后分层[1]。
1.2治疗方案88例患者根据治疗方案不同分为2组。单药组(n=34):DAC 5~7 mg·m-2·d-1持续应用10 d,或15 mg·m-2·d-1持续5 d,静脉滴注,28 d为一个疗程。DAC联合低剂量化疗方案组(联合组,n=54):如DAC+CAG方案中DAC用法及用量同单药组;阿克拉霉素20 mg,第1、3、5天静脉滴注;阿糖胞苷10 mg/m2,12 h 1次,第1~7天静脉滴注;粒细胞集落刺激因子300 μg/d,第1~7天皮下注射。DAC+MA方案中DAC用法及用量同单药组;米托蒽醌 10 mg/m2,第1~7天静脉滴注;阿糖胞苷100 mg/m2,第1~7天静脉滴注。28天为一个疗程。如果患者出现严重不良反应(如3级以上感染及骨髓抑制),根据情况适当延迟下一疗程的治疗。化疗过程中每2 d监测患者体温一次,定期监测血常规及生化指标等,必要时输注成分血支持治疗(当血红蛋白<60 g/L时,输注悬浮红细胞;血小板计数<30×109个/L,输注机采血小板),出现发热等感染表现时,予抗感染等治疗,直至骨髓及外周血指标恢复正常。
1.3临床疗效及不良反应评价依据骨髓增生异常综合征中国诊断与治疗指南(2019年版)[1,7]判定疗效。总体反应率(overall response rate, ORR)为CR、部分缓解(partial remission, PR)、骨髓完全缓解(marrow complete remission, mCR)、血液学改善(hematopoietic improvement, HI)例数之和与总例数的比值。本研究以患者治疗期间达到的最佳疗效来进行疗效分析。不良反应分级根据美国国立肿瘤研究所常见毒性标准(Version 4.0)进行判定,其中血细胞减少按照每个疗程化疗期间及化疗结束后细胞最低水平进行分级。
1.4随访随访时间从疾病确诊之日起至2018年12月31日止。随访资料来源于患者的门诊、住院病历资料及电话随访记录。总生存(overall survival, OS)时间定义为确诊至随访截止日期或患者死亡日期。无进展生存(progression free survival, PFS)时间定义为从治疗开始至疾病进展、复发或患者死亡的时间。
1.5统计学处理用SPSS 21.0处理数据。2组患者临床特征及疗效的比较采用秩和检验或χ2检验,不良反应发生情况的比较采用秩和检验,生存分析采用Kaplan-Meier法。检验水准α=0.05。
2 结果
2.12组临床特征的比较联合组MDS-EB-Ⅱ型患者比例及IPSS中危-2+高危患者比例均高于单药组,2组患者的年龄、性别、治疗前血象及化疗疗程数差异无统计学意义(表1)。
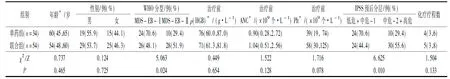
表1 2组患者临床特征分析
2.22组疗效比较2组均无PR病例。单药组CR 7例,mCR 11例,HI 4例,治疗失败12例,联合组分别为26、26、0、2例,联合组总体疗效优于单药组(χ2=4.100,P<0.001)。联合组ORR为96.3%(52/54),高于单药组[64.7%(22/34)](χ2=13.049,P<0.001);CR率为48.1%(26/54),亦高于单药组[20.6%(7/34)](χ2=6.761,P=0.009)。
2.32组不良反应比较88例患者均出现了不同程度的骨髓抑制和感染。其中,联合组中性粒细胞减少较单药组严重,其他指标2组间差异均无统计学意义(表2),经对症治疗后均好转。

表2 2组不良反应比较 例
2.4生存分析两组患者PFS生存曲线差异无统计学意义(χ2=2.532,P=0.112),OS生存曲线差异有统计学意义(χ2=5.081,P=0.024)(图1),联合组预后好于单药组。
单药组随访期间有11例患者死亡,其中4例死于严重感染,1例死于急性心肌梗死,余6例死于院外(具体死因不详);联合组有9例死亡,4例死于严重感染,1例死于颅内出血,余4例死于院外(具体死因不详)。

图1 单药组与联合组PFS(左)和OS(右)生存曲线
3 讨论
WHO(2016)血液肿瘤分型将MDS-EB按骨髓原始细胞占有核细胞比例的不同分为MDS-EB-Ⅰ、MDS-EB-Ⅱ。研究[1,3]表明,25%MDS-EB-Ⅰ和55%MDS-EB-Ⅱ患者在治疗第1年进展为AML,目前没有一种药物能够将其治愈,HSCT是唯一的方法。但MDS患者一般以中老年人居多,因年龄偏高、免疫力低下、脏器功能不全等因素,难以承受异基因HSCT[1,8]。近几年,随着表观遗传学的不断进展,研究[9]发现DNA甲基化异常与MDS的发生发展存在密切关联,同时由于甲基化过程的可逆性,去甲基化成为治疗MDS的一种新方式。DAC作为一种去甲基化药物,为当前治疗MDS的常用药物,既往研究多为单药应用,剂量偏大,虽可改善患者生活质量,延长患者生存期,但因毒副反应严重,限制了其广泛应用[3-4]。
近年来研究[4,10]发现,DAC单药治疗MDS-EB的ORR较低(38.9%~67.9%)。故国内外许多研究[10-12]将DAC与其他治疗方案联合应用治疗MDS,比如组蛋白去乙酰化酶抑制剂、蛋白激酶、参与细胞代谢酶药物、免疫检查点抑制剂(PD-1/PD-L1)等。国内有研究[11]采用DAC联合低剂量IA方案治疗MDS-EB,1~2个疗程后ORR为100%,CR率为21.1%,中位PFS为10个月,优于单用DAC治疗(ORR为38.9%,中位PFS为6个月)。还有研究[5-6]将DAC联合CAG方案或HAG方案,治疗效果亦优于单用DAC。上述研究应用的DAC剂量均偏高,故其骨髓抑制毒性较大。随着国产DAC的上市,每支10 mg的剂型使得探讨低剂量DAC治疗MDS成为可能。
本研究回顾性分析了接受低剂量DAC或低剂量DAC联合低剂量化疗治疗的88例MDS-EB患者的资料,单药组ORR为64.7%,CR率为20.6%,联合组ORR为96.3%,CR率为48.1%,且联合组预后较单药组明显改善,与既往研究[4-6,10-11]中较大剂量DAC的疗效相近。此外,联合组中MDS-EB-Ⅱ型患者所占比例高,且联合组预后相对高危者比例高于单药组,研究[4,13]发现此二者是MDS-EB预后的独立危险因素。本研究显示低剂量DAC单药或其联合其他方案化疗后主要不良反应为骨髓抑制及继发感染,非血液学不良反应发生率低,与既往报道[4-6,11-12,14-16]类似;此外,与单药组相比,联合组化疗后中性粒细胞减少较严重,但经对症处理可恢复。
综上所述,低剂量DAC联合低剂量化疗治疗MDS-EB比单用低剂量DAC总体疗效更佳,缓解率高,生存时间延长,对身体状况差且不适合行HSCT的MDS-EB患者更有应用价值。但本研究为单中心回顾性分析,存在着病例数相对较少,随访时间相对较短,且部分病例资料完整性欠佳等不足,需要前瞻性多中心研究进一步明确该方案的疗效。
