液液萃取-GFAAS法测定生物样品中的Cu(Ⅰ)
2020-02-25罗红军罗文鸿林哲绚
张 源, 吴 鹏, 李 慧, 罗红军, 罗文鸿, 林哲绚
汕头大学医学院生物分析实验室, 广东 汕头 515041
引 言
铜离子是生物体不可缺少的微量元素。 铜离子参与生物体一些重要的生理过程, 如细胞呼吸、 神经递质的传递、 抗氧化应激和铁离子的摄取[1]。 人体许多疾病与体内铜离子失衡有关, 如糖尿病、 心血管病[1]、 疯牛病[2]、 AD病[3]和癌症[4]等。 神经退行性疾病由人体丧失铜蓝蛋白的生物活性造成[5], 有可能与Cu(Ⅰ)的毒性有关[6]。 脑血栓病人血清小分子蛋白结合Cu(Ⅱ)含量发生变化, 同样会降低血清铜蓝蛋白活性[7]。 在生物体内, 铜以Cu(Ⅰ)或Cu(Ⅱ)和酶、 蛋白质分子以及一些生物小分子如氨基酸络合, 通过两个形态之间的转换而得以进行生物化学反应[8]。 当细胞内铜浓度过高时, Cu(Ⅰ)和Cu(Ⅱ)之间的氧化还原反应能催化产生毒性的羟自由基, 损伤脂肪、 蛋白质、 DNA等生物大分子[9]。 因此, 测定生物体系中的Cu(Ⅰ)或Cu(Ⅱ), 可以定量了解生物体内铜离子价态的变化, 对研究铜离子形态失衡有着重要的生理意义。
适宜pH条件下Cu(Ⅱ)与1,10-菲罗啉反应形成的Cu(Ⅱ)配合物在光照条件下还原成Cu(Ⅰ)配合物, 可用分光光度法测定试样中的Cu(Ⅰ)。 在碱性条件下, 1,10-菲罗啉与Cu(Ⅰ)形成的配合物在428 nm处有光吸收, 用三乙醇胺和亚硫酸钠联合保护Cu(Ⅰ)不被氧化, 可在混有Cu(Ⅱ)情况下直接测定Cu(Ⅰ)[10]。 含有Cu(Ⅰ)和Cu(Ⅱ)离子的样品与1.5 mmol·L-12-喹啉甲酸钠盐于pH 8.7混和后, 用毛细管电泳将两者分离后由紫外检测器可分别测定两者的浓度[11]。 在这些方法文献中, 测定Cu(Ⅰ)时大多集中在无机样品中, 且由于这些方法检测限高, 灵敏度低, 样品基体不复杂, 通常不适合测定生物样品中的痕量Cu(Ⅰ)浓度。 用石墨炉原子吸法(GFAAS)测定铜检测限低, 灵敏度高, 目前只能定量测定总铜[12], 无法区分其中的Cu(Ⅰ)和Cu(Ⅱ)。
在血清中, 铜蓝蛋白能结合血清中约90%的铜, 铜蓝蛋白既可以通过铜转运蛋白Ctr1结合Cu(Ⅰ), 也可结合血清中多余的Cu(Ⅱ)以抑制脂质过氧化作用发生[13]。 铜蓝蛋白主要通过其分子中的组氨酸残基上的氮与半胱酸残基上的硫与Cu(Ⅰ) 和Cu(Ⅱ)结合[14]。 在三氯乙酸的变性作用下, 血清中蛋白质中的铜可全部释放出来, 碱性条件下, 用盐酸羟胺将其中的Cu(Ⅱ)还原为Cu(Ⅰ), 利用Cu(Ⅰ)和BCA(2,2′-联喹啉-2,2′二甲酸)钠盐反应生成紫色络合物, 可用分光光度法测定血清或生物样品的总铜[15]。 上述文献表明, 血清中存在两种不同价态的铜, 但迄今为止, 没有相关文献报道血清中Cu(Ⅰ)的定量检测方法。
本研究利用碱性条件下甘氨酸螯合铜Cu(Ⅱ)溶于水不溶于有机溶剂[16]而亚铜试剂(2,2′-联喹啉)与Cu(Ⅰ)形成的络合物溶于有机溶剂而难溶于水的性质, 通过2,2′-联喹啉的有机溶剂处理含甘氨酸的水溶液生物样本将两种不同的形态铜分离在不同的水相和有机相中, 从而可以用GFAAS法测定有机相中的Cu(Ⅰ)。
1 实验部分
1.1 仪器与试剂
AA-7000型原子吸收光谱仪(岛津公司, 日本)。 铜空心阴极灯, 波长324.8 nm, 工作电流10 mA, 狭缝宽0.5 nm, 氘灯扣背景技术, 气流0.2 L·min-1, 进样体积20 μL, 峰高定量进样。 ASC-7000自动进样器, 涂层石墨管(日本岛津公司), 美国Millipore公司超纯水器。 Eppendorf微量移液管。 旋涡振荡器。 离心机。 所用玻璃和塑料器具用10%HNO3浸泡后用超纯水清洗三次。
CuCl标准品(99.999%, 阿拉丁); 65%HNO3(德国默克优级纯); 30%H2O2(德国默克优级纯); 正戊醇(德国默克优级纯); 1 g·L-1铜标准贮备液(国家钢铁材料测试中心)。
1.2 方法
1.2.1 标准品的保存及标准溶液的配制
CuCl标准品开封后, 用10只1 mL塑料管分装, 小心充入氩气, 将管内空气驱净后用密封胶封好管口, 并储存于放有硅胶的干燥器中。 配制工作曲线时, 取出其中一管, 称取CuCl的标准品0.015 6 g置于10 mL容量瓶, 用0.05% 2,2′-联喹啉的正戊醇溶液稀释至刻度线, 即1 000 ppm亚Cu标准溶液。 取100 μL用2,2′-联喹啉的正戊醇溶液依次稀释成10, 1, 0.1和0.01 ppm溶液, 取0.01 ppm溶液1 000 μL置2 mL消化管于95 ℃烘箱烘干(约5 h), 冷至室温后分别加入200 μL 65%硝酸和200 μL 30%双氧水密封, 80 ℃水浴1 h, 冷至室温后加入1 000 μL 1%HNO3, 上机时用1%HNO3作稀释剂, 自动进样器自动稀释成1, 2, 4, 8, 16 μg·L-1做工作曲线。
1.2.2 甘氨酸-NaOH缓冲溶液pH配制
处理不含蛋白的中性水溶液样本时, 所用甘氨酸-NaOH缓冲溶液pH用 0.05 mol·L-1甘氨酸和0.5 mol·L-1NaOH配至pH为9。 用20%三氯乙酸处理含蛋白的样本时, 由于三氯乙酸酸性较强, 为了使上机前的样液pH大约为9, 所用甘氨酸-NaOH缓冲溶液pH需要配到12.5(按体积比1∶3混合计算)。
1.2.3 样本收集
宫颈癌血清由汕头大学医学院附属医院肿瘤医院检验室提供, 健康人血清样本由汕头大学医学院第一附属医院体检中心检验室提供, 测定前储存于冰箱-80 ℃。
细胞匀浆液及细胞膜液样本制备: 人永生化肝细胞HL-7702细胞在DMEM/F12(1∶1,V/V)含10% NCS培养三天后, 去掉培养液, 收集细胞, 甘氨酸-NaOH缓冲溶液(pH, 9.0)洗涤3次。 于-80 ℃冰箱冻融三次破膜后, 15 000 g×30 min离心, 上清为胞浆液, BCA检测试剂盒检测蛋白浓度。 沉淀再经超声破碎, 用700 μL 2%Triton X-100溶解, 得即细胞膜液, BCA检测试剂盒检测蛋白浓度。
1.2.4 总Cu(TCu)含量测定
按文献[17]方法稍加改进: 取100 μL血清(200 μL细胞浆液或细胞膜液)置于6 mL特氟隆消化管, 防尘措施下置烘箱80 ℃敞口烘干(约6 h), 消解按1.2.1处理, 用1%硝酸稀释成1 000 μL, 上机用GFAAS法测定总铜。
1.2.5 Cu(Ⅰ)含量测定
400 μL血清(细胞匀浆液、 细胞膜液)与400 μL 20%三氯乙酸混匀, 1 200转离心10 min去蛋白, 取离心后上清液400 μL置5 mL塑料管内, 加入1 500 μL pH为12.5的甘氨酸-NaOH缓冲溶液, 混匀后加入1 000 μL 0.05% 2,2′-联喹啉的正戊醇溶液, 旋涡振荡1 min, 静置分层后取有机层500 μL于6 mL特氟隆消化管, 95 ℃烘箱烘干(约5 h), 消解按1.2.1处理, 室温加入600 μL, 上机用GFAAS法测定Cu(Ⅰ)。
2 结果与讨论
2.1 萃取条件的优化
2.1.1 Cu(Ⅰ)的络合试剂及其络合物的有机溶剂选择
血清中的蛋白经三氯乙酸沉淀, 全部铜以两种不同形态的铜释放出来[15]。 其中的Cu(Ⅰ)能与2,2′-联喹啉结合且形成的配合物易溶于有机溶剂而难溶于水。 选用2,2′-联喹啉作为Cu(Ⅰ)的络合试剂。 考虑正戊醇是一种微溶于水的无毒有机溶剂, 与水混溶后迅速形成均匀的乳浊液, 使得溶解在其中的2,2′-联喹啉能充分结合水相中的Cu(Ⅰ)离子, 形成的Cu(Ⅰ)配合物进入到正戊醇中。 放置后正戊醇由于密度(0.81)比水小, 很快浮在水面上层, 水相与有机相液界面非常清晰, 无须离心。 因此, 本文采用正戊醇作Cu(Ⅰ)试剂的有机溶剂。
2.1.2 Cu(Ⅱ)离子的配合剂选择及其浓度、 pH选择
如图1所示, 用含2,2′-联喹啉的正戊醇溶液与10 μg·L-1Cu(Ⅱ)的纯水溶液充分荡时, 有极少量Cu(Ⅱ)从水相转入有机相, 对测定混存的痕量Cu(Ⅰ)时会产生干扰。 产生这种原因, 很可能因Cu(Ⅱ)离子与溶液中OH-或Cl-形成了低极性的配合物。 要减少这种干扰, 就必须降低Cu(Ⅱ)离子从水相转入有机相的量。
甘氨酸分子属于极性氨基酸, 溶于极性溶剂, 难溶于非极性溶剂 。 甘氨酸能与Cu(Ⅱ)形成稳定的无机络合剂, 其稳定常数为15.1[18]。 因此选择甘氨酸作Cu(Ⅱ)离子的配合剂。
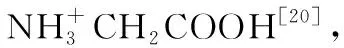

图1 甘氨酸对10 μg·L-1 Cu(Ⅱ)离子由水相进入有机相的影响
图2为混有8 μg·L-1Cu(Ⅰ)与10 μg·L-1Cu(Ⅱ)两种离子的水相经过甘氨酸和2,2′-联喹啉处理后, 转移到有机相中的铜分析结果。 从图2中可看出, 在考察的pH范围中, 8 μg·L-1Cu(Ⅰ)绝大部分能从水相转移到有机相中。 而Cu(Ⅱ)离子只有当缓冲溶液pH≥8时才不会进入到有机相, 说明pH≥8时Cu(Ⅱ)离子对Cu(Ⅰ)离子的测定基本上没有干扰。

图2 不同pH甘氨酸-NaOH缓冲溶液对水相中不同价态铜离子进入有机相的影响
Fig.2 Effects of different pH glycine-NaOH buffer solutions with copper ions entering organic phase
2.2 Cu(Ⅰ)离子的稳定性
2.2.1 标准溶液中Cu(Ⅰ)离子的稳定性
如图3所示, 移取5 μg·L-1Cu(Ⅰ)的氯化钾饱和溶液于10 mL塑料管内, 盖紧管口, 每隔1 h取出1 mL测定Cu(Ⅰ)浓度, 结果表明, 随着放置时间延长, Cu(Ⅰ)浓度会渐渐降低, 7 h后浓度几乎降低了一半。 将Cu(Ⅰ)直接溶于2,2′-联喹啉的有机相后, 由于其与配合剂生成稳定的配合物, 加上有机溶剂隔绝空气中的氧, 7 h内吸光度几乎没有什么变化。 因此, 短期内Cu(Ⅰ)标准溶液可用含2,2′-联喹啉正戊醇溶液配置。
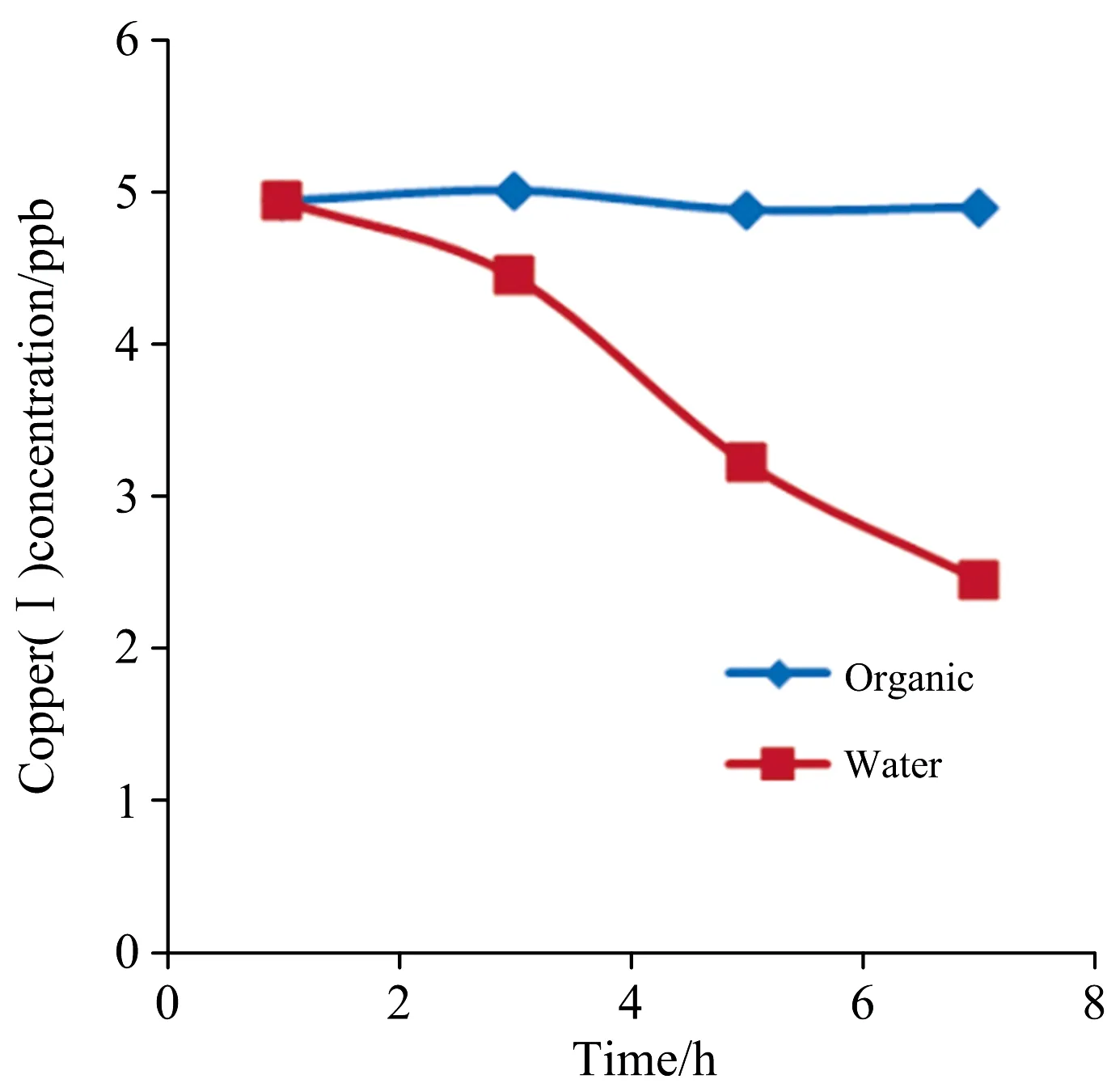
图3 室温放置一天Cu(Ⅰ)在水相及有机相中的浓度变化
2.2.2 生物样本处理过程中Cu(Ⅰ)离子的稳定性
如图4所示, 将血清样品分成两组, 一组-80 ℃低温冰箱保存, 一组室温下放置。 每隔一天测血清中的Cu(Ⅰ)浓度, 一周后发现-80 ℃低温冰箱的血清Cu(Ⅰ)浓度基本上没变化, 室温下的血清Cu(Ⅰ)浓度度降低了近20%。 这可能与保护Cu(Ⅰ)不被氧化的蛋白质降解有关, 由于血清总铜不变, 即部分Cu(Ⅰ)被氧化成了Cu(Ⅱ)。 因此, 测定生物样品的Cu(Ⅰ)时, 新鲜的血清应尽量及时处理, 而对于浓度极低的细胞液或细胞膜液, 则应在当天处理。
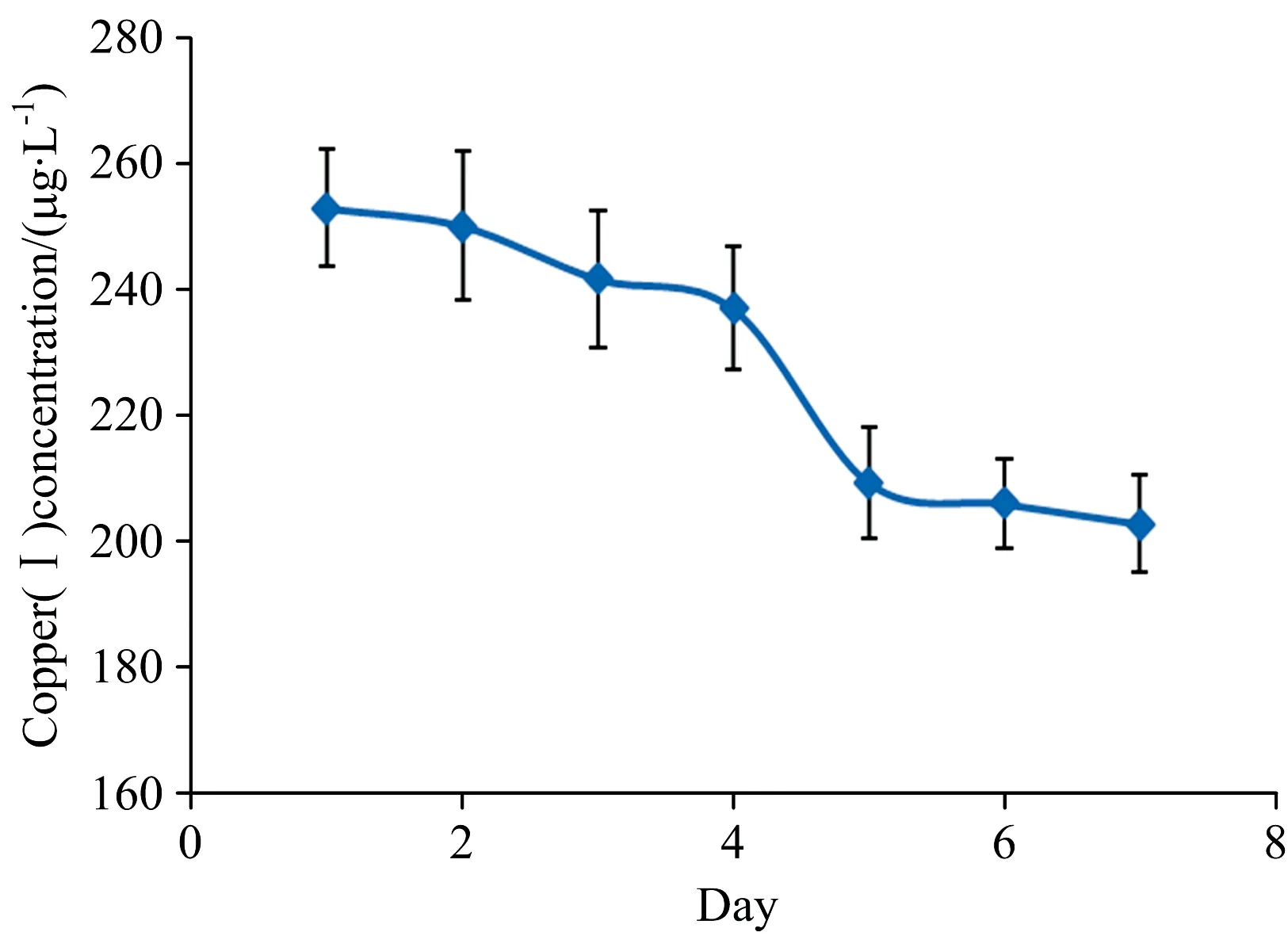
图4 血清室温放置一周的Cu(Ⅰ)浓度变化
2.3 最佳条件下考察Cu(Ⅱ)对Cu(Ⅰ)的干扰情况
图5为pH为9的甘氨酸-氢氧化钠缓冲溶液条件下, 10, 100和1 000 μg·L-1的Cu(Ⅱ)离子从水相转移到有机相中, 在有机相中测到的铜浓度值。 结果表明, 10倍Cu(Ⅱ)离子浓度的存在, 对Cu(Ⅰ)离子的测定不再产生干扰。

图5 水相中不同浓度的二价铜进入有机相的浓度
2.4 方法的分析性能
按1.2.1方法制作测定铜标准系列, 校准曲线方程为
A=0.048c+0.000 5,R=0.999 5
按3倍空白标准偏差计算方法的检出限(n=12), Cu(Ⅰ)的检出限为0.10 μg·L-1。 将一定质量CuCl的标准加入样品, 按1.2.5方法处理后测定Cu(Ⅰ), 所得回收率和标准偏差见表1。
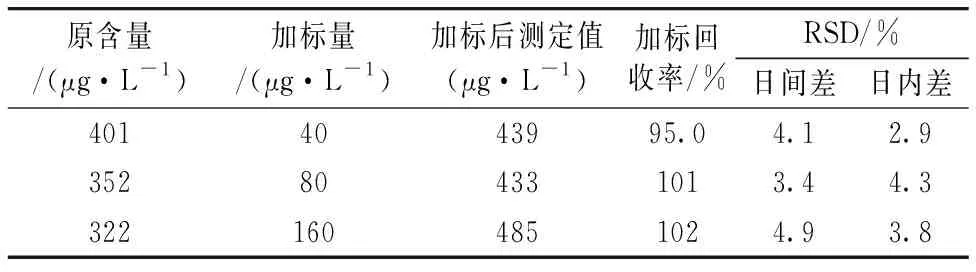
表1 方法回收率和标准偏差
2.5 实际样品分析(n=5)
表2说明, 宫颈癌患者与健康者相比, 血清总铜变化不大, Cu(Ⅰ)浓度明显偏高。
表3说明, 农夫山泉水、 自来水及尿液检测不到Cu(Ⅰ), 而细胞液和细胞膜中几乎没有Cu(Ⅱ)离子存在。

表2 健康者与宫颈癌患者血清中Cu(Ⅰ)测定结果比较

表3 几种样品的亚铜和总铜含量
3 结 论
在pH为8~10的条件下, 甘氨酸与Cu(Ⅱ)形成溶于水不溶于有机溶剂的稳定配合物甘氨酸铜, 2,2′-联喹啉亚铜溶于有机溶剂而不溶于水, 利用此原理能将样品中同时存在的Cu(Ⅰ)和Cu(Ⅱ)分离在不同液相, 进而用GFAAS法可以测定血清中Cu(Ⅰ)含量。 本法可用于生物样品中Cu(Ⅰ)离子的测定, 10倍的Cu(Ⅱ)离子对其测定无干扰。 目前定量测定生物体系中的铜仍然局限在总铜方面。 本文报道μg·L-1级Cu(Ⅰ)含量的检测, 通过检测, 可加深认识和了解生物体系中铜形态的转换及代谢失衡的变化规律, 对研究老年痴呆、 肿瘤、 炎症等疾病状态下Cu(Ⅰ)是否具有独自的病理生理意义有一定的意义。
