茶树对硒吸收累积特性及其硒调控相关基因的表达分析
2020-02-25曹丹马林龙刘艳丽龚自明金孝芳
曹丹,马林龙,刘艳丽,龚自明,金孝芳
茶树对硒吸收累积特性及其硒调控相关基因的表达分析
曹丹,马林龙,刘艳丽,龚自明,金孝芳*
湖北省农业科学院果树茶叶研究所,湖北 武汉 430064
本文采用沙培试验,从动态角度研究了不同时间和不同浓度下茶树对硒的吸收累积规律,并分析相关基因的表达特点。结果发现,茶树不同部位对硒的累积量存在较大差异,大部分硒保留在根部,在其体内的迁移率较低,硒的累积量和外源硒浓度、培养时间显著相关;当外源硒浓度在0~0.05 mmol·L-1时,茶树长势良好,但当浓度高于0.10 mmol·L-1时,茶树表现出中毒症状。荧光定量PCR分析发现,转录因子及茉莉酸信号途径中的关键基因丙二烯环化氧化酶基因()和脂氧合酶基因()受到高浓度硒的诱导表达,相关性分析表明,这3个基因的表达量与根系硒含量呈显著正相关。本研究表明,茶树各部位对硒的累积与外源硒浓度和培养时间显著相关,基因、和可能在该过程中发挥着重要作用。
茶树;硒;吸收累积;基因表达
硒是人体必需的微量元素,过量或不足均会导致机体产生疾病[1],近几年由于其“双刃剑”作用越来越受到关注。适量的硒可以清除人体内的自由基,具有抗衰老和防癌抗癌等功效[2];在植物体内有助于增强植物的抗逆性,提高品质[3-5]。植物是人体摄取硒的主要来源,因此研究植物对硒吸收累积机理意义重大。
茶是世界上广泛流行的饮品,茶树富集硒的能力较强,但其吸收、转运和分配的机制并不明确。基于此,研究者相继开展了许多相关试验,叶飞等[6]认为茶树对土壤中硒的吸收与土壤pH值有关,pH在4.5~5.5区间内有利于茶树对硒的吸收。刘海燕等[7]通过检测4个田间试验地12个样点茶园土壤及其种植的茶叶样品中的硒含量发现,茶叶中的硒含量受茶园土壤硒含量、土壤质地以及茶园温湿度等多种环境因素共同影响。周超等[8]研究发现,干旱胁迫也会影响茶树对硒的吸收,当土壤含水率为90%时,茶树根系硒的累积量最高。然而,因茶树存在品种和生长环境等因素的差异性,利用田间取样分析的结果可能会有偏差,难以系统全面地揭示出茶树对硒吸收累积的规律特征。本研究采用沙培试验模型,探讨茶苗对硒的吸收、转运及累积的特性。实验室前期对水培茶树进行硒处理,取其根系和叶片进行了转录组测序,对其差异基因进行分析发现,转录因子及茉莉酸信号途径中的关键基因丙二烯环化氧化酶基因()和脂氧合酶基因()在硒处理后显著上调表达,推测这些基因与茶树硒累积相关[9]。本试验将继续对其在不同处理条件下表达情况进行研究,探索其与茶树硒累积的关系,有助于解析茶树中硒元素的累积机理。
1 材料与方法
1.1 茶树培养
以金茗1号为试验材料,该品种是由本课题组采用系统选育的方法从群体种中育成的无性系优良品种[10]。采用沙培培养的方式,基质为洁净河沙(沙粒直径<1 mm),于烘箱中120℃烘干3 h,冷却后装入规格为24.2 cm× 17.4 cm×6.7 cm的蓝色周转箱,每箱2 800 g。硒源为Na2SeO3,培养液采用1/3 Hoagland营养液[9,11],用NaOH和HCl调节pH至5.0左右,试验期间每3 d浇1次营养液,每箱500 mL至浇透。
1.1.1 沙培时间对茶树吸收累积硒的影响试验
幼苗取回后,用自来水清洗其根部的培养基质,然后在蒸馏水中润洗3次。选取长势一致的茶苗定植于周转箱中,每箱6株。设置硒浓度为0.05 mmol·L-1,分别在培养0、1、2、4、8、12、24、48、96、192 h取样,每次取出3箱,根部用蒸馏水清洗干净后,将茶苗的幼根、嫩茎(一芽二叶以下约5 cm长的茎段)、一芽二叶分装用于硒含量测定,另取一部分根部液氮速冻并置于–80℃保存,用于硒调控相关基因的表达分析。
1.1.2 硒浓度对茶树硒吸收累积的影响试验
选取长势一致,按照1.1.1章节所述方法清洗定植茶苗,设置0、0.01、0.03、0.05、0.10、0.30、0.50、1.00 mmol·L-1共8个硒浓度处理,每个处理3次重复。处理期间观察并记录茶苗形态变化,3 d后按1.1.1章节所述方法取样保存。
1.2 总硒含量测定及迁移系数
采用HNO3-HClO4(∶=4∶1)消解,消解过程中温度控制在180℃,将消解液置于6 mol·L-1的HCl中还原,冷却后定容过滤,利用氢化物发生原子荧光光谱法(HG-AFS-8220)测定总硒含量[12]。
茎/根迁移系数=茎中硒含量/根中硒含量,叶/茎迁移系数=叶中硒含量/茎中硒含量[13]。
1.3 RNA提取及荧光定量分析
茶树根系总RNA测定,采用EASYspin plus多糖/多酚复杂植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取,通过M-MLV逆转录试剂盒(上海英骏生物技术有限公司)逆转录为cDNA;采用KAPA SYBR®FAST qPCR Kit试剂盒()在ABI7500型荧光定量PCR仪()进行定量PCR反应。反应体系为20 μL:2×KAPA SYBR®FAST qPCR Master Mix ABI Prism 10 μL,上、下游引物各0.4 μL,cDNA模板1 μL,PCR-grade water 8.2 μL。反应步骤:95℃预变性3 min;95℃变性3 s,60℃退火30 s,72℃延伸30 s,40个循环。分别对各个样品进行溶解曲线分析,确定每对引物均为特异性扩增,每个基因重复3次。
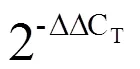

表1 qRT-PCR引物序列
1.4 数据分析
采用Excel 2003和SPSS 19.0 Duncan新复极差法对硒含量进行统计分析,并用Person相关性分析方法,分析7个时间点和6个浓度处理相关基因的表达与根部硒含量变化的相关性,检验值<0.01,使用TBtools软件绘制基因表达热图。
2 结果与分析
2.1 沙培时间对茶树吸收累积硒的影响
茶树在硒浓度为0.05 mmol·L-1的沙培营养液中培养0~192 h,茶树幼根、嫩茎、一芽二叶中的硒含量及不同部位的迁移系数结果如图1-A所示。在沙培时间0~4 h和8~48 h,根部硒含量接近直线增长趋势(硒含量=0.221 3+0.068 5,2=0.990 6;硒含量=0.067 6+0.848 9,2=0.927 4);而在48~192 h之间,硒含量不再继续增加,维持在较高水平。
硒被茶树根部吸收后,将继续向茎部和叶片迁移。如图1-A所示,茎部硒含量在0~24 h之间缓慢增长,在24~96 h也接近直线增长的趋势(硒含量=0.018 7-0.145,2=0.965 7),之后在96~192 h保持稳定。叶部硒含量在0~24 h内未有增加,在24~96 h亦以直线增长趋势(硒含量=0.001 7+0.075 3,2=0.989 7),在96~192 h呈现出根、茎相似的稳定趋势,表明茶树在该时间段可能处于硒吸收、转运与分配的动态平衡中。另一方面,从图1-B可知,外源硒促进硒从根部向茎段以及从茎段向叶部的迁移,且随着处理时间的延长,其迁移特征表现出降低的趋势。
2.2 硒浓度对茶树吸收累积硒的影响
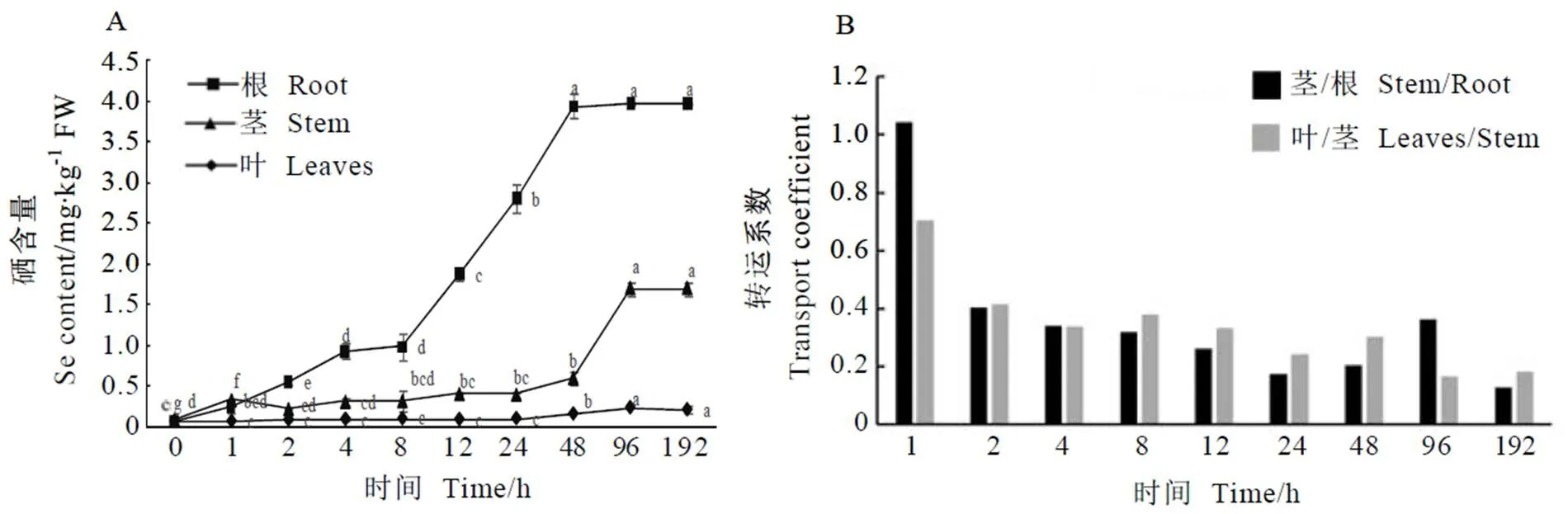
不同浓度硒处理茶树,根、茎和叶部硒含量及其迁移系数的变化如图2所示。沙培茶树3 d,硒浓度为0~0.03 mmol·L-1时,茶树根部硒含量呈直线增长趋势(硒含量=121.61+0.302 1,2=0.986 0),而茎段和叶部硒含量无显著变化。当硒浓度为0.03~0.05 mmol·L-1时,根中的硒含量有所下降,同时根部到茎段的转运系数较之前有所提高,说明这不仅与根部硒浓度有关,还与硒从根部到地上部的转运相关。当硒浓度在0.05~0.10 mmol·L-1时,根、茎、叶硒含量均无显著变化,说明此时可能处于吸收、转运与分配的动态平衡或饱和状态。当硒浓度为0.1~1.0 mmol·L-1时,根茎叶各部位硒含量又接近直线增长趋势(硒含量=3.387+1.212 2,2=0.921 4;硒含量=3.786 2-0.158 2,2=0.993 5;硒含量=2.805 1-0.248 4,2=0.891 3),同时根系到茎段、茎段到叶部的迁移系数也呈上升趋势,说明此时茶树根部吸收、转运效率均较高。形态观察发现,茶树在此浓度范围内出现危害症状,表现为根系由白色逐渐变红,叶片发生褐变,先出现在主脉,再向侧脉延伸,并伴有干枯甚至脱落现象。
2.3 硒累积相关基因表达及其与硒含量相关性分析
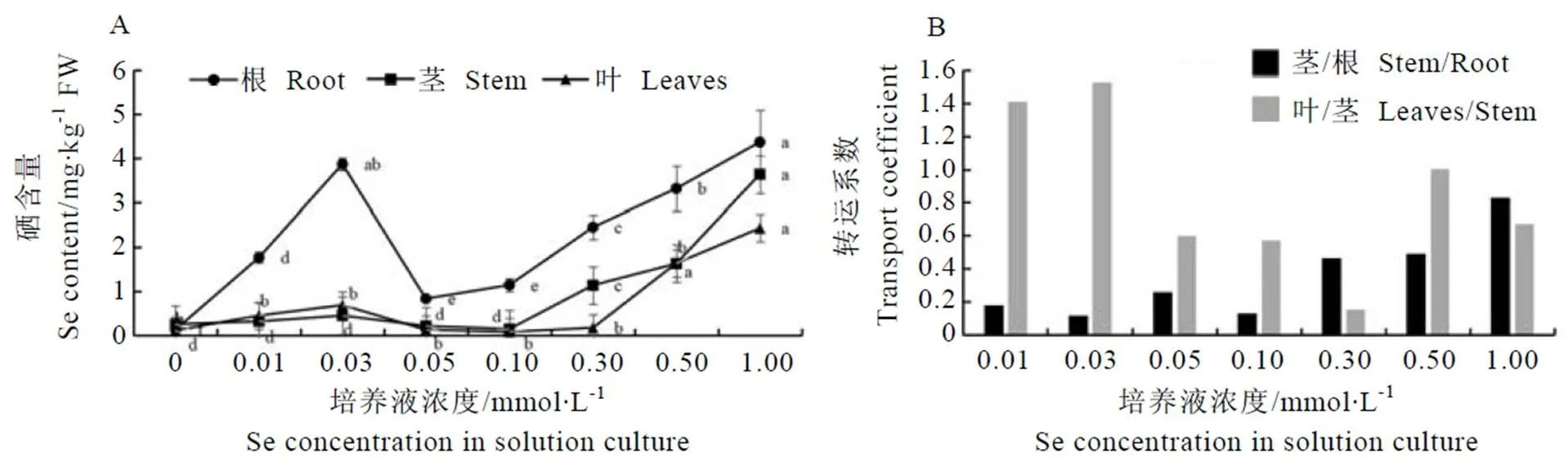
荧光定量分析发现、、在不同硒浓度处理及同一浓度的不同处理时间下受到响应。如图3所示,当茶树处于低硒浓度(0~0.05 mmol·L-1)时,茶树根系中的这3个基因呈现正常或略下调表达趋势,而根部的硒含量呈显著上升的趋势(图2-A),表明这3个基因在此阶段不参与调控硒累积;随着硒浓度的提高(0.10~1.00 mmol·L-1),茶树可能受到胁迫,从而激活体内的某些调节机制,诱导转录因子以及茉莉酸信号途径中的关键基因、的上调表达,增强茶树的抗逆性,从而使得根系中硒含量继续增加。基因、、与茶树根部硒含量的相关性分析见表2,基因、、的表达量与硒含量变化呈显著正相关,相关系数分别为0.802、0.723和0.781。
注:A:不同处理时间对茶树根、茎、叶硒含量的影响,B:不同处理时间对硒根-茎与茎-叶迁移系数的影响
注:A:不同硒浓度处理对茶树根、茎、叶硒含量的影响,B:不同硒浓度处理对硒根-茎与茎-叶迁移系数的影响

注:A:CsbHLH62、CsAOC、CsLOX6在硒浓度0.05 mmol·L-1不同处理时间的表达量分析,B:CsbHLH62、CsAOC、CsLOX6在不同浓度处理3 d的表达量分析
表2 硒含量与基因表达间相关系数
**表示<0.01显著水平
**represents extremely significant difference at 0.01 level
3 讨论
硒是一种具有保健价值的营养元素,植物中硒是人体摄取硒元素的主要途径,因此植物对硒的吸收转运、代谢与累积一直都是研究热点。目前还没有充分证据证明硒是植物生长必需的元素,但以往研究发现硒形态、施用方法及施用量等对茶树产量和品质有着显著的影响[14-15]。植物吸收硒的主要形式是硒酸盐和亚硒酸盐[16],亚硒酸盐易被金属离子氧化物吸附形成难溶性的复合物,从而降低了硒的移动性,而硒酸盐则较容易运转且氧化性较强,但易对植物的生长造成毒害[17]。此外,硒酸盐主要存在于碱性环境中,而亚硒酸盐主要存在于酸性环境中[18],茶园土壤大多呈酸性,因而本试验采用亚硒酸盐作为硒源。硒在植物体内主要通过提高抗氧化能力来保护细胞,还对植物的光合作用和呼吸作用等过程有着积极的影响[19]。但是只有适量的硒含量才对植物有正面效应,若添加过量则对植物有毒害作用[20-21]。本试验也得出类似结论,当硒浓度在0.10 mmol·L-1及以上时,茶树出现中毒迹象。我国绝大多数地区的茶园土壤都缺硒,添加外源硒是生产富硒茶的有效途径之一。然而,由于茶树对不同浓度硒的累积特性存在差异,故筛选合适的硒浓度至关重要。添加外源硒后,茶树各部位的硒含量均能显著增加,大体呈现根>茎>叶的趋势;周鑫斌等[22]研究发现,添加亚硒酸盐后,水稻各器官的硒含量表现为根>叶>茎,说明不同植物对硒的分配规律有所差异。茶树吸收的硒大部分都累积在根部,可能是因为亚硒酸钠被吸收后,先在根部转化为其他硒化物再向地上部运输,而根系的吸收速率快于其转化为可向地上部运输的形态,这与水稻、油菜及草莓等的研究结果一致[23-25]。
植物中硒吸收累积等过程涉及诸多影响因素,包括外界环境、关键基因的表达及转录因子的调控等。bHLH是一类广泛存在于植物中的转录因子,在植物生长发育、信号转导和次生代谢调控中发挥着重要的作用[26],本研究中的转录因子因含有螺旋-环-螺旋结构域而属于此类基因[27]。近几年的研究发现,该类转录因子还参与植物对元素的吸收累积,如过表达能增加拟南芥对Zn和Ni的耐受性[28],同时拟南芥bHLH家族中的、和参与植株对Cd的响应[29]。植物激素茉莉酸(Jasmonic acid,JA)也是植物生长发育和次生代谢产物合成的有效诱导因子,大量研究证明,JA可通过提高抗逆性酶的活性,来促进黄酮、生物碱等物质的合成及相关途径基因表达[26]。廖永翠[30]利用荧光定量PCR分析发现,JA信号途径中的关键基因能显著响应外界刺激,诱导白木香中倍半萜的合成,过表达基因能正向调控拟南芥倍半萜合酶基因和的表达,最终证实了JA信号途径参与沉香倍半萜的生物合成。在橡胶树中,JA分子也可能通过调节bHLH等转录因子的表达,激活与橡胶生物合成相关的基因,从而提高乳胶的产量[31]。在拟南芥和硒超累积植物的研究中发现,硒处理可以诱导其体内的JA和茉莉酸甲酯(Methyl jasmonate,MeJA)等植物激素合成酶基因的上调表达,从而诱导体内的硒含量增加[32-33]。在本研究中,茶树经硒处理后,各部位的硒含量显著增加,高浓度硒能诱导转录因子与JA信号通路中关键基因和上调表达,这可能是因为高硒浓度处理激活了JA信号通路,进一步调控其代谢与累积。另外,bHLH类转录因子可与MYB转录因子互作参与类黄酮生物合成、花青素累积等次级代谢[34],而在茶树硒富集过程中是否也有类似的调控机制,有待于进一步的验证。
[1] 王子健. 中国低硒带生态环境中硒的环境行为研究进展[J]. 环境化学, 1993(3): 237-243. Wang Z J. Some biogeochemical aspects of selenium in Chinese low-selenium belt [J]. Environmental Chemistry, 1993(3): 237-243.
[2] Brooks J D, Metter E J, Chan D W, et al. Plasma selenium level before diagnosis and the risk of prostate cancer development [J]. Journal of Urology, 2001, 166(6): 2034-2038.
[3] Hawrylaknowak B. Beneficial effects of exogenous selenium in cucumber seedlings subjected to salt stress [J]. Biological Trace Element Research, 2009, 132(1/3): 259-269.
[4] Cartes P, Jara A A, Pinilla L, et al. Selenium improves the antioxidant ability against aluminium-induced oxidative stress in ryegrass roots [J]. Annals of Applied Biology, 2010, 156(2): 297-307.
[5] Mimmo T, Tiziani R, Valentinuzzi F, et al. Selenium biofortification in: implications on strawberry fruits quality, content of bioactive health beneficial compounds and metabolomic profile [J]. Frontiers in Plant Science, 2017, 8: 1887. doi: 10.3389/fpls.2017.01887.
[6] 叶飞, 龚自明, 高士伟, 等. 湖北恩施茶园土壤及茶叶硒元素调查研究[J]. 四川农业大学学报, 2015, 33(3): 275-278. Ye F, Gong Z M, Gao S W, et al. Investigation of the selenium element in tea plantation of Enshi District, Hubei Province [J]. Journal of Sichuan Agricultural University, 2015, 33(3): 275-278.
[7] 刘海燕, 黄彩梅, 周盛勇, 等. 茶园土壤及与茶叶中微量元素锌硒含量相关性的研究[J]. 广西植物, 2015, 35(6): 868-874, 941. Liu H Y, Huang C M, Zhou S Y, et al. Correlation of zinc and selenium contents in tea and the planting soil [J]. Guihaia, 2015, 35(6): 868-874, 941.
[8] 周超, 胡玉荣, 曾建明, 等. 土壤因子对茶树硒吸收特性的影响[J]. 茶叶科学, 2015, 35(5): 429-436. Zhou C, Hu Y R, Zeng J M, et al. Effects of soil factors on the selenium absorption characteristics of tea plant [J]. Journal of Tea Science, 2015, 35(5): 429-436.
[9] Cao D, Liu Y, Ma L, et al. Transcriptome analysis of differentially expressed genes involved in selenium accumulation in tea plant () [J]. PLoS ONE, 2018, 13(6): e0197506. doi: 10.1371/journal.pone.0197506.
[10] 金孝芳, 贾尚智, 闵彩云, 等. 茶树良种‘金茗1号’[J]. 林业科学, 2015, 51(12): 156-156. Jin X F, Jia S Z, Min C Y, et al. An Elite Variety of'Jinming 1' [J]. Scientia Silvae Sinicae, 2015, 51(12): 156-156.
[11] Liu Y, Cao D, Ma L, et al. TMT-based quantitative proteomics analysis reveals the response of, to fluoride [J]. Journal of Proteomics, 2018, 176: 71-81.
[12] 中华全国供销合作总社. 茶叶中硒含量的检测方法: GB/T 21729—2008[S]. 北京: 中国标准出版社, 2008. All China Federation of Supply and Marketing Cooperatives. Determination of selenium content in tea: GB/T 21729—2008 [S]. Beijing: Standards Press of China, 2008.
[13] 明佳佳, 胡承孝, 赵小虎, 等. 硒对油菜各部位矿质元素含量及其迁移特征的影响[J]. 浙江农业学报, 2016, 28(9): 1564-1571. Ming J J, Hu C X, Zhao X H, et al. Content and migration characteristic of mineral element in rape with application of selenium [J]. Acta Agriculturae Zhejiangensis, 2016, 28(9): 1564-1571.
[14] 王磊, 黄婷婷, 杨春, 等. 叶面喷硒对台茶12号所制红绿茶含硒量及品质的影响[J]. 西南农业学报, 2016, 29(11): 2578-2582. Wang L, Huang T T, Yang C, et al. Effect of selenium content and quality of black tea and green tea made of taiwan tea 12 by foliar spray of selenium [J]. Southwest China Journal of Agricultural Sciences, 2016, 29(11): 2578-2582.
[15] 杨海滨, 李中林, 徐泽, 等. 施肥对富硒茶园茶叶硒含量、养分和品质的影响[J]. 中国农业科技导报, 2018, 20(5): 130-137. Yang H B, Li Z L, Xu Z, et al. Effects of fertilization on selenium content, nutrient and quality of tea in se-enriched tea garden [J]. Journal of Agricultural Science and Technology, 2018, 20(5): 130-137.
[16] Bañuelos G S, Lin Z Q. Phytoremediation management of selenium-laden drainage sediments in the San Luis Drain: a greenhouse feasibility study [J]. Ecotoxicology & Environmental Safety, 2005, 62(3): 309-316.
[17] Eustice D C, Foster I, Kull F J, et al.incorporation of selenomethionine into protein bypolysomes [J]. Plant Physiology, 1980, 66(1): 182-186.
[18] Elrashidi M A, Adriano D C, Workman S M, et al. Chemical equilibria of selenium insoils: a theoretical development [J]. Soil Science, 1987, 144(2): 274-280.
[19] 张均华, 朱练峰, 禹盛苗, 等. 稻田硒循环转化与水稻硒营养研究进展[J]. 应用生态学报, 2012, 23(10): 2900-2906. Zhang J H, Zhu L F, Yu S M, et al. Selenium cycling and transformation in paddy field and selenium nutrition of rice: A review [J]. Chinese Journal of Applied Ecology, 2012, 23(10): 2900-2906.
[20] 段曼莉, 付冬冬, 王松山, 等. 亚硒酸盐对四种蔬菜生长、吸收及转运硒的影响[J]. 环境科学学报, 2011, 31(3): 658-665. Duan M L, Fu D D, Wang S S, et al. Effects of different selenite concentrations on plant growth, absorption and transportation of selenium in four different vegetables [J]. Acta Scientiae Circumstantiae, 2011, 31(3): 658-665.
[21] 徐云, 王子健, 王文华, 等. Se和环境中富里酸对小麦种子发芽的影响及其生理特性[J]. 应用生态学报, 1997(4): 439-444. Xu Y, Wang Z J, Wang W H, et al. Effect of selenium and fulvic acid on seed germination of wheat and its physiological properties [J]. Chinese Journal of Applied Ecology, 1997(4): 439-444.
[22] 周鑫斌, 施卫明, 杨林章. 富硒与非富硒水稻品种对硒的吸收分配的差异及机理[J]. 土壤, 2007, 39(5): 731-736.Zhou X B, Shi W M, Yang L Z. Genotypical differences and characteristics of se uptake and accumulation in rice [J]. Soils, 2007, 39(5): 731-736.
[23] Wang X F, Zhang L, Wan Y N, et al. Effects of foliar-applied selenite and selenate on selenium accumulation in strawberry [J]. Journal of Agricultural Resources and Environment, 2016, 33(4): 334-339.
[24] Chen S Y, Jiang R F, Li H F. Uptake and translocation of selenate or selenite by wheat and rice seedlings [J]. Environmental Science, 2011, 32(1): 284-289.
[25] Liu X W, Zhao Z Q, Hu C X, et al. Effect of sulphate on selenium uptake and translocation in rape (L.) supplied with selenate or selenite [J]. Plant and Soil, 2016, 399(1/2): 295-304.
[26] Anjum S A, Wang L, Farooq M, et al. Methyl jasmonate-induced alteration in lipid peroxidation, antioxidative defence system and yield in soybean under drought [J]. Journal of Agronomy & Crop Science, 2011, 197(4): 296-301.
[27] 曹丹, 金孝芳, 马林龙, 等. 基于RNA-seq技术的茶树生物信息学分析[J]. 西南农业学报, 2019, 32(1): 36-41. Cao D, Jin X F, Ma L L, et al. Bioinformatics analysis ofin tea plant based on rna sequencing [J]. Southwest China Journal of Agricultural Sciences, 2019, 32(1): 36-41.
[28] Wu H L, Chen C L, Du J, et al. Co-Overexpressionwithorin Arabidopsis-Enhanced cadmium tolerance via increased cadmium sequestration in roots and improved iron homeostasis of shoots [J]. Plant Physiology, 2012, 158(2): 790-800.
[29] Mortel J E V D, Schat H, Moerland P D, et al. Expression differences for genes involved in lignin, glutathione and sulphate metabolism in response to cadmium inand the related Zn/Cd-hyperaccumulator[J]. Plant Cell & Environment, 2010, 31(3): 301-324.
[30] 廖永翠. 茉莉酸信号途径参与调控沉香倍半萜生物合成的分子机制研究[D]. 北京: 北京协和医学院, 2015. Liao Y C. Moleular mechanism of JA signaling pathway involved in the regulation of agarwood sesquiterpene biosynthesis [D]. Beijing: Peking Union Medical College, 2015.
[31] Zhao Y, Zhou L M , Chen Y Y , et al.genes with differential responses to tapping, mechanical wounding, ethrel and methyl jasmonate in laticifers of rubber tree (Muell. Arg.) [J]. Journal of Plant Physiology, 2011, 168(14): 1649-1658.
[32] Tamaoki M, Freeman J L, Pilon-Smits E A H. Cooperative ethylene and jasmonic acid signaling regulates selenite resistance in[J]. Plant Physiology, 2008, 146(3): 1219-1230.
[33] Wang J, Cappa J J, Harris J P, et al. Transcriptome-wide comparison of selenium hyperaccumulator and non-accumulator,, species provides new insight into key processes mediating the hyperaccumulation syndrome [J]. Plant Biotechnology Journal, 2018, 16(9): 1582-1594.
[34] 李欣, 李影, 曲子越, 等. bHLH转录因子在茉莉酸信号诱导植物次生产物合成中的作用及分子机制[J]. 植物生理学报, 2017, 53(1): 1-8. Li X, Li Y, Qu Z Y, et al. The molecular mechanism and the function of bHLH regulating jasmonic acidmediated secondary metabolites synthesis [J]. Plant Physiology Journal, 2017, 53(1): 1-8.
Absorption and Accumulation Characteristics of Selenium in Tea Plant () and Expression Analysis of Genes Related to Selenium Regulation
CAO Dan, MA Linlong, LIU Yanli, GONG Ziming, JIN Xiaofang*
Fruit and Tea Research Institute, Hubei Academy of Agricultural Sciences, Wuhan 430064, China
The concentration dependence and time course of selenium (Se) absorption and accumulation in tea plant were investigated under sand culture and the expressions of related genes were also analyzed. The results show that the absorption amounts of Se in different tissues of tea plant were remarkably different. Most of them were fixed by the roots, and low movement from roots to shoots was observed. Moreover, the accumulation of Se was significantly correlated with exogenous Se concentration and culture duration. Furthermore, tea plant grew well in the Se concentration from 0 to 0.05 mmol·L-1, but when the concentration was higher than 0.10 mmol·L-1, tea plant showed poisoning symptoms. Fluorescence quantitative PCR analysis indicates that allene oxide cyclase (), lipoxygenase () (key genes of jasmonic acid signaling pathway), as well as a basic helix-loop-helix transcription factor () could be obviously induced by high concentration of Se. The correlation analysis showes that the expressions of these genes were positively related with the Se content in roots. These results suggest that Se accumulation in different tissues of tea plant was significantly correlated with exogenous Se concentration and culture duration, and,,might play important roles in this process.
tea plant, Se, absorption and accumulation, gene expression
S571.1;Q52
A
1000-369X(2020)01-077-08
2019-04-16
2019-08-05
湖北省农业科技创新中心项目(2019-620-000-001-24)、湖北省农业科学院青年基金项目(2018NKYJJ12)
曹丹,女,助理研究员,主要从事茶树资源与育种研究,skyiswide@163.com。
xfjin@126.com
