制浆造纸厂富铁污泥中Fe3+的电化学还原研究
2020-02-24张婧伟白周央谭苏吉杨树成
张婧伟,白周央,葛 强,谭苏吉,徐 浩,杨树成
(1.西安交通大学能源与动力工程学院,陕西西安710049;2.中国轻工业长沙工程有限公司,湖南长沙410114)
Fenton氧化法因具有反应速率快、氧化彻底等优点被广泛用于制浆造纸行业的废水深度处理,其原理是在强酸性条件下,利用Fe2+催化H2O2产生的强氧化性的·OH氧化分解废水中的难降解有机物〔1-2〕。 但 Fenton 反应后会产生大量富铁污泥〔3〕,其中除含大量的铁元素外,还含有一些重金属、卤化物及有机质等,若处理不当会引起二次污染。同时,富铁污泥中的含铁量可高达40%〔4-5〕,直接废弃也会造成资源浪费。因此,将富铁污泥进行合理的资源化利用具有重要的环境效益和工程价值。
将富铁污泥与生物污泥混合脱水是目前制浆造纸厂处理富铁污泥的主要方式。但由于富铁污泥粒径小,采用板框压滤机脱水时易造成滤布堵塞,致使污泥脱水困难〔5〕,且脱水污泥仍需进一步处理,难以达到富铁污泥最大资源化利用的目的。富铁污泥中的铁主要以三价的水合氧化铁形式存在〔5〕,将其直接或酸处理后用作混凝剂可以降低废水的COD〔6〕,将其用作污泥调理剂可以大幅度提高污泥的脱水性能〔5〕。 Guomin Cao 等〔7〕将富铁污泥脱水、干燥、焙烧、酸溶后不经还原直接用作类Fenton催化剂,降低了Fe2+的投加量。考虑到Fe2+比未经还原的Fe3+具有更高的催化活性,Zhimin Qiang等〔3〕以硫酸铁为研究对象,对电化学还原Fe3+进行了系统研究。在此基础上,本研究对电化学还原Fe3+的阴极材料进行了优化,并研究了实际富铁污泥中Fe3+的电化学还原可行性,以期为富铁污泥资源化利用提供参考。
1 材料与方法
1.1 实验材料
富铁污泥样品采自山东某制浆造纸厂废水处理站Fenton氧化单元,该废水处理站主要接纳化学制浆造纸工艺产生的废水,污泥样品采集后储存于4℃的冰箱中。
本实验所用化学试剂硫酸铁、硫酸钠、氟化铵等均为分析纯,实验用水为经反渗透处理的纯水。
1.2 实验方法
1.2.1 硫酸铁还原
配制 Fe3+质量浓度为 2 000 mg/L 的 Fe2(SO4)3溶液,以石墨棒为阴极和阳极材料,使用直流稳压电源(2220-30-1,美国KEITHLEY仪器公司),采用恒电流模式进行电解。反应过程中及反应后溶液Fe2+浓度采用邻菲罗啉分光光度法(TU-1810紫外分光光度计,北京普析通用仪器有限责任公司)测定。由于溶液中大量的Fe3+会干扰Fe2+的测定,测定中加入掩蔽剂氟化铵〔3〕。采用线性扫描伏安法(电化学工作站,CHI6600D,上海辰华仪器有限公司)测试电极材料性能。
1.2.2 富铁污泥混合液还原
首先将富铁污泥采用硫酸进行处理,然后将反应后的混合液在4 000 r/min下离心5 min。取上清液,经0.45 μm膜过滤后进行电化学还原。
2 结果与讨论
2.1 硫酸铁的电化学还原实验
2.1.1 阴极材料的影响
对Fe2(SO4)3进行电化学还原时阴阳极会发生以下反应:

阴极析氢副反应的存在会导致体系中H+与Fe3+争夺电子用于产生H2,从而使得电流效率降低。随着还原过程的进行,Fe3+浓度逐渐降低,而H+浓度逐渐升高,H+竞争电子的优势逐渐提高。因此,尽量抑制析氢反应,才能提高Fe3+的还原率和还原的电流效率。实际中由于极化作用,当阴极电位比理论值低时才会发生电极反应,即在阴极电位低至一定值时才会引起析氢反应的发生,此时电位与理论计算的可逆电位的差值称为析氢过电位。不同阴极材料析氢反应过电位不同,因此选用析氢过电位比较高的阴极材料有助于抑制析氢反应,提高电流效率〔8〕。
以 Fe2(SO4)3溶液(Fe3+质量浓度为 2 000 mg/L)为电解液,考察Fe3+和H+共存时的还原情况;同时以相同pH的H2SO4溶液作为电解液,考察仅H+存在时的还原情况。实验以石墨棒为阳极。阴极材料为石墨棒和不锈钢的线性伏安曲线如图1所示。

图1 不同阴极材料的线性伏安曲线
由图1(a)可以看出,当以石墨棒作为阴极材料时,以 Fe2(SO4)3和 H2SO4溶液为电解质发生还原反应的起始电压均为-1.0 V左右,说明此实验条件下石墨棒阴极上Fe3+和H+的还原电位基本相等,当Fe3+开始还原时就会发生析氢副反应。由图1(b)可以看出,当以不锈钢棒作为阴极材料时,以Fe2(SO4)3和H2SO4溶液为电解质发生还原反应的起始电压分别为-0.7 V和-1.1 V左右,说明在外加电压为-0.7 V时Fe3+开始还原,而在电压为-1.1 V时H+才会开始还原。因此,与石墨棒相比,以不锈钢作为阴极材料,可以较大幅度降低Fe3+还原的过电位,也可以小幅提高析氢过电位,从而可减少阴极的析氢副反应,提高电流效率,节约能源。
2.1.2 辅助电解质的影响
在通电时,电解液依靠其中自由移动的阴阳离子导电,加入电解质可以增加阴阳离子浓度,有利于提高溶液的导电性,降低电阻、电压值和系统能耗。以 Fe2(SO4)3溶液(Fe3+质量浓度为 2 000 mg/L)为电解液,在电流密度为0.65 mA/cm2,极水比(电极有效面积与电解液体积的比值)为0.17 cm2/mL的条件下对比不额外添加电解质和加入0.05 mol/L Na2SO4的2个体系的Fe3+还原情况,结果如图2所示。

图2 辅助电解质Na2SO4对Fe3+还原的影响
由图2可以看出,添加辅助电解质Na2SO4的Fe2+再生率曲线与不添加Na2SO4的Fe2+再生率曲线基本重合,说明添加Na2SO4并未提高Fe2+的再生速率和最终再生率。考虑到在溶液电导率较低时进行还原反应,必须施加较高的还原电压,因此记录了实验过程中还原电压的变化。结果表明,添加辅助电解质体系与不添加辅助电解质体系的还原电压相差并不大。原因可能是原体系中的离子浓度已经足够大,电导率足够高,因此再加入额外的电解质并不能有效提高整体的电导率。而且还原电压不仅与溶液电导率有关,还与界面电势(导线与电极接触界面、溶液与电极接触界面等)有关,这可能是图2中局部区域添加Na2SO4体系的还原电压甚至高于不添加Na2SO4体系还原电压的原因。
为进一步探明保证 Fe2(SO4)3还原的适宜电导率,在不额外添加电解质的情况下,对不同浓度Fe2(SO4)3溶液的电导率及其电化学还原过程的稳定电压进行了研究,结果如图3所示。

图3 Fe3+浓度变化时的还原电压及电导率曲线
从图3可以看出,随着Fe3+浓度的降低,溶液电导率呈近似线性地降低。当Fe3+质量浓度为2 000 mg/L时,电导率为11.73 mS/cm,而当Fe3+质量浓度降为200 mg/L时,电导率降至1.65 mS/cm。从还原电压来看,当Fe3+质量浓度>800 mg/L时,随着Fe3+浓度的升高,还原电压变化幅度较小;而当Fe3+质量浓度<800 mg/L时,随着Fe3+浓度的升高,还原电压快速降低。还原电压过高,不仅能耗过大,同时还原效率下降。因此,可认为800 mg/L为无需外加电解质进行还原的最低Fe3+浓度,此时溶液电导率为5.36 mS/cm。
综上,当Fe3+质量浓度>800 mg/L时,溶液电导率高于5.36 mS/cm,还原电压变化幅度较小,可以在不外加电解质Na2SO4的条件下进行还原。本研究Fe3+质量浓度为2 000 mg/L,对应的电导率为11.73 mS/cm,故后续实验不添加Na2SO4。
2.1.3 阴极极水比的影响
以 Fe2(SO4)3溶液(Fe3+质量浓度为 2 000 mg/L)为电解液,在电流密度为0.65 mA/cm2的条件下,考察极水比对Fe2+再生率的影响,结果如图4所示。
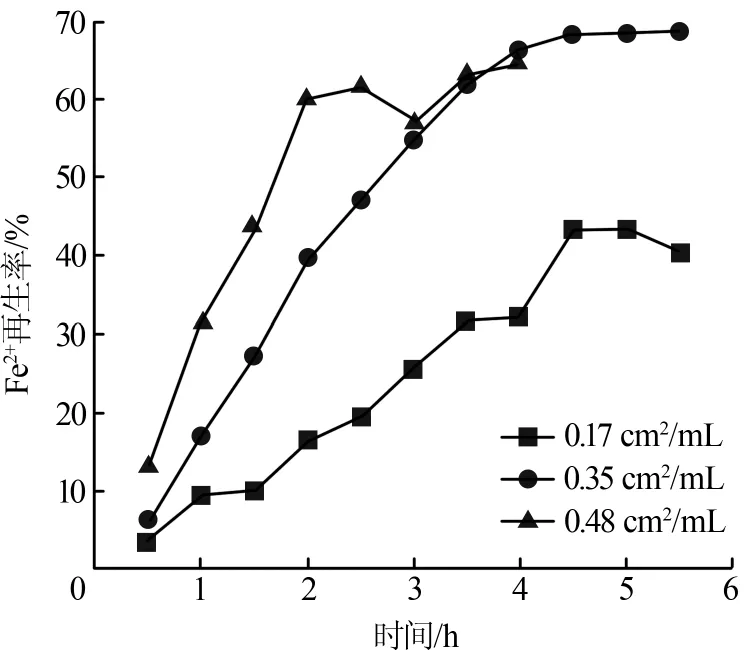
图4 极水比对Fe2+再生率的影响
从图4可以看出,在不同极水比下,随着电化学还原时间的延长,Fe2+再生率均逐步增大并趋于稳定。 当极水比为 0.17、0.35、0.48 cm2/mL 时,Fe2+稳定再生率分别为43.7%(反应4.5 h时)、66.2%(反应4 h时)和60.1%(反应2 h时)。另外,由于还原过程中Fe3+浓度逐渐降低,而H+浓度逐渐升高,反应后期阴极上主要进行析氢副反应而不是Fe3+还原反应,因此,随着电化学还原时间的延长,电流效率逐步降低。实验结果表明,当极水比为0.17、0.35、0.48 cm2/mL时,达到稳定Fe2+再生率时对应的电流效率分别为84.0%、69.7%和92.1%。阴极表面积过小,不利于溶液中Fe3+快速扩散到电极表面,从而影响Fe2+的再生,同时导致电流效率较低。在其他条件不变的情况下,增大极水比,会减少单位面积的电极所需还原的Fe3+的量,从而使电化学还原处理效率得到了提高,电流效率提高。综上,较佳的极水比为0.48 cm2/mL。
2.1.4 电流密度的影响
以 Fe2(SO4)3溶液(Fe3+质量浓度为 2 000 mg/L)为电解液,在极水比为0.48 cm2/mL的条件下,考察电流密度对Fe2+再生率的影响,结果如图5所示。

图5 电流密度对Fe2+再生率的影响
由图5可以看出,当电流密度<0.15 mA/cm2时,Fe2+再生率很低。当电流密度为0.30、0.60、0.65mA/cm2时,达到较为稳定的Fe2+再生率的时间分别为4.5、3、2 h,对应的 Fe2+再生率分别为 58.1%、60.4%和60.1%。极水比一定时,电流密度与还原电流成正比,而增大电流有助于提高还原速率。电流密度对电流效率也有较大影响。实验结果表明,当电流密度<0.30 mA/cm2时,反应前期电流效率迅速升高,后期维持在80%左右;当电流密度为0.60、0.65 mA/cm2时,反应的前1 h电流效率均出现急剧增高,而2 h后都开始迅速降低。电流密度低时,还原速率较慢,反应后期Fe3+浓度仍很高,析氢反应不明显;而电流密度较高时,还原速率快,Fe3+浓度快速降低,析氢反应也会增强,从而导致电流效率下降。综合Fe2+再生率和电流效率,较佳的电流密度为0.65 mA/cm2,在此条件下还原2 h,Fe2+再生率可达到60.1%,对应的电流效率为92.1%。
2.2 富铁污泥混合液还原
采用硫酸处理后的制浆造纸厂实际富铁污泥(经离心和膜滤,溶液Fe3+质量浓度为2 350 mg/L)为电解液,在上述较佳的实验条件下进行电化学还原实验。根据混合液实际情况,选取电流密度为0.55 mA/cm2和0.65 mA/cm2探究Fe3+的还原,并将还原时间延长至7 h,以观察后续实验有无异常情况。实验结果如图6所示。

图6 富铁污泥混合液Fe2+再生率及电流效率随时间的变化
由图6可知,在不同的电流密度下,在反应的前3 h内,Fe3+还原很快,电流效率接近100%。3 h时,电流密度为0.55、0.65 mA/cm2对应的Fe2+再生率分别为62.1%和68.8%。反应4 h后,Fe2+再生率分别稳定至66.9%和74.3%,高于Fe2(SO4)3溶液还原的Fe2+再生率。富铁污泥混合液中Fe3+的电化学还原表现优于Fe2(SO4)3溶液,这可能与混合液中的某些组分有关。据报道,制浆造纸厂富铁污泥中含有较高浓度的 Ti、Si、Ca 等〔5〕,某些物质可能对 Fe3+的电化学还原有促进作用。
3 结论
(1)与石墨棒相比,以不锈钢作为阴极材料可以较大幅度地降低Fe3+还原的过电位,从而减少阴极的析氢副反应,提高电流效率。
(2)采用电化学方法还原 Fe2(SO4)3溶液中的Fe3+,当Fe3+质量浓度>800 mg/L时无需添加辅助电解质。当Fe3+质量浓度为2 000 mg/L时,在极水比为0.48 cm2/mL,电流密度为0.65 mA/cm2的条件下还原2 h,Fe2+再生率可达到60.1%,对应的电流效率为92.1%。
(3)酸处理后的富铁污泥可采用电化学方法实现溶液中Fe3+的部分还原。在极水比为0.48 cm2/mL,电流密度为0.65 mA/cm2的条件下反应3 h,Fe2+再生率可达到68.8%,电流效率接近100%。
