凡纳滨对虾室外生物絮团养殖池水体理化因子和细菌的变化
2020-02-24廖栩峥陈金荣秦海鹏王博胡世康孙成波
廖栩峥,陈金荣,秦海鹏,王博,胡世康,孙成波
(广东海洋大学水产学院,广东 湛江 524088)
我国已成为世界上对虾养殖面积最大和产量最高的国家。自2001年以来,我国对虾养殖业迅速发展,养殖面积和产量逐年增加,现已成为水产养殖业中重要的支柱性产业[1]。凡纳滨对虾(Litopenaeus vannamei)拥有生长速度快,对环境的适应性强等优点[2]。在20世纪80年代末,我国将其引入,并在人工育苗方面获得成功[3]。近年来,随着养殖的规模扩大和集约化程度的提高,养殖对环境的污染、养殖生物疾病的暴发和化学药物的残留等问题日益突出,对凡纳滨对虾的养殖可持续发展带来了严重影响。目前对虾养殖业的所需做的任务之一应为进一步提高高位池养殖技术,生物絮团技术可作为一种新的思路。当今对虾高位池养殖的硬件设施以及管理操作等应用为发展生物絮团技术提供了必要条件[4]。生物絮团技术(Biofloc Technology)的研究和发展为对虾养殖提供了有效的技术支撑和解决方法[5]。基于生物絮团技术的养殖模式符合当代养殖发展的要求,是我国对虾养殖的发展方向。
以色列学者Avnimelech在1999年系统地提出了关于在养殖系统中投入的C/N比对养殖系统水质调控的生物絮团反应机制理论[6],通过将生物絮团技术投入到现实的生产,此举对养殖水体中的氨氮和亚硝酸氮水平有着显著的降低作用[7]。生物絮团是以异养菌为主的菌胶团,经生物絮凝作用结合水体中有机质、原生动物、藻类、丝状菌等形成的絮状物[8]。目前我国的传统水产养殖的生产中,由于残饵和养殖动物排泄物得不到及时分解,水体中的氮经常会处于高水平,这时候通过添加碳源,异养微生物就开始同化水体无机氮从而转化为自身蛋白,并且生物絮团含有可被对虾摄食的营养物质,提高饲料的利用率,减少投饵量,此外生物絮团含有大量活性物质可以提高对虾的非特异性免疫力[9]。生物絮团技术目前还很不成熟,生产上生物絮团的形成容易受到许多因素的影响,例如温度、盐度和pH值等。国外已有报道相似,国内生物絮凝培养取得了理想效果,显着提高了生长率,增加了诱饵系数,明显着抑制了弧菌的产生,稳定了水质,使得对虾的硝化没活力和免疫酶活力得到提高[10]。
由于很多机理没研究透彻导致室外不可控因素较多,现在大部分生物絮团的形成是在室内养殖池塘,该试验在室外养殖池塘培养生物絮团,以期为对虾生物絮团养殖奠定理论基础。
1 材料与方法
1.1 材料
试验地点在广东海洋大学东海岛海洋生物研究基地进行,试验时间为123 d。试验挑选体长为(2.35±0.40)cm,体质量为(0.16±0.07)g体质健壮的凡纳滨对虾作为试验用虾,池塘面积为800 m2,池塘中放入130 000尾对虾。试验通过接种生物絮团,添加氮源和碳源,维持水体C/N为15∶1,构建室外生物絮团池,试验过程中适量补充碳源。投喂时间为 07:00、11:00、18:00、23:00,每天观察对虾的摄食情况和生长情况。
1.2 方法
1.2.1 测定指标
试验期间每日08:00点进行水体理化因子的测定。pH值、温度、盐度检测方法使用电子仪器检测;氨氮(TAN)采用靛酚蓝法,亚硝酸盐(Nitrite)采用重氮-偶氮法,硝酸盐(Nitrate)采用锌-镉还原法,弧菌菌落数、总菌菌落数使用稀释涂步平板计数法。
1.2.2 主要试剂与器具
磺胺(10 g/L),盐酸纳乙二胺溶液(1 g/L),氯化镉溶液(20%),锌卷(AR)(5 cm×6 cm),柠檬酸钠(480 g/L),苯酚溶液,次氯酸钠溶液(1.50 mg/mL有效氯),盐酸(0.018 mol/L),酚酞指示剂,甲基红-次甲基蓝混合指示剂,营养琼脂,TCBS培养基。笔式酸度计pH-220(杭州齐威仪器有限公司)。
1.2.3 样品的采集和DNA的提取
将采集的水样用0.22 μm滤膜对室外生物絮团水进行真空抽滤,每张滤膜过滤150 mL的养殖海水,将滤膜置于50 mL的离心管中,放入-80℃冰箱中保存。DNA提取根据DNA Isolation Kit(美国Hipurte Power SoilR)说明书进行。
1.2.4 PCR扩增
引物设计:341F:5’-CCTAYGGGRBGCASCAG-3’;806R:5’-GGACTACNNGGGTATCTAAT-3’。反应体系:5×PrimeSTAR Buffer(Mg2+Plus)10 μl,dNTP混合物(2.5 mM each)4 μL,上下游引物(5 μM)各 1 μL,PrimeSTARHSDNAPolymerase0.5μL,DNA模板10 ng,补充超纯水至20μl。PCR反应参数:预变性:1×(1min,98°C);循环:27×(30 s,98 °C;30 s,55 °C;30 s,72 °C);后延伸:5 min,72 °C。
1.2.5 数据统计与分析
使用EXCEL软件列出各个指标变化值并且处理试验组与对照组不同数据间的变化趋势图。试验数据运用平均值+标准差表示,采用SPSS17.0软件对数据进行单因素方差分析,结合Duncan’s法进行多重比较,P<0.05时处理组间差异有统计学意义。
2 结果
2.1 生物絮团对氨氮的影响
氨氮的最高浓度在第28天,浓度为(8.53±0.60)mg/L,之后开始下降,第30 天达到最低值(1.70±0.15)mg/L。在80 d之后的试验养殖周期氨氮较为平稳,大部分在1 mg/L以下,最低值在第88天和第108天,浓度为(0.24±0.05)mg/L。
2.2 生物絮团对亚硝酸盐的影响
验期间亚硝酸盐浓度从第1天到到第26天都在0.17 mg/L以下,最低值在第16天,浓度为0 mg/L。从第26天起亚硝酸盐浓度开始快速上升,在第46天达到峰值,亚硝酸盐浓度为(5.18±0.03)mg/L。从第65天开始到第83天快速下降,最低值在第83天,浓度为(0.89±0.02)mg/L。从第84天开始,到试验结束,亚硝酸盐一直保持在0.71 mg/L以下,最低值在第 121天,浓度为(0.07±0.01)mg/L。
2.3 生物絮团对硝酸盐的影响
试验期间硝酸盐浓度从第1天到到第28天波动较小,浓度都在0.34 mg/L以下。从第29天起硝酸盐浓度开始迅速上升,第90天硝酸盐浓度达到最高为(11.11±0.39)mg/L,到试验结束,硝酸盐的浓度趋于平稳,浓度在(4.10±0.15)~(6.49±0.23)mg/L之间。
2.4 构建生物絮团养殖系统期间pH值的变化
试验前期,最高值为第12天,pH值为8.05±0.00,最低值在第53天,pH值为7.49±0.02。在第64天,pH值快速降低,达到6.61±0.03。从第65天开始,到第84天一直稳定在pH值为7.47±0.01~7.59±0.01之间。试验进行到第85天开始,pH值呈现稳定上升趋势,最高值在第108天,pH值为8.31±0.02。
2.5 生物絮团微生物多样性分析
表1为室外生物絮团Alpha生物多样性分析结果。其Otus数量为831±72.06,在菌群丰度指数指数中,Ace 为 1 180.75±133.94,Chao1 为 1 195.12±124.93;在菌群多样性指数中,Shannon为 6.16±0.02,Simpson 为 0.96±0.01。

表1 Alpha多样性分析
2.6 生物絮团微优势菌群分析
由图5可见,从门的分类水平上来分析,变形菌门(Proteobacteria)所占的比例最多(62.43%±1.26%),蓝细菌门(Cyanobacteria)所占的比例最低(4.44%±0.35%);从科的分类水平上分析,红杆菌科(Rhodobacteraceae)占的比例最高(22.01%+2.25%),分支杆菌科(Mycobacteriaceae)占的比例最低(1.06+0.40%)(表2);从属的分类水平上分析,Candidatus Aquiluna所占的比例最高为8.10%±0.39%,其次是聚球蓝细菌属所占的比例为3.32%±0.31%(图6)。
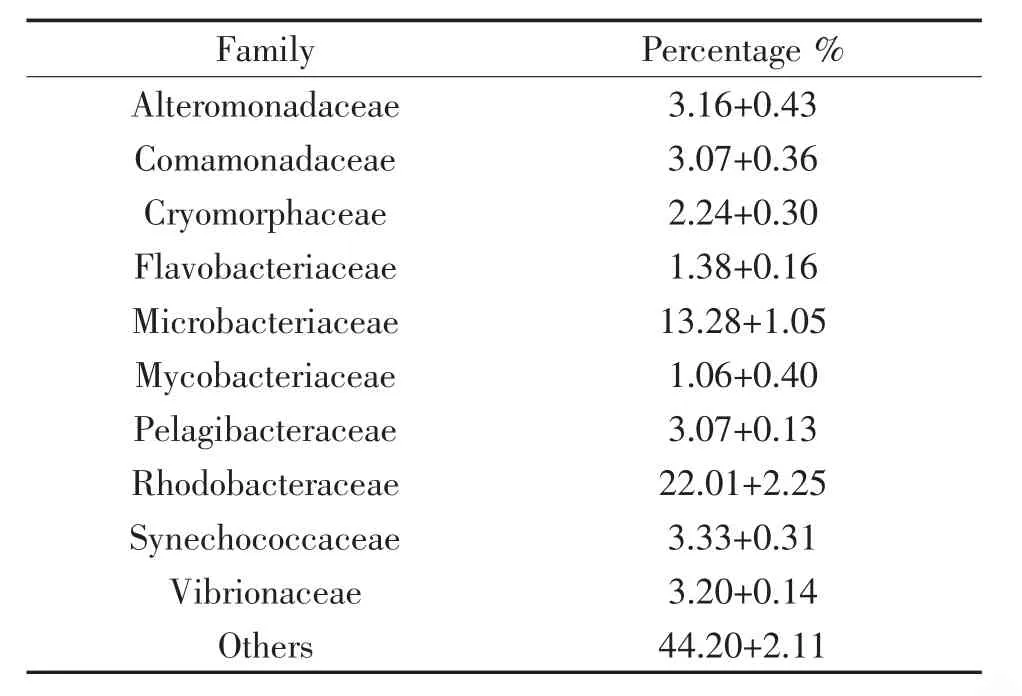
表2 室外生物絮团微生物优势科结构
3 讨论
3.1 室外生物絮团养殖模式对亚硝酸盐、氨氮和硝酸盐含量的影响
从监测水体中三氮转化的变化结果来看,该试验所构造的生物絮团能很好的促进三氮的转化。有研究表明,生物絮团起着降低养殖水体中的氮含的作用。生物絮团技术是一种通过向水产养殖系统添加额外碳,并通过添加外部碳源或提高饲料中碳含量来提高水质的技术[11]。在碳氮平衡的条件下,养殖动物排泄物和剩饵产生的氨氮的转化可通过自养微生物的硝化作用、藻类的光能自养和异养微生物的同化作用等途径实现[12]。传统水产养殖生产中,水体中的氮经常会由于残饵和养殖动物排泄物而处于较高水平[9],若此时添加额外碳源,异养微生物就会同化水体无机氮转化为自身蛋白[8],同时生物絮团作为食物被水生动物摄食,并能够净化养殖水体[9]。总体来说,该技术通过3个方面使对虾养殖受益:增加产量、降低饲料成本和减少水体中的无机氮[13]。从图1可以看出,构建的生物絮团系统前期氨氮浓度不高,从第17天开始水体中氨氮浓度急剧上升,最高达到(8.53±0.60)mg/L,这可能由于投喂饵料和凡纳滨对虾排泄物增加造成有机氮过剩,生物絮团量还不足有关。通过补充碳源,维持水体中C/N为15,正常投喂下,在第28天氨氮开始下降,试验后期,也就是在第67天,即使投饵量不断增加,氨氮能一直维持在较低的稳定值。从图2可知,亚硝酸盐浓度在试验的第26天开始急剧上升,在第64天开始下降,能一直维持在较低值,0.5 mg/L以下。从表3可以得出,水体中硝酸盐浓度在第26天开始逐步上升,后期稳定在 3.70±0.27~11.11±0.39mg/L之间。水体中氨氮、亚硝酸盐和硝酸盐这种承接的变化,可以看出该试验生物絮团系统除了有异养细菌的同化氨氮,亚硝酸氮外,还存在硝化-反硝化作用,并且对有机氮的转化起着很大的影响[14]。该试验在室外养殖池构建生物絮团可以对室外高位池和土塘带来更加安全的养殖模式。
3.2 室外生物絮团养殖模式对水质微生物菌群的影响
生物絮团能为水体中的微生物提供安全的环境,以此躲避高级原生动物捕食,同时絮团结构能有效提高微生物汲取营养的效率,因而大部分的海水微生物可以聚集到生物絮团中[15]。从该试验结果中可以得知,菌群丰度指数中ACE为1 180.75±133.94、Chao1为1 195.12±124.93,菌群多样性的结果为Shannon 为 6.16±0.02,Simpson 为 0.96±0.01,与于任利华等的报道相似[16]。夏耘等[17]在对草鱼养殖中形成的生物絮团的研究中发现,生物絮团菌群多样性随着养殖的时间变化而变化,之后趋于稳定的特征。变形菌是细菌中最大的门类,广泛分布于海洋、江河、海底沉积物中,是凡纳滨对虾养殖中常见优势种类[18]。在该试验验中,变形菌门所占的比例也是最大的,其所占的比例为62.43%,这与于任利、夏耘等研究的结果相似[16-17]。在科的分类水平上,红杆菌科所占的比例最高为22.01%+2.25%,其属于α-变形菌纲(Alphaproteobacteria),这与任利华等研究的黄杆菌纲、α-变形菌纲和芽孢杆菌纲是刺参苗种培育池中生物絮团的主要优势菌群的结果相似,Zhao等(2012)利用bioflocs技术分析生物絮团细菌群落结构得出α-变形菌亚纲细菌是优势菌群[19]。异养细菌是生物絮团转换养殖水体中三氮的主要力量。该试验中变形菌纲占主要地位,这与过往研究污水处理的结果基本一致[20-22],其主要的功能是处理污水中的有机物,由此说明生物絮团在养殖水体中起到了调节水质的作用。该试验在室外凡纳滨对虾养殖池中所构建的生物絮团,从三氮的转换能力和水体中的微生物菌群结构都与一些室内的构建结果相似,此结果可以为室外高位池和土塘养殖带来指导的作用。
