鸡爪槭ApMYB306基因克隆及功能分析
2020-02-22朱璐李淑顺闻婧马秋月颜坤元任杰李倩中
朱璐 李淑顺 闻婧 马秋月 颜坤元 任杰 李倩中


摘要:采用基因克隆的方法获得鸡爪槭金陵黄枫R2R3-MYB转录因子基因,经同源比对和生物信息学分析将其命名为ApMYB306。通过组织表达特性分析发现ApMYB306在茎中表达量最高,叶中表达量次之,根中表达量最低。在洋葱表皮细胞中瞬时表达分析结果显示ApMYB306蛋白定位于细胞核中。ApMYB306对于高温、低温、干旱和盐胁迫均有明显的响应,受胁迫诱导后表达量显著上升。冷冻处理后,转ApMYB306基因株系成活率较野生型升高。ApMYB306超表达拟南芥株系较野生型开花延迟,表明ApMYB306可能通过抑制拟南芥FT基因启动子的表达调控花期。
关键词:鸡爪槭;ApMYB306基因;抗逆性
中图分类号:S687文献标识码:A文章编号:1000-4440(2020)06-1512-09
Abstract:In this study, the R2R3-MYB transcription factor gene was obtained from Acer palmatum Jinlinghuangfeng by gene cloning and named ApMYB306 via homology comparison and bioinformatics analysis. Through the analysis of tissue expression characteristics, it was found that the expression level of ApMYB306 was the highest in the stem, followed by leaves, and the expression level was lowest in the roots. The results of transient expression analysis in onion epidermal cells showed that ApMYB306 protein was localized in the nucleus. ApMYB306 had obvious response to high temperature, low temperature, drought and salt stress, and its expression level increased significantly after induction. After freezing treatment, the survival rate of ApMYB306 transgenic lines was higher than that of the wild-type lines. The flowering time of ApMYB306 overexpressing Arabidopsis lines was later than that of the wild-type lines, which indicated that ApMYB306 might regulate the flowering time by inhibiting the expression of the FT gene promoter.
Key words:Acer palmatum;ApMYB306 gene;stress resistance
雞爪槭(Acer palmatum Thunb.)为槭树科槭属植物,其叶色丰富,叶形优美,是中国极为重要的彩叶树种,具有很高的观赏价值,在彩叶苗木生产中具有十分重要的地位[1]。在鸡爪槭苗木栽培和生产过程中,干旱、盐胁迫、寒害和热胁迫等非生物胁迫是制约鸡爪槭生产和园林应用的关键因素,因此挖掘鸡爪槭抗性基因,解析其调控机制,可为获得优良抗性的鸡爪槭品种及其分子遗传育种提供重要基础。
MYB转录因子大家族包括3个亚类,即MYB1R、R2R3-MYB和MYB3R。其中,植物中最大的亚类是R2R3-MYB转录因子[2-3]。例如,模式植物拟南芥具有126个R2R3-MYB转录因子[3],而玉米的基因组则具有173个[4],苹果具有222个[5],番茄具有121个[6],黑杨木具有192个[7]。R2R3-MYB转录因子功能繁多,参与调控植物初生和次生代谢反应、植物生长发育及生物和非生物胁迫等过程。例如,苹果MdMYB23受冷胁迫诱导。MdMYB23超表达的转基因苹果愈伤组织和拟南芥耐寒性增强[8]。水稻OsMYB2在盐、冷和干旱胁迫下表达增强,超表达植株比野生型对盐、冷和干旱胁迫的耐受性更强[9]。而在拟南芥中,AtMYB30、AtMYB60和AtMYB96(亚家族1)[10-12],AtMYB13和AtMYB15(亚家族2)[13],AtMYB102和AtMYB41(亚家族11)[14-15],AtMYB33和AtMYB101(亚家族18)[16],AtMYB2、AtMYB62和AtMYB108(亚家族20)[17],AtMYB44、AtMYB70、AtMYB73和AtMYB77(亚家族22)[18-19]等均参与调控生物和非生物胁迫响应途径。菊花R2R3-MYB转录因子CmMYB2不仅参与非生物胁迫应答,还参与调控菊花和拟南芥开花[19-20]。本研究根据转录组序列克隆鸡爪槭R2R3-MYB转录因子基因,并对其基因和编码的氨基酸序列进行比对分析,利用荧光定量PCR(qRT-PCR)技术对其基因在不同组织和非生物胁迫下的表达进行分析,为进一步研究鸡爪槭R2R3-MYB转录因子响应非生物胁迫和开花机制奠定基础。
1材料与方法
1.1试验材料及处理方式
供试鸡爪槭品种金陵黄枫种植于江苏省农业科学院槭树良种基地。取当年生新鲜枝条作为外植体,通过组织培养快繁获得无菌幼苗,将幼苗练苗并移栽到穴盘中培养。取生长一致的约10 cm左右的幼苗用于低温(4 ℃)处理和高温(40 ℃)处理。将组织培养获得的幼苗在Hoaglands营养液中水培,取生长一致的约10 cm左右的幼苗用于盐胁迫(200 mmol/L NaCl)处理和干旱(20% PEG6000)处理。4种非生物胁迫处理均以上午9∶00为0 h,分别在0 h、1 h、4 h、8 h、12 h和24 h取样。低温处理和高温处理取样部位为第3和第4片完全展开叶,盐胁迫处理和干旱处理取样部位为不定根,每个处理3个重复。未处理的穴盘苗和水培小苗植株,取其根、茎和叶片,立即放入液氮中,-80 ℃冰箱保存备用,每个组织3个重复。将3周龄的转基因拟南芥株系置于光照培养箱(Sanyo,MIR-154)4 ℃处理24 h,-9 ℃处理6 h后,转移到正常培养条件的光培箱培养14 d,统计观察成活率。培养条件为光周期16 h/8 h(光照/黑暗),温度22 ℃/18 ℃,光照度200 μmol/(m2·s),相对湿度为70%。
1.2总RNA提取及cDNA合成
总RNA提取使用Trizol(TaKaRa, Tokyo, Japan)提取法,使用RNase-free DNase I(TaKaRa公司产品)去除基因组DNA。取1 μg总RNA,利用反转录酶M-MLV反转录获得cNDA备用。
1.3鸡爪槭金陵黄枫ApMYB306基因克隆及表达载体构建
从鸡爪槭转录组库(SRX833686 ULRs: http://www.ncbi.nlm.nih.gov/sra/)中查找获得鸡爪槭ApMYB306 cNDA全长序列,利用Primer Premier 5.0设计ApMYB306全长引物和RT-PCR引物。利用高保真酶Ex Taq(TaKaRa公司产品)进行PCR扩增获得ApMYB306 cNDA全长序列,将扩增产物连接pMD19-T载体(TaKaRa公司产品)进行测序,获得ApMYB306在鸡爪槭金陵黄枫中的cNDA全长序列。将ApMYB306开放阅读框(ORF)使用含有酶切位点BamH I和Not I序列的引物扩增,同时使用BamH I和Not I对扩增产物和pENTR1A(Invitrogen, Carlsbad, CA, USA)进行双酶切。将酶切后的产物回收并利用连接酶T4 DNA ligase(TaKaRa公司产品)进行连接,获得载体pENTR1A-ApMYB306。将该载体进行单酶切,使之线性化,通过LR(LR ClonaseTM II enzyme system,Invitrogen)重组构建到pMDC43载体[21]上,最终获得载体pMDC43-ApMYB306,提取质粒-20 ℃保存备用。
1.4ApMYB306序列比对和系统进化树的构建
从GenBank下载ApMYB306同源蛋白质氨基酸序列,与ApMYB306氨基酸序列共同使用ClustalW软件进行多重比对分析[22]。使用MEGA 7.0软件,基于Neighbor-joining方法构建系统进化树。
1.5ApMYB306亚细胞定位
通过基因枪(PDS-100, Bio-Rad, Hercules, CA, USA)轰击洋葱表皮细胞,将2 μg质粒pMDC43-ApMYB306和pMDC43空载(对照)分别瞬时转入洋葱表皮细胞。将转化的洋葱表皮细胞在MS(Murashige and Skoog)培养基上23 ℃暗培养16 h,通过激光共聚焦显微镜(LSM800, Zeiss, Germany)观察GFP蛋白的表达情况。
1.6ApMYB306基因表达分析
利用荧光定量PCR技术对ApMYB306基因进行表达分析,使用ApActin基因(MN026864)作为内参基因。每个qPCR体系终体积为20.0 μl,均由10.0 μl SYBR Premix Ex TaqTM(TaKaRa公司产品),0.4 μl上游和下游引物(10 μmol/L)(F:5′-TGTCCCCTGAAAAACCAAATA-3′;R:5′-TTCCTCCCCCATCAGCAAA-3′),5.0 μl模板cDNA(1 ng/μl)和0.4 μl ROX组成。使用Real Time PCR荧光定量仪(Applied Biosystems 7500, Carlsbad, CA, USA)进行相对实时荧光定量PCR。反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 35 s 40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s[23]。使用2-△△Ct方法计算相对表达量,每个反应3个生物学重复。
1.7转ApMYB306基因拟南芥
将构建好的质粒pMDC43-ApMYB306转化农杆菌EHA105,利用蘸花法侵染拟南芥花序,在含有潮霉素(Hygromycin)的培养基上筛选获得转基因阳性株系。选择2个独立的转基因株系用于表型分析。
1.8ApMYB306与拟南芥AtFT启动子结合性试验
将1.0 kb的AtFT启动子构建到pCAMBIA1381-LUC载体,与pMDC43-ApMYB306分别转化农杆菌GV3101,将含有阳性质粒的农杆菌和增强表达菌株P19培养至OD值1.5左右。然后离心,收集菌体,将菌体使用侵染缓冲液[10 mmol/L 2-(N-吗啡啉)乙磺酸(MES)、50 mmol/L MgCl2和100 μmol/L 乙酰丁香酮(AS)]重悬。根据试验要求将含有不同载体的菌液混合,同时在每一个组合中添加菌株P19。将混合后的菌液离心,黑暗静止3 h,然后注射烟草叶片。注射后的烟草暗培养1 d,光培养2 d后摘下侵染叶片,在背面喷施荧光素酶(LUC)底物甲虫荧光素(Beetle luciferin),暗处理5 min,使用天能化学发光仪器5200Multi进行曝光拍照。
1.9数据分析
试验数据采用Excel 2016和SPSS 19.0进行统计整理及分析,差异显著性采用ANOVA分析,Duncans检验(P<0.05)。
2结果与分析
2.1ApMYB306基因碱基序列
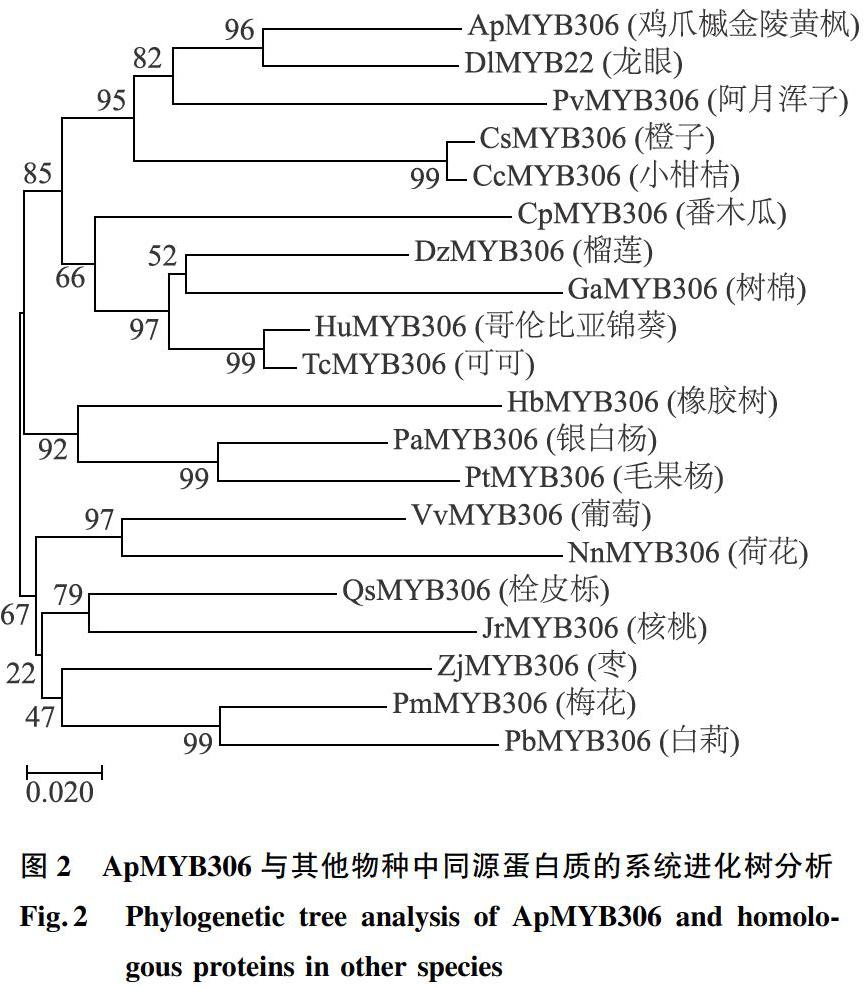
根据转录组中的序列设计全长特异引物,以鸡爪槭金陵黄枫cDNA为模板,利用高保真酶PCR技术获得一个R2R3-MYB转录因子基因的全长序列,通过同源比对和生物信息学分析将其命名为ApMYB306。ApMYB306开放阅读框(ORF)具有1 065 bp,编码一条355个氨基酸残基的多肽。推测蛋白质相对分子质量约为3.967×104,理论等电点为6.35。将ApMYB306基因编码的氨基酸序列在NCBI站點进行BLASTp比对,发现ApMYB306编码的氨基酸序列与龙眼(Dimocarpus longan)MYB22基因(Accession Number:QCH41134.1)、柑桔(Citrus macrophylla)MYB60基因(Accession Number:ABK59039.1)、小柑桔(Citrus clementina)MYB306基因(Accession Number:XP_006431144.1)、葡萄(Vitis vinifera)MYB306基因(Accession Number:XP_002283575.1)、榴莲(Durio zibethinus)MYB306基因(Accession Number:XP_022751922.1)、哥伦比亚锦葵(Herrania umbratica)MYB306基因(Accession Number:XP_021297573.1)和可可(Theobroma cacao)MYB306基因(Accession Number:XP_007032529.1)编码的氨基酸序列进行比对(图1),同源性依次为78.99%、67.5%、65.57%、66.95%、65.66%、67.80%、67.80%。ApMYB306蛋白分别在14~63 aa和67~111 aa处含有2个MYB结构域,为典型的R2R3-MYB转录因子。另外将ApMYB306蛋白氨基酸序列与其他物种中的同源序列进行多重比较,并进行聚类分析,构建系统进化树。从系统进化树中可以看出ApMYB306与龙眼DlMYB22亲缘关系最近,推测其可能具有类似的功能(图2)。
2.2ApMYB306基因组织表达特性及定位
取鸡爪槭幼苗根、茎和叶提取总RNA,并反转录成cDNA,利用实时荧光定量PCR技术分析ApMYB306基因在不同组织中的表达。结果表明,ApMYB306基因在茎中表达量最高,叶片次之,根中表达量最低(图3)。
为了检测ApMYB306蛋白的亚细胞定位情况,本研究在洋葱表皮细胞中瞬时表达了p35S::GFP-ApMYB306。结果表明ApMYB306蛋白在细胞核中积累。同时,在整个细胞中都观察到了阳性对照p35S::GFP瞬时表达产生的GFP信号(图4)。
各氨基酸来源及序列登录号为:DlMYB22(龙眼QCH41134.1)、CmMYB60(柑桔ABK59039.1)、CcMYB306(小柑桔XP_006431144.1)、VvMYB306(葡萄XP_002283575.1)、DzMYB306(榴莲XP_022751922.1)、HuMYB306(哥伦比亚锦葵XP_021297573.1)和TcMYB306(可可XP_007032529.1)。
2.3ApMYB306基因在不同胁迫处理下的表达
2.3.1ApMYB306基因在低温和高温胁迫下的表达如图5所示,ApMYB306基因表达受低温(4 ℃)和高温(40 ℃)诱导。ApMYB306基因在低温和高温条件下,表达量均在24 h内持续升高,并在24 h表达量达到最高值,分别是0 h表达量的8.9倍和5.8倍,表明ApMYB306基因受低温和高温胁迫显著诱导。
2.3.2ApMYB306基因在盐和干旱胁迫下的表达如图6所示,在200 mmol/L NaCl处理下,ApMYB306基因被迅速诱导表达,在处理8 h后,ApMYB306表达量达到最高值,是0 h表达量的3.1倍,随后表达量略有降低,但仍高于对照。ApMYB306基因在20% PEG6000模拟干旱条件下,表达量迅速升高,并在处理8 h后ApMYB306表达量达到最高值,随后逐渐降低,表明ApMYB306基因受盐和干旱胁迫诱导显著。
2.4ApMYB306超表达拟南芥的抗冻性和开花期变化
将获得的ApMYB306超表达拟南芥阳性株系进行筛选和鉴定,选取表达量最高的2个独立株系用于后续功能鉴定。如图7所示,对野生型和ApMYB306超表达拟南芥株系(35S::ApMYB306-1、35S::ApMYB306-2)进行冷冻处理后,ApMYB306超表达拟南芥株系较野生型成活率明显升高。推测ApMYB306基因提高了拟南芥的抗冻性。
对ApMYB306超表达拟南芥株系(35S::ApMYB306-1、35S::ApMYB306-2)进行表型观测发现,ApMYB306超表达拟南芥较野生型拟南芥开花延迟(图8)。野生型拟南芥在播种后(36.6±1.2) d开花,而35S::ApMYB306-1、35S::ApMYB306-2则分别在播种后(42.3±1.5) d和(41.5±1.1) d开花(图8b)。测量野生型和ApMYB306超表达拟南芥株系的莲座叶数量,发现野生型莲座叶数量为12.2±0.9,而35S::ApMYB306-1、35S::ApMYB306-2莲座叶数量多于野生型,分别为16.1±1.2和15.7±1.1(图8c)。对开花关键基因AtFT和AtFLC的表达进行荧光定量PCR分析,发现AtFT的表达量在ApMYB306超表达拟南芥株系中明显降低(图8d),AtFLC的表达量则无明显变化(图8e)。
将拟南芥AtFT 1.0 kb长度的启动子序列构建到无启动子、下游具有LUC标签的载体上,转化农杆菌后,与ApMYB306共同侵染烟草叶片,暗培养1 d,光照培养2 d后喷施LUC底物,用CCD冷冻相机观察。结果表明,阴性对照(只加AtFTpro)亮度较强,添加ApMYB306后,亮度变弱,说明ApMYB306与AtFT启动子结合,并抑制了其表达(图9)。推测ApMYB306可能通过抑制AtFT启动子表达使得ApMYB306超表达拟南芥株系开花延迟,其调控机制还需进一步研究。
3讨论
随着全球环境的不断恶劣,干旱、洪涝等极端天气频现。植物的生长受逆境胁迫影响越来越严重。因此寻找抗逆胁迫下的应答基因,解析其分子调控机制,是进行植物抗逆分子改良与育种的前提。本研究从鸡爪槭金陵黄枫中克隆获得了一个MYB转录因子基因,分析发现该基因编码的转录因子含有2个MYB保守结构域,属于R2R3-MYB类转录因子,经过蛋白质氨基酸序列比对和生物信息学分析将其命名为ApMYB306。
研究结果表明,不同的MYB家族成员具有不同的组织表达特性,可能在不同的组织器官中发挥重要作用。如柳枝稷PvMYB4在根、茎、叶、叶鞘和花序中均有表达,但在叶和叶鞘中表达量最高[24]。大部分的番茄R2R3MYB转录因子基因在根、茎、叶和果实中均有表达,但表达水平不同,如SlMYB16在茎、叶和未成熟的果实中表达量都很高,但在根中表达量相对较低,SlMYB2、SlMYB20、SlMYB29、SlMYB43、SlMYB45、SlMYB53、SlMYB58、SlMYB73、SlMYB74、SlMYB79、SlMYB92、SlMYB93和SlMYB102在根中的表达量则高于其他组织器官[6]。ApMYB306在根、茎和叶中均有表达,但在莖和叶中的表达量远高于根中的表达量。转录因子可结合到靶基因的启动子部位,进而激活或抑制靶基因的表达,该过程发生于细胞核中,因此转录因子必须要进入细胞核中,才能发挥其转录调控的基本功能。我们通过瞬时表达洋葱表皮细胞,发现ApMYB306蛋白定位于细胞核中,具有调控转录的基本条件。越来越多的证据表明,MYB转录因子家族在参与植物胁迫应答调控中起着关键作用[18,25-26]。水稻OsMYB55通过直接激活谷氨酸代谢途径基因GS1、GAT1和GAD1提高对高温胁迫的抗性,超表达OsMYB55可提高在高温胁迫下的产量[25]。拟南芥AtMYB44负调控SOS2的基因ABI1、ABI2、PP2CA、HAB1和HAB2,使得超表达拟南芥对干旱和盐胁迫的抗性增强[18]。小麦TaMYB33响应ABA调控的胁迫应答,超表达拟南芥株系耐旱性和耐盐性增强,这些是通过TaMYB33提高细胞活性氧的清除能力和积累渗透压调节物实现的[26]。桃PpMYB3的表达量变化则与温度的变化趋势一致,推测PpMYB3可能负调控桃的抗寒性[27]。小麦TaMYB165在小麦苗期和灌浆期均响应热胁迫,热胁迫处理后,过表达拟南芥株系较野生型成活率升高[28]。燕子花IlMYB306也参与了非生物胁迫的调控[29]。本研究通过荧光定量PCR技术分析了ApMYB306在不同胁迫下的反应,发现ApMYB306受高温、低温、干旱和盐胁迫诱导表达,在该4种胁迫诱导下表达量明显上调,暗示ApMYB306参与了胁迫响应过程,但其响应机制还需进一步研究。
开花是高等植物生活史的重要过程[30-32],目前已知的调控植物开花的主要途径有:光周期途径(Photoperiod pathway)、春化途径(Vernalization pathway)[33]、赤霉素途径(Gibberellin pathway)和自主途径(Autonomous pathway)[34]。研究结果表明,多个MYB转录因子参与了开花时间的调节。菊花CmMYB2超表达株系开花提前,CmMYB2通过赤霉素途径调控菊花开花[20]。杨树PtrMYB192基因超表达拟南芥株系较野生型开花延迟,其中春化途径关键基因FLC表达量升高,而光周期途径关键基因CO表达量降低[35]。拟南芥MYB30通过直接调节FT基因的表达调控开花[36]。本研究ApMYB306超表达拟南芥株系較野生型开花延迟,进一步研究发现ApMYB306可结合拟南芥FT的启动子序列,并抑制其表达,FT基因是开花途径的整合子,推测ApMYB306通过抑制FT的表达调节拟南芥开花。相关研究结果为ApMYB306进一步的功能研究奠定了基础,为培育鸡爪槭抗逆和不同花期新种质提供了候选基因。
参考文献:
[1]LI S S, LI Q Z, TANG L, et al. Pigment comparison and expression of chlorophyll metabolism genes in yellow and green Acer palmatum leaves[J]. Canadian Journal of Plant Science, 2017, 97: 1-21.
[2]DUBOS C, STRACKE R, GROTEWOLD E, et al. MYB transcription factors in Arabidopsis[J]. Trends in Plant Science, 2010, 15:573-581.
[3]STRACKE R, WERBER M, WEISSHAAR B, The R2R3-MYB gene family in Arabidopsis thaliana[J]. Current Opinion in Plant Biology, 2001, 4:447-456.
[4]YILMAZ A, NISHIYAMA M Y J, FUENTES B G, et al. GRASSIUS: a platform for comparative regulatory genomics across the grasses[J]. Plant Physiology, 2009, 149:171-180.
[5]CAO Z H, ZHANG S Z, WANG R K, et al. Genome wide analysis of the apple MYB transcription factor family allows the identification of MdoMYB121 gene confering abiotic stress tolerance in plants[J]. PLoS One, 2013, 8: e69955.
[6]ZHAO P P, LI Q, LI J, et al. Genome-wide identification and characterization of R2R3MYB family in Solanum lycopersicum[J]. Molecular Genetics and Genomics, 2014, 289:1183-1207.
[7]WILKINS O, NAHAL H, FOONG J, et al. Expansion and diversification of the Populus R2R3-MYB family of transcription factors[J]. Plant Physiology, 2009, 149:981-993.
[8]AN J P, LI R, QU F J, et al. R2R3-MYB transcription factor MdMYB23 is involved in the cold tolerance and proanthocyanidin accumulation in apple[J]. The Plant Journal, 2018, 96(3):562-577.
[9]AN Y, DAI X, ZHANG W H. A R2R3-type MYB gene, OsMYB2, is involved in salt, cold, and dehydration tolerance in rice[J]. Journal of Experimental Botany, 2012, 63(7):2541-2556.
[10]COMINELLI E, GALBIATI M, VAVASSEUR A, et al. A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J]. Current Biology, 2005, 15:1196-1200.
[11]OH J E, KWON Y, KIM J H, et al. A dual role for MYB60 in stomatal regulation and root growth of Arabidopsis thaliana under drought stress[J]. Plant Molecular Biology, 2011, 77:91-103.
[12]SEO P J, PARK C M. MYB96-mediated abscisic acid signals induce pathogen resistance response by promoting salicylic acid biosynthesis in Arabidopsis[J]. New Phytologist, 2010, 186:471-483.
[13]AGARWAL M, HAO Y, KAPOOR A, et al. A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J]. Journal of Biological Chemistry, 2006, 281:37636-37645.
[14]COMINELLI E, SALA T, CALVI D, et al. Over-expression of the Arabidopsis AtMYB41 gene alters cell expansion and leaf surface permeability[J]. The Plant Journal, 2008, 53:53-64.
[15]LIPPOLD F, SANCHEZ D H, MUSIALAK M, et al. AtMyb41 regulates transcriptional and metabolic responses to osmotic stress in Arabidopsis[J]. Plant Physiology, 2009, 149:1761-1772.
[16]REYES J L, CHUA N H. ABA induction of miR159 controls transcript levels of two MYB factors during Arabidopsis seed germination[J]. The Plant Journal, 2007, 49:592-606.
[17]ABE H,URA T, ITO T, et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J]. The Plant Cell, 2003, 15: 63-78.
[18]JUNG C, SEO J S, HAN S W, et al. Overexpression of AtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenic Arabidopsis[J]. Plant Physiology, 2008, 146:623-635.
[19]SHAN H, CHEN S M, JIANG J F, et al. Heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB2 enhances drought and salinity tolerance, increases hypersensitivity to ABA and delays flowering in Arabidopsis thaliana[J]. Molecular Biotechnology, 2012, 51:160-173.
[20]ZHU L, GUAN Y X, LIU Y N, et al. Regulation of flowering time in chrysanthemum by the R2R3 MYB transcription factor CmMYB2 is associated with changes in gibberellin metabolism[J]. Horticulture Research, 2020, 7:96.
[21]CURTIS M D, GROSSNIKLAUS UA. Gateway cloning vector set for high-throughput functional analysis of genes in planta[J]. Plant Physiol, 2003, 133:462-469.
[22]LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. Clustal W and clustal X version 2.0[J]. Bioinformatics, 2007, 23:2947-2948.
[23]ZHU L, MA Q Y, LI S S, et al. Reference gene selection for quantitative real-time PCR analyses of acer palmatum under abiotic stress[J]. Phyton-International Journal of Experimental Botany, 2020, 89:385-403.
[24]SHEN H , HE X , POOVAIAH C R, et al. Functional characterization of the switchgrass (Panicum virgatum) R2R3-MYB transcription factor PvMYB4 for improvement of lignocellulosic feedstocks[J]. New Phytologist, 2011, 193(1):121-136.
