基于UPLC-QTOF/MS的蓝莓果实发育代谢组学差异分析
2020-02-22王倩张长青李广平李海玲赵辉
王倩 张长青 李广平 李海玲 赵辉
摘要:蓝莓做为深受消费者喜爱的一种新兴高经济价值水果,果实风味、色泽和果皮厚度等直接影响其商品品质。为探究果实成熟期间各小分子物质变化对果品品质的影响,通过高效液相色谱及质谱分析,从代谢组学水平对成熟果实中小分子化合物通路成分和变化进行研究。以幼果为对照,共筛选出858个差异离子,其中414个为上调,444个为下调。经KEGG数据库通路注释,鉴定出294种差异代谢物,可分为13大类,其中苯丙酯类和聚酶化合物数量最多,达61种,占总数的20.6%,其次是有机含氧化合物与脂类和类脂分子,各有48种,这些代谢物涵盖了糖类、有机酸、氨基酸、脂类和胺类等化合物。该结果有助于揭示蓝莓果实成熟的生理发育机制,可为高品质蓝莓的培育提供参考。
关键词:蓝莓;代谢组学;果实发育;通路分析
中图分类号:S663.901 文献标志码: A 文章编号:1002-1302(2020)24-0148-05
蓝莓是杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)果树,又名越橘。其果实为蓝色浆果,具有白色果粉,味道酸甜并带有芳香气味。同时蓝莓果实富含花青素、多酚等物质,因而具有较强的抗氧化能力,深受消费者喜爱,是具有较高经济价值和广阔前景的果树树种[1]。近些年我国科研单位陆续开展蓝莓果树的研究与利用,推动了我国蓝莓产业的快速发展。目前南方主栽品种主要为兔眼蓝莓和南高丛蓝莓,多数存在果实小、风味淡、口感不佳等问题。华星等研究发现随着蓝莓果实发育,总酚和总黄酮等物质含量呈先下降再升高的趋势,同时己糖、葡萄糖和果糖的积累可以促进花色苷的形成[2]。
代谢组学全谱分析是对生物体内所有代谢物进行定量分析,并寻找代谢物与生理病理变化相对关系的研究技术,其研究对象是相对分子质量小于1 000 u的小分子物质,如脂类、酮类和有机酸等[3]。使用代谢组学分析样本不仅能系统地分析主要差异物的影响,还能对一些常规分析方法难以检测到的物质进行检测,因此是开展生理差异分析的重要手段。代谢组分析可以从大量代谢物中筛选出具有统计学和生物学意义的差异代谢物,并以此为基础阐明生物体的代谢过程和变化机制差异[4-5]。随着基因组学、转录组学、蛋白组学、代谢组学等组学技术的迅速发展,组学研究方法被应用于果实发育与成熟的研究中,但蓝莓中相关研究较少。由于蓝莓的高营养价值,研究人员对其营养成分、抗氧化活性物质等研究较为深入。但利用高效液相色谱串联质谱技术,对蓝莓果实发育过程中代谢物质进行组学分析,从差异代谢物及代谢途径等方面进行阐述的研究甚少。
为研究蓝莓果实成熟期间各小分子物质变化对果品品质的影响,本研究通过高效液相色谱串联质谱技术,从代谢组学水平对成熟果实中小分子化合物组分差异和通路成分进行分析,以期为蓝莓果实发育代谢组学研究提供基础。
1 材料与方法
1.1 材料与设计
以金陵科技学院园艺实验站种植的兔眼蓝莓(Vaccinium ashei)品种“粉蓝”为试材,树龄达10年以上,分别在果实膨大期(直径5 mm)和成熟期采集果实样本。对于每个样品均等分成4份,每份100 g,用干冰储藏运送进行代谢物提取。
1.2 方法
1.2.1 代谢物提取 样品采用有机试剂沉淀蛋白法进行代谢物提取,具体过程如下:经-80 ℃保存的果实样品先放置于-20 ℃环境下30 min,再放置于4 ℃冰箱解冻。向每个样品管中添加 800 μL 冷冻后的甲醇 ∶ 水(体积比为1 ∶ 1)缓和溶液。在每个样品管中分别加入2个钢珠,利用组织研磨器进行充分研磨,设置参数为50 Hz,5 min;取出钢珠,将离心管放置在-20 ℃冰箱中沉淀2 h,然后在4 ℃、30 000 g条件下离心15 min。分别从每个样品中取出650 μL放入新样品管中,并在 4 ℃、25 000 g条件下离心15 min,然后从每个样品中取出550 μL放入新样品管中,按照顺序将样品放置保存。最后,每个样品取30 μL混合,制成质量控制(QC)样品,进行质谱数据采集。
1.2.2 代谢物分离 用质控(QC)样品平衡仪器后,采用超高效液相色谱系统(Waters,UK)进行色谱分离,色谱柱温度保持在50 ℃,流速为 0.4 mL/min,其中流动相A为水和0.1%甲酸,流动相B为甲醇和0.1%甲酸。对代谢物使用以下梯度洗脱:0~2 min,100%流动相A;2~11 min,0~100%流动相B;11~13 min,100%流动相B;13~15 min,0~100%流动相A。每个样品的上样体积为10 μL。
1.2.3 代谢物检测 用高分辨率串联质谱仪Xevo G2-XS QTOF (Waters,UK)对色谱柱上洗脱下来的小分子代谢物进行正负离子模式检测。对于正离子模式,毛细管电压和取样锥电压分别设置为3.0 kV和40.0 V;对于负离子模式,毛细管电压和取样锥电压分别设置为2.0 kV和40.0 V。用质心均方误差模式进行质心数据采集。一级扫描范围为50~1 200 u,扫描时间为0.2 s。用20~40 eV的能量对所有母离子进行碎片化,扫描时间为0.2 s。在数据采集过程中,每3 s对亮氨酸脑啡肽信号进行1次实时质量校正。同时,每隔10个样品进行1次质量控制样品采集,用来评估样品数据采集过程中仪器状态的稳定性。
1.3 数据分析
使用软件Progenesis QI (version 2.2)对质谱下机数据进行峰对齐、峰提取和峰鉴定等[6-7]。单变量分析采用t检验和变异倍数分析(fold change analysis,FC analysis),多變量分析采用无监督的主成分分析方法(principal component analysis,PCA)。采用单变量分析差异倍数(fold change)和q值来筛选差异表达的代谢物,以差异倍数≥1.2 或≤0.833 3,q-value 值小于0.05作为筛选差异代谢物的条件。使用R软件中的pheatmap包中的pheatmap函数进行聚类分析,并基于KEGG数据库进行代谢物代谢通路注释。
2 結果与分析
2.1 差异代谢物检测分析
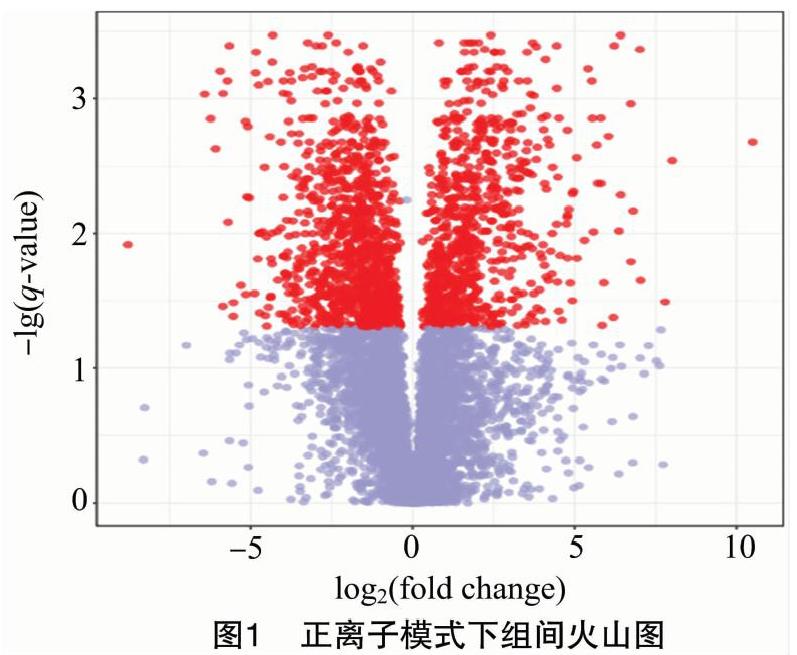
通过变异倍数分析(FC)和火山图(图1),可直观显示出2组代谢物间变化的显著性,从而筛选差异性代谢物。筛选条件为FC值小于等于0.833 3或大于等于1.2,且q-value值小于0.05。图1为成熟果实和幼嫩果实组织间正离子模式下的火山图,log2 (fold change)为横坐标,q-value的负对数-lg(q-value)为纵坐标,红点为筛选出的差异表达的代谢物。
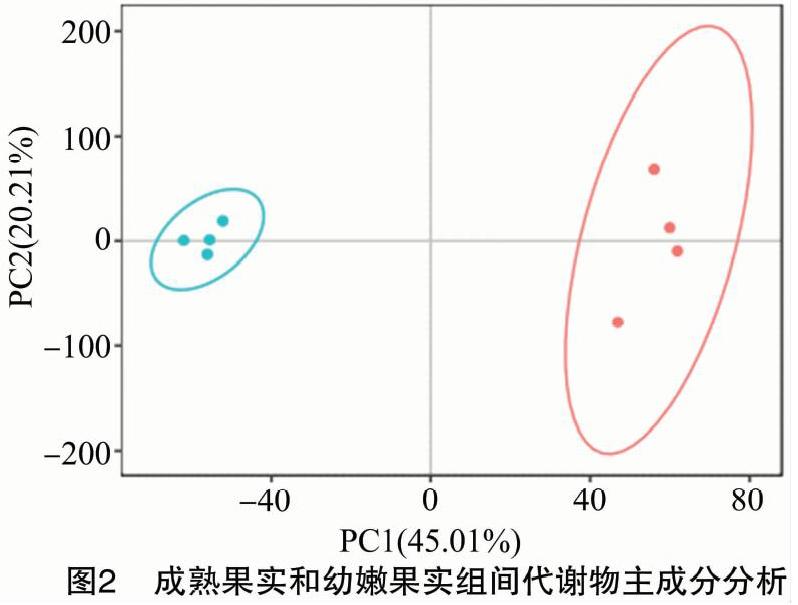
代谢组学分析中,主成分分析(PCA)主要用于观察实验模型中的组间分离趋势,是否有异常点出现,以及反映组间和组内变异度的分析技术。PCA分析结果(图2)表明,2个处理的4次重复在得分图中分布较为集中,表明每个处理内差异较小,本次试验的稳定性比较好。红色标注为成熟果实4个样本,蓝色标注为幼嫩果实4个样本。横坐标为第一主成分PC1,由图可知该主成分能综合原始信息的比例为45.01%,纵坐标为第二主成分PC2,该主成分能综合原始信息的比例为20.2%。成熟果实和幼嫩果实2组间PCA得分差异显著,相距较远,且处于95%置信区间内,表明2个组分间的代谢产物存在较大的差异。
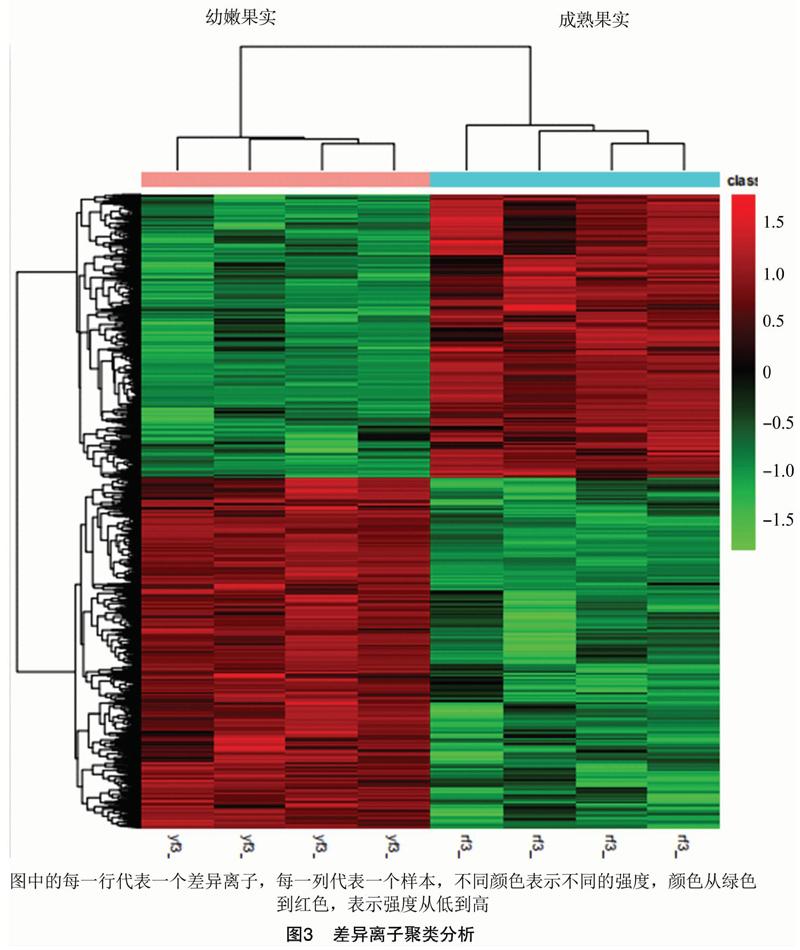
2.2 差异离子聚类分析
在正离子模式条件下,提取峰后共得到 1 784个差异离子,经一级数据搜索数据库后鉴定到1 150个差异离子,其中527个为上调,623个为下调;经数据库理论二级碎片搜索后鉴定到858个差异离子,其中414个为上调,444个为下调。对筛选出来的离子进行聚类分析,结果如图3所示。
2.3 差异代谢物通路分析
通过代谢通路分析能够更好地了解代谢物所参与的主要生化代谢途径和信号转导通路[8],基于KEGG数据库进行代谢物代谢通路注释,共鉴定出294种代谢物,可分为13大类,详见图4。苯丙酯类和聚酮化合物最多,达61种(占总差异物的20.6%),其次是有机含氧化合物与脂类和类脂分子相同,均为48种(各占总差异物的16.2%),苯环类化合物为44种(占总差异物的14.9%),有机杂环化合物为43种(占总差异物的14.5%),有机酸及其衍生物为37种(占总差异物的12.5%),涵盖了糖类、有机酸、氨基酸、脂类和胺类等化合物。
这些差异代谢物参与了果实发育过程中不同的生物代谢途径[9-10],由图5可见,共有40个差异代谢物参与了赖氨酸降解过程。其中L-2-氨基己二酸6-半醛、6-氨基-2-氧代己酸甲酯和5-氨基戊酸盐作为生物素关键因素对L-赖氨酸降解发挥较大的促进调控作用。6-乙酰氨基-2-氧代己酸甲酯起抑制作用,需氧菌素对于果实发育的调控作用尚不明确。
3 讨论
赖氨酸在脱羧酶的作用下发生脱羧反应可生成1,5-戊二胺(又称为尸胺),有研究表明戊二胺可以作为第二信使调控植物衰老过程,并能促进雌蕊和雄蕊的发育,外源添加戊二胺可以改善坐果和促进果实发育。同时戊二胺也是生物合成喹嗪碱的前体,而喹嗪碱在调节植物新陈代谢和合成次级代谢产物方面也起着重要的作用。一般来说,随着果实的成熟,胺类物质积累量会逐渐减少[11]。本研究中关于蓝莓胺类物质的研究结果支持了这一观点。在成熟果实中,多胺含量,包括Spd、Spm、4-氨基丁烷和tSpm等,均较幼果低。
代谢组学是通过分析海量代谢物信息,来探究生物体内源性代谢物整体及其变化规律的科学。海量信息的获取不仅受提取方法的影响,还受检测仪器的分辨率等因素的影响。代谢组学常用高分辨检测技术有 GC-MS 和LC-MS,与 LC-MS 相比,GC-MS 不宜进行热不稳定代谢物的分析,且样品前处理需衍生化,不仅操作繁琐、耗时,还可能引入干扰物[12],对组学分析产生误差。LC-MS 技术虽较晚应用到代谢组学中,但具有检测范围广,适用于热不稳定代谢物,前处理简单,基本不需要衍生化等优点。本研究采用的 QTOF(飞行时间质谱)技术,是目前使用较普遍的代谢组学质谱分析仪器,准确度能达到1×10-6 mg/L,通过与超高压液相色谱联用,扫描速度快,为代谢物的定性分析提供更多依据[13]。本试验通过高效液相色谱结合串联质谱分析,揭示了在果实成熟中赖氨酸降解的代谢通路中各小分子化合物的作用,研究结果拓展了人们关于蓝莓小分子代谢物的认知和应用。
参考文献:
[1]孙海悦,李亚东. 世界蓝莓育种概述 [J]. 东北农业大学学报,2014,45(9):116-22.
[2]华 星,侯智霞,苏淑钗. 蓝莓果实关键品质的形成特性 [J]. 经济林研究,2012,30(1):108-113.
[3]戴宇樵,吕才有. 代谢组学技术在茶学中的应用研究进展 [J]. 江苏农业科学,2019,47(2):24-28.
[4]Fortes A M,Agudelo-Romero P. Polyamine metabolism in climacteric and non-climacteric fruit ripening [J]. Methods Mol Biol,2018,1694:433-447.
[5]Poidevin L,Unal D,Belda-Palazon B,et al. Polyamines as quality control metabolites operating at the post-transcriptional level [J]. Plants,2019,8(4):109-121.
[6]Wen B,Mei Z L,Zeng C W,et al. MetaX:a Flexible and comprehensive software for processing metabolomics data [J]. BMC Bioinformatics,2017,18(1):183-196.
[7]Dunn W B,Broadhurst D,Begley P,et al. Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry [J]. Nature Protocols,2011,6(7):1060-1083.
[8]Chen X,Qiu L,Guo H,et al. Spermidine induces physiological and biochemical changes in southern highbush blueberry under drought stress [J]. Brazilian Journal of Botany,2017,40:841-851.
[9]Lasanajak Y,Minocha R,Minocha SC,et al. Enhanced flux of substrates into polyamine biosynthesis but not ethylene in tomato fruit engineered with yeast S-adenosylmethionine decarboxylase gene [J]. Amino Acids,2014,46(3):729-742.
[10]陈志远,赵冠杰,魏若男. 蓝莓果实发育期内源精胺的CE-ECL分析及与保鲜品质的关系 [J]. 分子植物育种,2019,17(7):2356-2362.
[11]Kushad M M,Yelenosky G,Knight R. Interrelationship of polyamine and ethylene biosynthesis during avocado fruit development and ripening [J]. Plant Physiology,1988,87(2):463-467.
[12]常玉瑋,王国栋. LC-MS 在植物代谢组学分析中的应用 [J]. 生命科学,2015,27(5):978-985.
[13]孔宏伟,戴伟东,许国旺. 基于液相色谱-质谱联用的代谢组学研究中代谢物的结构鉴定进展 [J]. 色谱,2014,32(10):1052-1057. 郭 双,刘 华,罗 昌,等. 4个芳香菊品种花、叶香气成分的HS-SPME/GC-MS分析[J]. 江苏农业科学,2020,48(24):198-207.
