联合利妥昔单抗治疗对高龄DLBCL的疗效及安全性影响
2020-02-22汪弘毅寿黎红方遒韩书文施雪霏
汪弘毅 寿黎红 方遒 韩书文 施雪霏


[摘要] 目的 探究联合利妥昔单抗的治疗方案对我国75岁及以上老年弥漫大B细胞淋巴瘤(DLBCL)患者的预后是否有改善。 方法 回顾性分析2013年1月~2019年5月我院诊治的69例75岁及以上老年DLBCL患者病例资料,根据治疗方式分为免疫化疗组和对症支持组,比较两组一般资料及总生存,多因素分析影响患者预后的相关因素。免疫化療组根据2疗程治疗后疾病是否进展分为未进展组和进展组,比较两组总生存情况。 结果 全部患者中位随访时间为447 d,免疫化疗组2个疗程后13例患者完全缓解(27.1%),17例部分缓解(35.4%),预计平均生存时间为1925.582 d,对症支持治疗组为122.985 d,差异有统计学意义(P=0.000)。多因素分析发现,仅治疗方式对OS的影响有统计学意义(P=0.000),仅对症支持治疗患者的死亡风险是免疫化疗患者的37.473倍。免疫化疗组未出现治疗相关死亡,其未进展组和进展组3年生存率比较(87.5% vs 50.0%),差异有统计学意义(P=0.023)。 结论 对于75岁及以上老年弥漫大B淋巴瘤患者,与仅对症支持治疗相比,联合利妥昔单抗的治疗可显著提高患者总生存率,且相对安全。对此类患者,治疗上不能一味追求疾病完全缓解,而是维持疾病不要进展对于患者预后有重要意义。
[关键词] 老年;弥漫大B细胞淋巴瘤;利妥昔单抗;预后
[中图分类号] R733.1 [文献标识码] B [文章编号] 1673-9701(2020)33-0118-05
[Abstract] Objective To explore whether the treatment regimen with rituximab can improve the prognosis of diffuse large B-cell lymphoma(DLBCL) patients aged 75 years or above in China. Methods A total of 69 DLBCL patients aged 75 and over who were treated in our hospital from January 2013 to May 2019 were retrospectively analyzed. According to the treatment methods, they were divided into the immunochemotherapy group and the symptomatic support group. The general data and overall survival of the two groups were compared, and the related factors affecting the prognosis of the patients were analyzed by multivariate analysis. The immunochemotherapy group was divided into the non-progressive group and progressive group according to whether the disease progressed after two courses of treatment, and the overall survival of the two groups was compared. Results The median follow-up time of all patients was 447 days. After two immunochemotherapy courses, 13 patients achieved a complete response(27.1%), and 17 patients achieved partial response(35.4%). The average estimated survival time was 1,925.582 days in the immunochemotherapy group, and 122.985 days in the symptomatic support group, with statistically significant differences(P=0.000). Multivariate analysis found that the effect of treatment alone on OS was statistically significant(P=0.000), and the risk of death in patients receiving symptomatic support therapy alone was 37.473 times higher than that in patients receiving immunochemotherapy. There was no treatment-related death in the immunochemotherapy group, and the difference in the 3-year survival rate between the non-progressive group and the progressive group was statistically significant(87.5% vs 50.0%, P=0.023). Conclusion In patients with diffuse large B lymphoma aged 75 years and older, rituximab combined with symptomatic support therapy significantly improves overall survival and is relatively safe. For such patients, treatment does not blindly pursue the complete remission of the disease, and maintaining the disease not to progress is of great significance to the patient's prognosis.
[Key words] Old age; Diffuse large B-cell lymphoma; Rituximab; Prognosis
随着中国人民生活水平及医疗水平的发展,目前人均寿命已明显增高,截至2018年底,60岁及以上老年人口为2.49亿人,占总人口的17.9%。国家卫健委分析2018年我国居民预期人均寿命为77.0岁。预计到2020年,高龄老年人将增加到2900万人[1]。据浙江省湖州市疾控中心分析,2018年湖州户籍人口人均预期寿命再创新高,达到81.89岁,其中男性79.95岁、女性83.94岁。随着老年人口的日益增多,如何改善老年人疾病的预后成为重中之重。弥漫大B细胞淋巴瘤是我国最常见淋巴瘤[2-3]。我国2011年1项由24个中心联合进行、共收集10 002例病例样本的分析报告指出,在中国DLBCL占所有NHL的45.8%,占所有淋巴瘤的40.1%[4]。对于弥漫大B细胞瘤传统治疗方法是包含蒽环类药物的化疗[5],但是对于较高龄的患者化疗副反应往往过大,不能耐受,并未明显提高此类患者生存,故很多患者及家属往往放弃积极治疗。而利妥昔单抗的出现及应用不仅提高了弥漫大B细胞淋巴瘤的治疗效果,同时也给这部分老年患者的治疗带来曙光,是近20年来弥漫大B细胞淋巴瘤治疗最重要的进步[6]。但是目前对于较高龄老年患者的临床研究仍然缺乏,为探讨联合利妥昔单抗的化疗对于此类患者的疗效与安全性,本研究分析了6年半来于我院诊治的75岁及以上老年患者的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
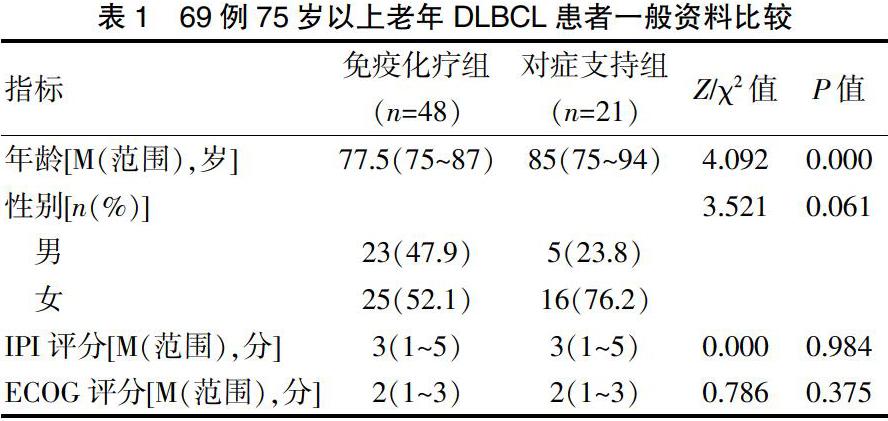
收集2013年1月~2019年5月在我院血液科收住的≥75岁的弥漫大B细胞淋巴瘤患者69例作为研究对象。所有患者均通过组织活检及免疫组化确诊为弥漫大B细胞淋巴瘤,初诊时均接受骨髓活检及显微镜观察骨髓细胞形态,流式细胞仪检测细胞免疫表型,所有患者初诊时均接受增强CT或PET-CT检查评估病情。所有接受免疫化疗的患者治疗2个疗程以后均行PET-CT或增强CT及骨穿评估病情。患者中男28例,女41例,中位年龄78(15~94)岁。其中免疫化疗组48例,对症支持组21例,免疫化疗组中位年龄77.5(75~87)岁,低于对症支持治疗组中位年龄85(75~94)岁,差异有统计学意义(P=0.000);性别及IPI评分、ECOG评分比较,差异均无统计学意义(P>0.05)。见表1。
1.2 方法
1.2.1 免疫化疗组 48例患者采用联合利妥昔单抗的化疗至少3个疗程,为免疫化疗组。其中大部分患者(37例)按照计划完成6个疗程联合利妥昔单抗的化疗及2疗程利妥昔单抗单药维持,化疗周期为21 d。实际疗程数根据患者缓解及耐受情况调整,部分复发患者再次使用联合利妥昔单抗的化疗方案诱导治疗。利妥昔单抗[Roche Pharma(Schweiz)Ltd,批准文号:国药准字J20120019、国药准字J20120020、国药准字J20170034,规格:100 mg/10 mL,500 mg/10 mL]的用法为375 mg/(m2·d);具体剂量根据患者实际情况,所有患者的单次实际剂量在500 mg或600 mg,主要的化疗方案为减低剂量的CHOP样方案,以标准剂量的50%~75%为初始剂量;环磷酰胺(Baxter Oncology GmbH,批准文号:国药准字H20110407\H20160467,规格:200 mg/瓶)单疗程总剂量为500~1000 mg×d1,长春地辛(杭州民生药业有限公司,批准文号:国药准字H20057028,规格:1 mg/瓶)单疗程总剂量为2~4 mg×d1,脂质体阿霉素(石药集团欧意药业有限公司,批准文号:国药准字H20113320,规格:20 mg/10 mL,上海复旦张江生物医药股份有限公司,批准文号:国药准字H20084432,规格:20 mg/10 mL)单疗程总剂量为20~40 mg,地塞米松(广州白云山天心制药股份有限公司,批准文号:国药准字H44022090,规格:5 mg/mL)单疗程剂量为10~15 mg×d1~5,部分患者为R2(利妥昔单抗联合来那度胺)方案,来那度胺(北京双鹭药业股份有限公司,批准文号:国药准字H20170009,规格:25 mg/片)25 mg×d1~14,具体用药时间根据患者血常规情况于门诊调整。
1.2.2 对症支持组 另外21例患者采用对症支持治疗,包括增强免疫、促造血、抗感染及血制品输注等治疗,为对症支持组。
1.3 观察指标
病例资料中的缓解标准根据美国国立综合癌症网络(National comprehensive cancer network,NCCN)颁布的指南[7]。通过电话、信件、病历登记系统等对所有患者进行随访,末次随访时间为2019年12月15日,中位随访时间为447 d(8~2326 d)。总生存(OS)时间指疾病确诊后至患者死亡或末次随访的时间。
1.4 统计学方法
所有统计均采用SPSS 23.0统计学软件完成分析。分类变量比较采用χ2或精确检验,连续型变量采用非参数秩和检验。Kaplan-Meier法用于分析OS率,并采用Log-rank检验比较组间差异性;同时采用COX风险模型完成OS单因素及多因素分析,单因素分析中P<0.10的变量进入多因素模型,多因素以强迫代入法分析,P值采用双侧分析,P<0.05为差异有统计学意义。
2 結果
2.1 不同治疗方式对患者预后的影响
2.1.1 疾病反应率 联合利妥昔单抗的免疫化疗组2个疗程治疗后的总反应率(OR)为62.5%,其中完全缓解(CR)率为27.1%,部分缓解(PR)率为35.4%,疾病稳定(SD)率为20.8%,疾病进展(PD)率为16.7%。对症支持组共21例,其中13例在治疗期间行影像学检查评估病情(3例行PET-CT评估病情,10例行原病灶的增强CT检查),10例疾病进展(76.9%),剩余3例疾病稳定(23.1%),无人疾病缓解(0.0%)。
2.1.2 总生存(OS)时间 至随访终点,两组患者总死亡率为36.2%(25/69),其中对症支持组组内死亡率为76.2%(16/21),免疫化疗组组内死亡率为18.8%(9/48)。免疫化疗组预计平均生存时间为1925.582 d(95%CI:1690.618~2160.545),仅对症支持组预计平均生存时间为122.985 d(95%CI:94.375~151.595),差异有统计学意义(P=0.000)。见图1。免疫化疗组3年总生存率为79.3%,至随访结束,对症支持组最长生存时间为199 d。
2.1.3 联合利妥昔单抗免疫治疗的安全性 48例采用联合利妥昔单抗化疗的患者中,有6例患者治疗过程中出现过Ⅳ级骨髓抑制,2例患者出现过Ⅲ级骨髓抑制,11例患者出现过Ⅱ级骨髓抑制,15例患者出现过Ⅰ级骨髓抑制。因骨髓抑制予以粒细胞集落刺激因子(G-csf)升白细胞针皮下注射者6例,其中继发感染者5例,予以抗生素抗感染后好转,因骨髓抑制予以红细胞输注者2例,无血小板输注患者。见表2。
2.2 免疫化疗组治疗后缓解情况
根据2个疗程治疗后的缓解情况,将联合利妥昔单抗患者分为四组,分别是2个疗程完全缓解(CR)组、2个疗程部分缓解(PR)组、2个疗程疾病稳定(SD)组、2疗程疾病进展(PD)组。3年生存率分别为:84.6%、94.1%、80.0%、50.0%,生存曲线见图2,总体差异无统计学意义(P=0.112)。根据2个疗程治疗后疾病是否进展,将其分为兩组,未进展组和进展组,未进展组3年生存率为87.5%,进展组3年生存率为50.0%,差异有统计学意义(P=0.023)。见图3。
2.3 OS危险因素分析
单因素提示年龄(P=0.000)及治疗方式(P=0.000)对OS均有一定程度影响。但通过多因素分析可发现,只有治疗方式对OS的差异有统计学意义(P=0.000)。仅对症支持治疗患者的死亡风险是联合利妥昔单抗化疗患者的37.473(11.588~121.181)倍。见表3。
3 讨论
世界许多国家正经历人口老龄化进程,我国也不例外[8]。我国第六次全国人口普查(2010年11月1日开始)数据显示,60岁及以上人口占比已经达到13.3%[9]。并且老年人的数量及其在总人口占比将会不断增长。根据预测,到2020年60岁以上老年人口将达到2.5亿人,其中80岁以上高龄老年人超过3000万人,并且2050年60岁及以上人口占比约35%,80岁及以上高龄老年人口增长至8200多万人,占老年人口的比重增长至21.3%,届时中国将成为一个高龄化的社会[10-12]。所以老年人的健康问题是我国医疗卫生工作的重中之重。对于较高龄患者,在传统化疗时代,不仅治疗相关死亡率高,且治疗反应差,很大一部分家庭放弃了对此人群的治疗[13]。然而利妥昔单抗的出现大大提高了患者的缓解率,并且由于减低了化疗的剂量甚至达到无化疗的联合用药,大大减少了此类患者治疗相关的并发症,极大提高了其生存时间及生活质量[14]。
利妥昔单抗(Rituximab,RTX)是通过基因重组技术研究出的一种人/鼠嵌合型单克隆抗体,通过识别B细胞表面的CD20抗原发挥作用[15],在与跨膜抗原CD20特异性结合后,通过补体依赖细胞介导的细胞毒作用、抗体依赖细胞介导的细胞毒作用与凋亡机制清除恶性B细胞[16-17]。目前国内及国际上针对75岁及以上老年人(较高龄)罹患弥漫大B细胞淋巴瘤的治疗相关研究还较缺乏。对于此人群治疗策略的选择目前尚无统一意见。为此本研究回顾性研究了我中心2013年1月~2019年5月就诊的69例75岁及以上的弥漫大B细胞淋巴瘤患者。
通过对免疫化疗组与对症支持组生存分析比较,发现免疫化疗组生存时间明显延长,预计生存时间明显长于对症支持组(1925.582 d vs 122.985 d),差异有统计学意义(P=0.000)。并且在利妥昔单抗等靶向药物治疗时代,化疗药物的地位也在不断接受挑战[18],此研究中这些较高龄患者全部采用减低剂量的化疗,甚至部分患者采用了利妥昔单抗联合来那度胺的无化疗治疗,这极大地减轻了治疗的副作用,减少了并发症的发生,本研究证实了这一点,所有患者无因治疗相关并发症而死亡,部分患者出现了Ⅲ级及以上骨髓抑制(16.7%),但经过对症支持治疗和调整化疗药物剂量均得到缓解。北京医院血液内科李江涛等[19]的一项回顾性研究也表明,对于这类老年患者,联合利妥昔单抗的减轻剂量化疗与联合利妥昔单抗的足剂量化疗对患者生存比较,差异无统计学意义。以上研究表明,在利妥昔时代,以及接下来的免疫靶向治疗时代(如利妥昔单抗联合来那度胺等),即使对于较高龄(年龄≥75岁)患者,积极的治疗仍是安全的,并且可以极大提高患者的生存期。
通过比较免疫化疗组2个疗程治疗后缓解情况对患者预后的影响,将其分为四组,分别是完全缓解(CR)组、部分缓解(PR)组、疾病稳定(SD)组、疾病进展(PD)组。四组患者3年生存率分别为84.6%、94.1%、80.0%、50.0%,差异无统计学意义(P=0.112)。根据2个疗程治疗后疾病是否进展,将其分为未进展组和进展组,未进展组3年生存率为87.5%,进展组3年生存率为50.0%,差异有统计学意义(P=0.023)。结果提示对于较高龄患者,不要一味追求疾病完全缓解,维持疾病不要进展对于患者预后有重要意义。
遗憾的是由于数据来源时间跨度较大,免疫组化抗体标志物种类不完全,以及部分患者未行病理组织的遗传学检测,故双打击/双表达数据不完全,未能将其纳入多因素生存分析。
综上所述,随着人民生活、经济水平的提高,高龄人群所占比越来越大,是医疗工作的新形势、新特点。利妥昔单抗等靶向药物的出现,减低甚至消除了传统化疗药物的使用,极大地减轻了治疗的副作用,为高龄人群积极的治疗带来福音[20]。通过对免疫化疗组与对症支持组生存分析比较,发现免疫化疗组可以显著提高患者预后,且较为安全,是高龄患者治疗的重要选择。通过免疫化疗组2个疗程治疗后缓解情况分析,提示对于这类患者,不能一味追求疾病完全缓解,维持疾病不要进展对于患者预后有重要意义。
[参考文献]
[1] 刘尚昕,于普林. 人口老龄化对我国健康保健服务体系的挑战与对策[J]. 中华老年医学杂志,2020,39(3):255-258.
[2] Sun J,Yang Q,Lu Z,et al. Distribution of lymphoid neoplasms in China:Analysis of 4,638 cases according to the World Health Organization classification[J]. Am J Clin Pathol,2012,138(3):429-434.
[3] Yang QP,Zhang WY,Yu JB,et al. Subtype distribution of lymphomas in southwest China:Analysis of 6382 cases using WHO classification in a single institution[J]. Diagn Pathol,2011,6:77.
[4] Li Xq L,Gao ZF. The relative frequencies of lymphoma subtypes in China-a nationwide study of 10 002 ca-ses by the Chinese Lymphoma Study Group(CLSG)[J]. Ann Oncol,2011,22(Suppl 4):141-146.
[5] 張利娟,王凤玮. 弥漫大B细胞淋巴瘤的治疗进展[J]. 中华临床医师杂志(电子版),2014,(11):2127-2132.
[6] 杨国荣,钟美佐. 弥漫大B细胞淋巴瘤的分子靶向治疗[J]. 国际肿瘤学杂志,2012,39(4):311-315.
[7] Cheson BD,Fisher RI,Barrington SF,et al. Recommendations for initial evaluation,staging,and response assessment of Hodgkin and non-Hodgkin lymphoma:The Lugano classification[J]. J Clin Oncol,2014,32(27):3059-3068.
[8] 饶克勤,钱军程,陈红敬. 人口老龄化对卫生系统的挑战及健康老龄化战略[J]. 中华健康管理学杂志,2013, 7(3):149-150.
[9] 高超,王淑君,于普林. 人口老龄化的现状及发展趋势[J].中华老年医学杂志,2014,33(8):924-926.
[10] 中华医学会老年医学分会,中华老年医学杂志编辑部. 中国健康老年人标准(2013)[J]. 中华老年医学杂志,2013, 32(8):801.
[11] 穆光宗,张团. 我国人口老龄化的发展趋势及其战略应对[J]. 华中师范大学学报(人文社会科学版),2011,50(5):29-36.
[12] 于普林,石婧. 中国老龄化进程及其对社会经济的影响[J]. 中华老年医学杂志,2014,33(2):113-115.
[13] 陆庭勋,徐卫,李建勇. 第13届国际恶性淋巴瘤会议报道-弥漫大B细胞淋巴瘤治疗进展[J]. 中华血液学杂志,2015,36(11):981-983.
[14] Meguro A,Ozaki K,Sato K,et al. Rituximab plus 70% cyclophosphamide,doxorubicin,vincristine and prednisone for Japanese patients with diffuse large B-cell lymphoma aged 70 years and older[J]. Leukemia & lymphoma,2012,53(1):43-49.
[15] 代湘云,吴涛,毛东锋,等. 利妥昔单抗在血液系统疾病中的应用现状[J]. 中华全科医师杂志,2018,17(10):840-842.
[16] 黄海雯,蒋亦彬,付天文,等. 外科手术及利妥昔单抗对原发胃弥漫大B细胞淋巴瘤患者生存的影响[J]. 中华血液学杂志,2016,37(7):602-606.
[17] 徐淑芬,白海,王存邦,等. 利妥昔单抗联合CHOP方案治疗弥漫大B细胞淋巴瘤临床疗效[J]. 现代肿瘤医学,2014,(8):1945-1947.
[18] 王奇璐,刘彦玲. 分子靶向治疗[J]. 中国现代医生,2008,46(14):1-4.
[19] 李江涛,刘辉,范芸,等. 老年初诊弥漫性大B细胞淋巴瘤患者临床特点回顾性分析[J]. 中华老年医学杂志,2016,35(2):201-204.
[20] 甄永苏. 抗体药物靶向治疗肿瘤前景广阔[J]. 中华医学杂志,2009,89(25):1729-1731.
(收稿日期:2020-09-07)
