H2S对Cd胁迫下大麦幼苗逆境生理及光合作用的影响
2020-02-21李晓科武玉珍张谨华张义贤
李晓科 武玉珍 张谨华 张义贤
摘要:【目的】为揭示H2S对Cd胁迫下大麦幼苗生长的胁迫效应规律,探讨H2S提高大麦幼苗耐镉的作用机制,并为大麦种植区镉污染防治提供一定的科学依据。【方法】采用室内水培法,以晋科571大麦品种为研究对象,设置以CdCI,(0.2 mmol.L-1,处理中简称Cd)、外源H2S供体NaHS(50.0 μmol.L-1,处理中简称NaHS)和H2S生成抑制剂羟胺HA(1.0mmol.L-1,处理中简称HA)形成的不同处理组:Cd、NaHS、HA、Cd+NaHS、Cd+HA。测定不同处理组对大麦幼苗生长、叶片损伤、渗透调节物质、抗氧化酶活性、叶绿素含量及光合特性的影响。【结果】与Cd组相比,外源H2S缓解了Cd对幼苗生长的抑制和对叶片的损伤,表现为大麦幼苗根长、苗长、生物量增加,叶片相对电导率、丙二醛( MDA)及超氧阴离子(02-)含量降低;促进了光合作用,表现为叶绿素含量和净光合速率( Pn)、气孔导度(Gs)、蒸腾速率(Tr)增加;提高了大麥幼苗抵抗外界不良环境的能力,表现为渗透调节物质(可溶性糖、脯氨酸、可溶性蛋白)含量和抗氧化酶( SOD、POD、CAT)活性增加。【结论】在外源H2S供体NaHS溶液浓度为50.0 ymol.L-1时,Cd胁迫对大麦幼苗造成的伤害得到了一定程度的缓解,外源H2S能够增强大麦在Cd污染逆境中的适应能力。
关键词:Cd胁迫;外源H2S;大麦;生理指标
中图分类号:X 171.5
文献标志码:A
文章编号:1008-0384( 2020) 10-1131-07
0 引言
【研究意义】随着工业化进程的加速、汽车尾气大量排放以及农药和肥料的大量施用,土壤重金属污染越来越严重。据统计,我国有接近2 000万hrn2的土壤遭受着不同程度的重金属污染,占全国总耕地面积的1/6,其中镉是我国农田土壤重金属污染的主要元素之一[1]。作为植物生长的非必需元素的重金属镉( Cd),易被植物吸收、毒性和富集性强、难降解、具有很强的化学活性,对环境和农业的毒害影响已越来越严重[2]。因此,探索解除或缓解重金属胁迫对作物的伤害机理一直是国内外研究的热点问题,具有非常重要的理论意义和实践价值。【前人研究进展】镉会抑制植物的生长发育,降低根系对必需元素的吸收能力,损伤植物细胞结构和膜透性,抑制酶活性,破坏叶绿素结构,影响氮代谢;植物体内镉的积累,会造成植物代谢紊乱,抗逆性降低,甚至造成植株死亡[3]。近年来的研究发现,气体信号分子H2S在植物中具有重要的生理功能,不仅能够抵抗各种环境胁迫,还能参与调节植物的种子萌发、气孔运动、光合作用等多项生理过程[4-5]。用浓度为1~10μmol.L-1的NaHS溶液(H2S外源供体)预处理,可使镉胁迫下的小白菜根系相对电导率降低,含水量增加,而较高浓度的NaHS和Cd则可对白菜根系造成双重伤害[6]。外施NaHS可显著降低镉胁迫对黄瓜发芽率的抑制作用,不同浓度缓解效果有较大差异,其中浓度为900 μmol.L-1的NaHS处理效果最为显著[7]。对拟南芥施加NaHS后,镉胁迫下拟南芥的根长较单独Cd胁迫处理增加48.94%,根的超氧化物歧化酶( SOD)活性上升13.90%,根的丙二醛( MDA)含量降低63.93%,作为外源H2S的NaHS在一定程度上缓解了Cd对拟南芥根系生长的抑制作用[8]。而外源H2S通过降低NADPH氧化酶活性,使Cd诱导产生的ROS速度减慢,并减少了体内H2O2的积累,从而减轻对谷子幼苗的氧化损伤[9]。此外,H2S也可与其他植物激素及信号分子相互作用,H7S和赤霉素(GA)能提高小麦种子和Cd胁迫下黄瓜种子萌发时β-淀粉酶的活性[4],H2S和Pro协同作用可活化Cd胁迫下谷子幼苗根系ROS清除系统,使ROS和MDA浓度降低,减少谷子根对Cd的吸收,提高植物的Cd耐受性[9];也可与信号分子NO协同作用,显著改善玉米幼苗存活率[4]。【本研究切入点】目前,外源H2S对植物Cd胁迫影响的研究主要集中在植物种子萌发、植物根系生理、H2S与其他植物激素及信号分子相互作用等方面,而关于外源H2S对Cd胁迫下植物幼苗叶片损伤、渗透调节物质、抗氧化酶系及光合特性的影响等方面的研究结果少见报道,并且有关植物对H2S信号分子响应Cd胁迫的生理生化影响的作用机理尚缺乏系统研究。【拟解决的关键问题】本研究以大麦(Hordeum vulgare)为试验材料,采用室内水培法,测定了外源H2S对Cd胁迫下大麦幼苗生长的逆境生理指标和光合特性指标,探究H2S能否减轻Cd胁迫对大麦幼苗的损伤,确定用外源H2S缓解大麦幼苗Cd胁迫损伤的最适使用浓度,探讨外源H2S对提高大麦幼苗耐镉性的作用机制。
1 材料与方法
1.1 试验材料
大麦(晋科571),由山西省农业科学院种子研究所提供。
1.2 试验方法
1.2.1 试验设计 先进行预试验,并确定所需氯化镉( CdC12)溶液、NaHS溶液、HA(羟胺,H2S生成抑制剂)与对照出现显著差异时的最佳浓度,分别为0.2 mmol.L-l的CdC12溶液、50.0 μmol.L-1的NaHS溶液、1.0 mmol.L-1的HA溶液。本试验包括6个处理组,分别为不加CdC12. NaHS和HA的对照组,以CK表示;只加氯化镉的单独Cd组,以Cd表示;只加NaHS的单独NaHS组,以NaHS表示;只加HA的单独HA组,以HA表示;复合处理组2组,分别以Cd+NaHS和Cd+HA表示。3次重复。
1.2.2材料培养与处理 大麦种子培养参照文献[10]的控制条件和方法,H2S采用叶面喷施法,Cd和HA处理分别向培养皿中滴加20 mL的CdC1,溶液和20 mL的HA溶液。复合处理组(NaHS+Cd和HA+Cd)采用NaHS溶液或HA溶液预处理24h,之后向培养皿中加0.2 mmol.L-1的CdC12溶液20 mL处理48h。
1.2.3测定方法 大麦幼苗处理72 h后,测定各项指标。幼苗根长、苗长、生物量的测定参照文献[11];丙二醛( MDA)含量、相对电导率、超氧化物歧化酶( SOD)活性、过氧化物酶(POD)活性、过氧化氢酶( CAT)活性、脯氨酸(Pro)含量、可溶性糖含量、可溶性蛋白质含量、叶绿素含量等的测定参照文献[12];超氧阴离子(O2-)含量的测定参照文献[13];光合速率(Pn)、气孔导度(Gs)、胞间C02浓度(Ci)、蒸腾速率(Tr)采用Li-6400XT便携式光合测定仪测定。
1.2.4 统计方法 试验结果采用SPSS 21.0统计软件分析。
2 结果与分析
2.1 H2S对Cd胁迫下大麦幼苗生长及叶片损伤的影响
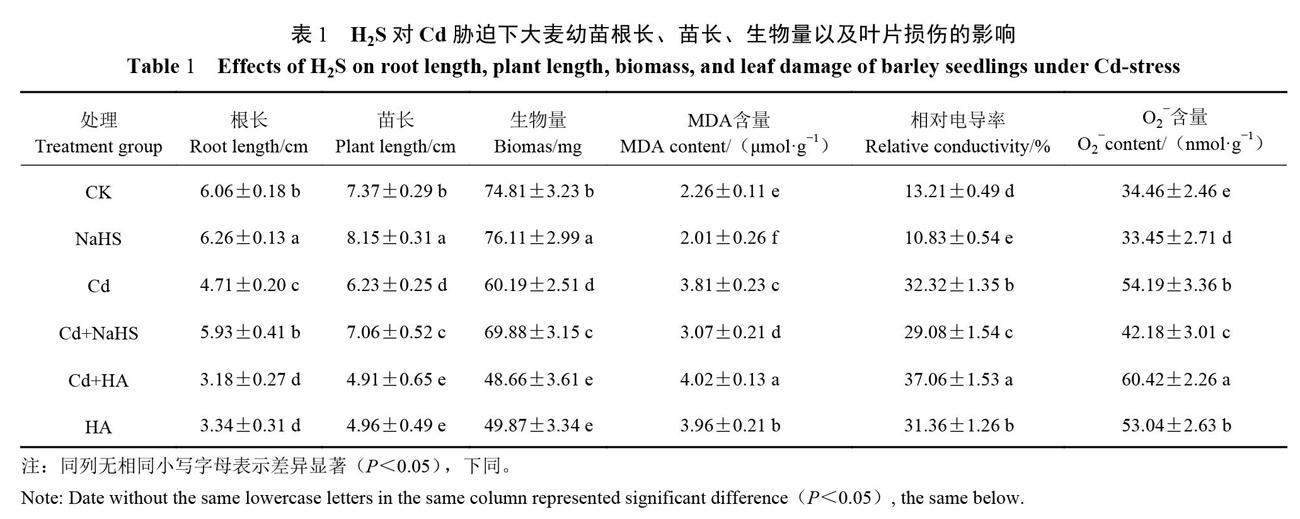
表1表明,大麦幼苗的根长、苗长以及生物量在Cd胁迫下受到了显著抑制,与CK组相比,Cd组上述3项指标分别下降22.28%、15.47%、19.54%,差异均达显著水平(P<0.05)。外源H2S对上述3項指标有显著的促进作用,与CK组相比,NaHS组分别上升3.30%、10.58%、1.74%,差异均达显著水平(P<0.05);Cd+NaHS组的根长(5.93 cm)、苗长( 7.06 cm)及生物量(69.88 mg)均显著高于Cd组(P<0.05),但均低于CK组。表明外源H2S可部分缓解Cd对大麦幼苗的伤害。而HA组的根长( 3.34 cm)、苗长(4.96 cm)及生物量(49.87 mg)均较CK组显著下降(P<0.05),Cd+HA组上述3项指标(根长3.18 cm、苗长4.91 cm、生物量48.66 mg)也均较CK组显著下降(P<0.05),且与单独HA组无差异显著(P>0.05)。
活性氧自由基积累可导致膜脂过氧化损伤,细胞膜透性增加,叶片MDA含量可反映氧化损伤的程度,质膜透性可用相对电导率来衡量[13]。从表1结果可以看出,在单独处理组中,与CK组相比,Cd组的相对电导率、MDA和02-含量分别增加144.66%、68.58%、57.25%,差异均达显著水平(P<0.05);而NaHS组的3项指标均显著降低(P<0.05),分别比CK组下降了18.01%、11.06%、2.93%。在复合处理组中,与Cd组相比,Cd+NaHS组叶片相对电导率(29.08%)、MDA含量(3.07 μmol.g-1)及O2-含量(42.18 nmol.g-1)显著降低,差异均达显著水平(P<0.05);Cd+HA组叶片MDA含量增加5.51%,相对电导率增加14.67%,0,含量增加11.50%,差异均达显著水平(P<0.05)。表明外源H,S能够缓解Cd对膜脂造成的氧化损伤,而HA加Cd可对大麦幼苗叶片细胞膜造成了双重伤害。2.2 H2S对Cd胁迫下大麦幼苗叶片渗透调节物质和抗氧化酶活性的影响
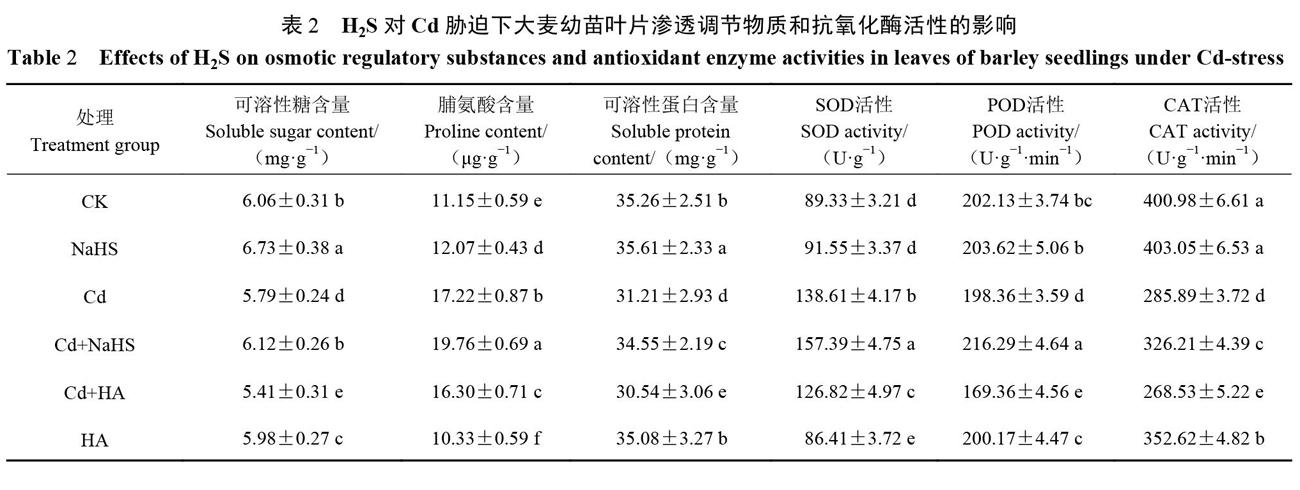
从表2可以看出,在单独处理组中,与CK组相比,Cd组的大麦幼苗叶片可溶性糖含量(5.79 mg.g-1)和可溶性蛋白含量( 31.21 mg.g-l)显著降低(P<0.05),脯氨酸含量(17.22 μg..g-1)显著增加(P<0.05);NaHS组3项渗透调节物质含量(可溶性糖含量6.73 mg.g-1、可溶性蛋白含量35.61 mg.g-1、脯氨酸含量12.07 μg.g-1)均显著增加( P<0.05);HA组的3项指标含量(可溶性糖含量5.98 mg.g-1、可溶性蛋白含量35.08 mg.g-1、脯氨酸含量10.33 μ9.g-1)均下降。在复合处理组中,与Cd组相比,Cd+NaHS的叶片可溶性糖含量、可溶性蛋白含量、脯氨酸含量分别增加5.70%、10.70%、14.75%( P< 0.05),而Cd+HA处理组的3项指标含量分别下降6.56%、2.15%、5.34%( P<0.05)。
在单独处理组中,与CK组相比,Cd组的大麦幼苗叶片POD和CAT活性分别下降1.87%和28.70%,SOD活性升高55.17%;NaHS组的3种抗氧化酶活性均略微增加;HA组的3种抗氧化酶活性均下降,其中CAT活性下降较多,比CK降低了12.06%。在复合处理组中,与Cd组相比,Cd+NaHS组的3种酶活性(SOD 157.39U.g-1、POD216.29U.g-1'mm-1、CAT326.21 U.g-1.min-1)均增加,差异达显著水平(P<0.05);Cd+HA处理组的3种酶活性(SOD 126.82U. g-1、POD169.36U.g-1'mm-1、CAT268.53U.g-1.min-1)均下降。本试验结果表明,外源H2S提高了Cd胁迫下大麦幼苗叶片3种渗透调节物质和3种抗氧化酶活性,有利于维持细胞渗透调节的稳定性,抵御Cd胁迫伤害。
2.3 H2S对Cd胁迫下大麦幼苗叶片叶绿素含量和光合特性的影响
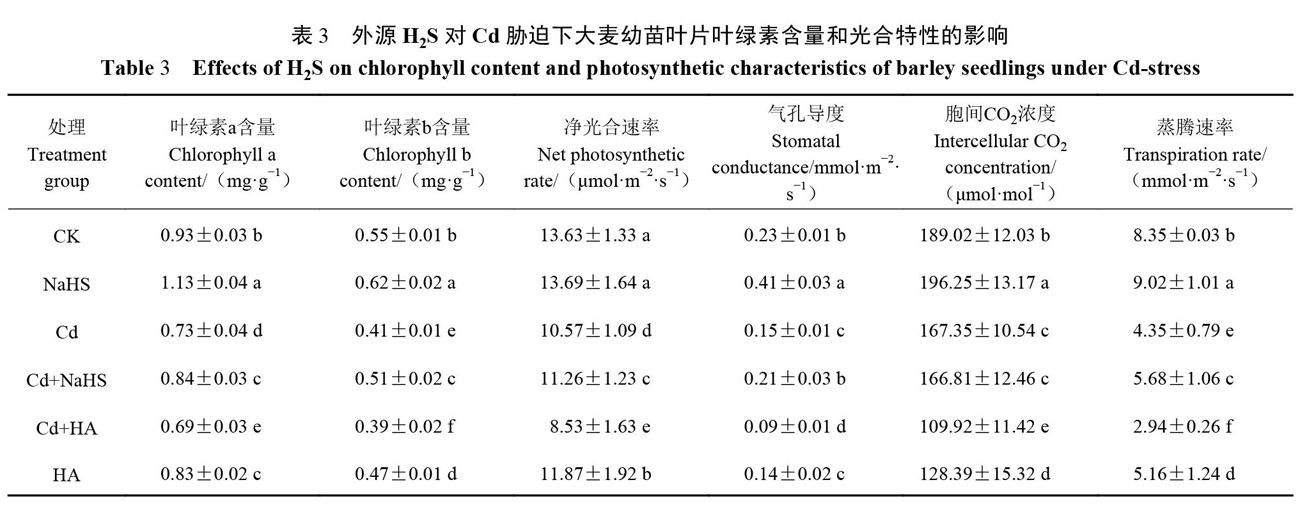
从表3可以看出,单独处理组中,Cd胁迫和H2S生成抑制剂HA可使大麦幼苗叶片叶绿素a、b含量以及净光合速率( Pn)、气孔导度(Gs)、胞间C01( Ci)、蒸腾速率(Tr)相比CK组显著降低,外源H2S对上述指标都有一定的促进作用。在复合处理组中,与Cd组相比,Cd+NaHS组的叶绿素a、b含量分别增加15.07%、24.39%、Pn、Gs、Tr分别上升了6.53%、40%、30.57%;而Cd+HA组的几项光合指标均显著下降。可见,外源H2S能够在一定程度上缓解Cd对大麦幼苗光合作用的伤害。
3 讨论与结论
大量研究表明,非必需元素重金属Cd进入植物细胞后,可破坏细胞膜结构,使活性氧自由基含量增加,导致膜脂过氧化,产生MDA,使细胞有丝分裂速度变慢,根系生长受阻,吸收和利用的矿质元素减少,抑制植物呼吸、光合作用,以及蛋白质合成等,最终导致植株生物量降低[14]。H2S作为植物体内一种气体信号分子,在植物非生物胁迫中起着重要的生理功能,影响植物细胞分裂和发育。它具有改善植物代谢、减轻活性氧ROS的氧化损伤的作用,并可通过调节相关表达基因和蛋白含量,增强植物的抗逆性,从而促进作物的生长和产量的提高[15】。本试验结果显示,在单独处理组中,Cd和HA处理相比CK组均使大麦幼苗生长受到抑制、叶片受到损伤,表现在根长、苗长,生物量下降,相对电导率、MDA及O2-含量增加。说明Cd胁迫可导致大麦幼苗细胞膜受损,膜透性增加,活性氧自由基O2-大量积累,细胞正常代谢受到干扰。在复合处理组中,Cd+HA组加大了对幼苗生长的抑制程度和叶片损伤程度,Cd+NaHS组则在一定程度上缓解了Cd对大麦生长的抑制和叶片损伤。表明外源H2S能够加快植物细胞分裂,降低膜透性,保护细胞膜结构稳定,减少活性氧( ROS)自由基的含量,防止过氧化作用的发生,促进了Cd胁迫下大麦幼苗的生长,从而使大麦植株生物量得到积累。这与张丽萍等[6]在白菜和于立旭等[7]在黄瓜中的研究结果一致。究其原因可能是H2S通过调节半胱氨酸( Cys)代谢相关基因和Mts基因的表达,增加金属硫蛋白和植物螯合肽的含量,降低了Cd在植物中的积累,提高了抗氧化酶活性和自由基清除能力,减轻了氧化伤害,从而缓解Cd胁迫对植物生长的抑制作用[9]。
在植物正常生长过程中会产生伤害植物本身的ROS自由基,植物体内的SOD、POD、CAT等抗氧化酶能够及时清除过多的ROS,从而保护植物免受ROS的伤害。但当植物受到重金属胁迫时,ROS会大量积累,此时抗氧化酶不能及时清除,导致细胞膜脂过氧化,膜透性增加,植物受到伤害[2]。研究表明,H2S处理能够激活植物抗氧化系统,显著增强多种抗氧化酶( SOD、POD、CAT、APX)的活性,提高植物對重金属胁迫的耐受性,缓解逆境对植物造成的伤害[16]。对拟南芥[8]的研究发现,H2S供体NaHS可提升镉胁迫下拟南芥根系CAT、POD、SOD和APX的活性,降低ROS自由基含量,提高拟南芥的抗逆性。Zhang等[17]和Dai等[18]研究表明,外施H2S可通过提高SOD、APX等抗氧化酶活性来缓解Cu胁迫对小麦幼苗的毒害。本试验发现,外源H2S使Cd胁迫下大麦幼苗叶片SOD、POD、CAT活性均有不同程度增加,而使用H2S生成抑制剂的HA处理使上述3种酶的活性降低。究其原因可能是H2S通过调控抗氧化防御系统相关基因MAPK1和MAPK3的表达,激活了抗氧化酶合成的代谢途径,缓解了Cd胁迫对植物的氧化损伤[19]。
重金属胁迫能够破坏植物细胞渗透势,进而影响渗透平衡,但植物体可通过可溶性糖、脯氨酸、可溶性蛋白等渗透调节物质来抵御重金属对植物造成的伤害,保护细胞结构和功能的正常[10,20]。研究表明,外源H2S能使植物通过积累脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质来降低镉对植物生长的抑制[21]。张丽萍等[6]对白菜幼苗根系的研究表明,H2S能够使白菜通过积累脯氨酸和可溶性糖来抵抗渗透胁迫。而本试验中加入H2S后,在Cd胁迫下的大麦幼苗叶片可溶性糖、脯氨酸、可溶性蛋白含量均上升。说明,外源H2S可通过提高渗透调节物质来稳定Cd胁迫下植物根系和叶片细胞渗透压和水分平衡,从而增强植物对渗透胁迫的抵抗力。其中脯氨酸含量提高可能是H2S提高了植物叶片中1.吡咯啉-5-羧酸合成酶(P5CS)的活性所致[22]。
光合作用在植物生长的过程中起着基础性的作用,而叶绿素含量的多少与光合作用强弱有重要的相关性。研究表明,重金属Cd胁迫能抑制叶绿素合成,使叶绿素含量下降,影响叶片净光合速率( Pn),导致胞间CO2( Ci)下降,最终使植物光合作用强度减弱[23_24]。郑州元等[25]研究发现,盐胁迫造成番茄幼苗叶片的叶绿素含量显著下降,喷施NaHS后,叶绿素含量明显升高,并且使番茄幼苗叶片Pn、Gs、Tr显著提升。本试验中,Cd和HA处理均使大麦幼苗叶绿素含量和4种光合特性指标值( Pn、Gs、Tr、Ci)下降,而喷施NaHS后能使Cd胁迫下的大麦幼苗叶绿素含量和Pn、Gs、Tr上升,说明H2S处理能使大麦幼苗叶绿素含量保持一定水平,保护光合系统,缓解Cd胁迫引起的大麦叶绿素的降解和光合强度下降,促进生物量合成,增加植株的苗长、根长和生物量。这与Chen等[26]在水稻上的试验和Ali等[27]在油菜上的试验结果相似。H2S能提高植物叶绿素含量从而调节光合作用,可能是因为外源H2S提高了PSⅡ的光化学活性,使光合酶如PEP羧化酶、RuBP羧化酶活性上升,增强了光合电子向电子受体( QA、QB)及质体醌(PQ)的传递,从而改变了光系统的运转效率。也可能是H2S能够抑制Cd2+向细胞内流动,并将吸收的Cd2+转运至液泡,降低体内Cd2+的浓度,同时增加外排的方式,使植物叶片和根中的Cd含量下降,从而减少对植物生长的影响。 综上所述,喷施NaHS缓解了重金属Cd对大麦幼苗根长、苗长、生物量、叶绿素含量和光合能力( Pn、Gs、Tr)的抑制作用,促进了光合作用和幼苗生长。外源H2S通过增加Cd胁迫下植物叶片叶绿素含量,增强光合作用速率,激活植物体内的抗氧化酶系统,清除O2自由基,提高渗透调节物质含量,降低膜脂过氧化程度,维持正常细胞膜透性,从而促进植物生长,增强大麦幼苗在Cd污染逆境中的适应能力。
参考文献:
[1]叶仙勇,沈磊.我国土壤环境污染的现状分析与防治措施[J].资源节约与环保,2016,38 (4):178-180.
YE X Y,SHEN L Analysis of the present situation of soilenvironmental pollution in China and its prevention and controlmeasures EJl.Resources Economization&Environment Protection,2016. 38 (4): 178-180. (in Chinese)
[2] 何俊瑜,任艷芳,王阳阳,等.不同耐性水稻幼苗根系对镉胁迫的形态及生理响应[J].生态学报,2011。31 (2):522-528.
HE J Y,REN Y F,WANG Y Y,et al.Root morphological andphysiological responses of rice seedlings with different tolerance tocadmium stress EJl.Acta Ecologica Sinica,201 1,31 (2):522528.(in Chinese)
[3] 闫晶,姬文秀,石贤吉,等,镉胁迫对烟草种子萌发和烟苗生长发育的影响[J].作物学报,2019. 45 (2):142-149.
YAN J, JI W X. SHI X J,et al.Effects of cadmium stress on seedgermination and seedling gro.Arth of tobacco [J].Acta AgronomicaSinica. 2019. 45 (2): 142-149. (in Chinese)
[4] 田雲,蒋景龙,李丽,等,信号分子硫化氢调控植物抗逆性研究进展[J].核农学报,2017. 31( 11):2279-2281.
TIAN Y, JIANG J L,LI L,et al.Research advances in plant stressresistance regulated by signal molecule hydrogen sulfide [J]. Journalof Nuclear Agricultural Sciences, 2017, 31 (11):2279-2281. (inChinese)[5] LI Z G,MIN X, ZHOU Z H.Hydrogen Sulfide:A si~al molecule inplant cross-adaptation EJl.Frontiers in Plant Science. 2016,7 (42):1621.
[6] 张丽萍,刘志强,金竹萍,等.H2S对镉胁迫下白菜幼苗根系渗透胁迫的调节作用[J].农业环境科学学报,2016, 35 (2):247-252.
ZHANG L P,LIU Z Q,JIN Z P,et aL Regulation of H2S on Cd-induced osmotic stress in roots of Chinese cabbage seedling [J].Journal of Agro-Environment Science. 2016, 35 (2):247-252. (inChinese)
[7] 于立旭,尚宏芹,张存家,等.外源硫化氢对镉胁迫下黄瓜胚轴和胚根生理生化特性的影响[J].园艺学报,2011, 38( 11):2131-2139.
YU L X. SHANG H Q,ZHANG C J,et al. Effects of exogenous H2S on the physiological and biochemical characteristics of the cucumber hypocotyls and radicles under cadmium stress [J].Acta HorticulturaeSinica, 2011, 38( 11): 2131-2139. (in Chinese)
[8] 贾红磊,刘珂娜,刘洋,等,硫化氢在缓解拟南芥镉胁迫中的作用[J].陕西科技大学学报,2018, 36 (5):23-27.
JIA H L,LIU K N, LIU Y, et al.Effect of hydrogen sulfide onreducing cadmium stress in Arabidopsis thaliana EJl. Journal ofShanxi University of Science&Technology, 2018, 36 (5):23-27.(in Chinese)
[9] 田保华,硫化氢信号在谷子响应镉胁迫中的生理作用[D].太原:山西大学,2016.
TIAN BH. Physiological effects of hydrogen sulfide signal onresponse of millet to cadmium stress [D]. Taiyuan: Shanxi University,2016. (in Chinese).
[10]张义贤,李晓科.镉、铅及其复合污染对大麦幼苗部分生理指标的影响[J].植物研究,2008, 28 (1):43-46.
ZHANG Y X, LI X K. Effects of Cd, Pb and their combined pollutionon physiological indexes in leaf of the Hordeum vulgare seedling EJlBulletin ofBotanical Research, 2008. 28(1):43-46.( in Chinese)
[11]肖志华,张义贤,张喜文,等.外源铅、铜胁迫对不同基因型谷子幼苗生理生态特性的影响[J].生态学报,2012. 32 (3):889897.
XIAO Z H. ZHANG Y X, ZHANG X W, et al.Effects of exogenousPb and Cu stress on eco-physiological characteristics on foxtail milletseedlings of different genotypes EJl. Acta Ecologica Sinica,2012,32 (3): 889897. (in Chinese)
[12]李合生,植物生理生化实验原理和技术[M].北京:高等教育出版社。2000: 184-185, 258-261.
[13] XIE z, DUAN L, TIAN X. et al. Coronatine alleviates salinity stress incotton by improving the antioxidative defense system and radical-scavenging activity[J]。Journal of Plant Physiology,2008,l65(4): 375—384.
[14]王晓娟,王文斌,杨龙吴,等,重金属镉(Cd)在植物体内的转运途径及其调控机制[J].生态学报,2015,35(23):792卜7929.
WANG X J,WANG W B,YANG L W,et al.TranSpOrt pathWayS Ofcadmium(Cd)and its regulatory mecbanisms in plam[J].ActaEcologica Sinica,2015,35(23):7921—7929.(in Chinese)
[15]zHANG H,HAO J,JIANG C x,et al.Hdrogen sulfide protectssoybean seedlings against drought-induced oxidative stress[J].ActaPhysiologia Planarum,2010(32):849—857.
[16]MOSTOFA M G,RAHMAN A,ANSARY M M,et al.Hydrogensumde modulates cadmium-induced physi010-gical and biochemicalresponses to alleviate cadmium toxicity in rice[J].Sci Rep,,2014,5:14078.
[17]ZHANG H,HU L Y,HU K D,et al.Hydrogen sulfide promotes wheatSeed gerrmination and alleviateS Oxidative damage againSt C0pperstress[J] Journal of Integrative Plant Biology,2008,50(12):1518—1529.
[18]DAIHF,XUY J,ZHAO L F,et al.Alleviation ofcoppertoxicity onchloroplast antioxidant capacity and photosystem II photochemistry ofwheat by hydmgen sumde[J] Brazilian Journal of Botany,2016,39(2):787—793.
[19]金竹萍,裴雁曦.植物H2S气体信号分子的生理功能研究进展[J].中国细胞生物学学报,2013,35(6):880一888.
JIN Z P,PEI Y X.ReSearCh PrOgrcSS On Hydrogen SUmde Signalingin Plants[J] Chinese journal of cell biology,2013,35(6):880一888.(in Chinese)
[20]张义贤,付亚萍,肖志华,等,铅胁迫对不同基因型谷子幼苗生理特性及基因组DNA多态性的影响[J].农业环境科学学报,2013,32(3):478—484.
ZHANG Y X,FU Y P,XIAO Z H,et al.Efbcts ofPb2-stress onphysi0109ical characteristicsand DNA polymorphism of genome indifferent genotypes foxtail millet[J].Journal of Agro-EnvironmentScience.2013.32(3):478—484.(in Chinese)
[21]ZHANG H,YU L Y,LI P,et al.Hydmgen sulfide alleviatedcllromium toxicity in wheat[J]。Biologia Plantarum,2014,54(4):743—747.
[22]李永生,方永豐,李玥,等.外源硫化氢对PEG模拟干旱胁迫下玉米种子萌发及幼苗生长的影响[J].核农学报,2016,30(4):813-821.
LI Y S,FANG Y F,LI Y,et al.EffeCtS Of ExogenouS HydrogenSumde on Seed Gemination and Seedling Growth Under PEGStimulated Dmu曲t Stress in Maize[J].Journal of NuclearAgricultural Sciences ,2016,30(4):813 821(in Chinese)
[23]张杰,马晓寒,陈彪.外源硫化氢对干旱胁迫下烟草幼苗生理生化特性的影响[J].中国农业科技导报,2018,20(11):112—119.
ZHANG J,MA X H,CHEN B.EffbCtS Of exOgenOuS hydrogen Sulfldeon physi0109ical andbiochemical characteristics of tobacco seedlingsllnder drought stress[J], Journal of Agricultural Science andTechnology,2018,20(1 1):112—119.(in Chinese)
[24]郑爱珍,镉胁迫对芥蓝根系质膜过氧化及ATPase活性的影响[J].
作者简介:李晓科(1979-),男,硕士,讲师,主要从事植物生理生态方面研究(E-mail: jzxylixiaoke@163.com)
