凋亡细胞调控巨噬细胞表达IL-12家族细胞因子的水平
2020-02-21刘冰慧龚志平梅艳芳钱雪松
刘冰慧,龚志平,梅艳芳,杨 涛,冯 军,钱雪松
(1.河北省承德市中心医院检验科,河北 承德 067000;2.河北医科大学基础医学院免疫学教研室,河北 石家庄 050017)
单核吞噬细胞系统负责吞噬大量的凋亡细胞,避免凋亡细胞的有害成分暴露于周围组织环境中,形成潜在的细胞毒性成分、免疫原或者诱发炎性反应的因子,这是机体维持免疫稳态的重要功能。机体维持内环境的稳定、控制炎症的方式不仅包括快速有效地识别清除凋亡细胞,还包括吞噬细胞主动分泌多种促炎因子和抑炎因子并对细胞因子含量进行调控等方式。巨噬细胞吞噬凋亡细胞的同时其表达和分泌的细胞因子也会受到影响,如凋亡细胞正向调节巨噬细胞的白细胞介素 (interleukin,IL)-10和负向调节IL-12表达[1]。IL-12家族细胞因子包括IL-12、IL-23、IL-27及IL-35,均是由2个亚基组成的异源二聚体,其中IL-12由p35和p40亚基组成,IL-23由p19和p40亚基组成,IL-12与IL-23共用p40亚单位[2]。IL-12家族细胞因子主要由人体组织中活化的巨噬细胞等抗原提呈细胞产生,IL-12能诱导Th1细胞分化,刺激T细胞、自然杀伤细胞产生干扰素γ,增强自然杀伤细胞活性。IL-23的效应是对记忆性的T细胞繁殖进行诱导,从而加速干扰素γ产生。研究在凋亡细胞过量存在的情况下,观察巨噬细胞受刺激被激活表达IL-12家族细胞因子的变化,同时比较凋亡细胞对一些抑炎性细胞因子的影响,旨在为进一步研究其机制及临床应用奠定基础。
1 材料与方法
1.1实验动物和材料 SPF级C57BL/6小鼠4只,雌雄各半,6~8周龄,体重25~30 g,饲养于河北省实验动物中心(不限食物与水摄入),动物许可号为B00005887∶1。人外周白血病T 细胞(Jurkat 细胞)和小鼠巨噬细胞系RAW264.7(RAW 细胞)购自中国医科院细胞中心。
1.2主要试剂及药物 RNAiso Plus提取试剂、SYBR Premix Ex TaqTMⅡ试剂盒(TaKaRa公司),ReverAid首链cDNA合成试剂盒(Fermentas Inc.),Real-Time PCR引物(上海生工合成),DMEM(高糖)培养基、PBS(Gibco BRL公司),胎牛血清(fatal bovine serun,FBS)(ExCell Biology公司),胰酶、脂多糖(lipopolysaccharides,LPS)(美国Sigma公司),二甲基亚砜(天津市化学试剂厂),青霉素、链霉素(华北制药公司),羊抗鼠IgG-HRP(北京中杉金桥生物公司),DEPC(Promega公司),β-actin Rabbit Ab (北京赛诺博生物技术中心),细胞培养板(Costoor公司),IL-10、前列腺素E2(prostaglandin E2,PGE2)和转化生长因子β(transforming growth factor-β,TGF-β)试剂盒(深圳市亚辉龙生物科技有限公司)。
1.3细胞培养
1.3.1细胞复苏方法 从液氮贮存罐保存的细胞中选择所需细胞,置在37 ℃水浴箱快速解冻。充分混合均匀后以1 000 r/min离心5 min,弃上清液,应用含量为10%的DMEM培养液将细胞沉淀悬起,并接种在培养瓶中,在37 ℃、5%CO2环境的孵育箱中进行培养,第2天记录观察细胞存活情况和贴壁情况,并换置DMEM培养液。
1.3.2细胞传代方法 当细胞量足够覆盖培养瓶90%以上面积时,倒掉培养液,用PBS清洗,0.25%胰酶1 mL加入培养瓶消化约4 min,用倒置显微镜观察细胞形态,细胞肿大排列松散即可停止消化,弃掉含消化酶的培养液,再加入10%DMEM培养液制成细胞悬液,取1/4细胞悬液接种到另一个培养瓶,以3 d为1个周期进行传代。
1.3.3收集小鼠腹腔巨噬细胞 选取C57BL/6小鼠每只经腹腔注射1 mg 3%巯基乙酸盐,3 d后处死小鼠并向腹腔内注射10 mL无菌PBS灌注清洗,抽取腹腔灌洗液,用细胞培养液洗涤悬浮小鼠腹腔巨噬细胞,将其接种并培养在培养板里。
1.3.4制备凋亡Jurkat细胞 应用Annexin-V-Biotin凋亡检测试剂盒,方法严格按照说明书进行。促凋亡药物使用staurosporine,用流式细胞检测仪测定细胞凋亡情况,将数据图像保留记载。
1.4分组激活巨噬细胞
1.4.1分组刺激RAW264.7细胞 解冻复苏RAW264.7细胞在6孔板中孵育(2×106/孔),细胞贴壁更换用无血清的DMEM培养过夜。弃培养液后重新各加入2 mL无血清DMEM,分别加入空白(Med)、LPS(1 mg/L)、apo(1×106/孔)和LPS(1 mg/L)+apo作用RAW264.7细胞6 h,PBS洗涤细胞3次后,收集细胞提取RNA。24 h后收集上清液用于ELISA检测。
1.4.2分组刺激小鼠腹腔巨噬细胞 培养后的小鼠腹腔巨噬细胞大约为1×106/mL,将细胞培养液换成无血清DMEM,分别以LPS(1 mg/L)、apo和LPS+apo作用小鼠腹腔巨噬细胞6 h后,用PBS洗涤细胞3次后,收集细胞提取RNA。
1.5SYBR Green荧光染料法Real-time PCR检测细胞因子mRNA表达 用Trizol 试剂提取各组细胞总RNA,逆转录合成cDNA。根据美国生物技术信息中心发布的小鼠IL-12p35、IL-12p40、IL-23p19基因序列,借助primer 5.0,自基因序列的外显子中分别设计2条引物以检测各细胞因子mRNA表达水平。mouse p19 cDNA:sense,5′-TGCACCAGC-GGGACATATGAATCT-3′;antisense,5-TGTT-GTCCTTGAGTCCTTGTGGGT-3。mouse p35 cDNA:sense,5-ACCTGCTGAAGACCACAGAT-GACA-3;antisense,5-TAGCCAGGCAACTCTCG-TTCTTGT-3。mouse p40 cDNA:sense,5-ACCT-GTGACACGCCTGAAGAAGAT-3;antisense,5-TCTTGTGGAGCAGCAGATGTGAGT-3。以cDNA为模板进行PCR扩增,反应条件为:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火30 s,共40个循环;72 ℃再延伸7 min。用 2-△△Ct法分析所得real-time PCR数据。
1.6IL-10、PGE2和TGF-β浓度检测 取Med、LPS、LPS+apo组细胞上清液,根据ELISA法检测IL-10、PGE2、TGF-β浓度,严格按试剂盒说明书操作。绘制校准品OD值与标示浓度的关系曲线,由样本OD值计算对应的IL-10、PGE2和TGF-β浓度。
1.7统计学方法 应用SPSS 18.1统计软件分析数据。计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1LPS和凋亡细胞对RAW细胞或小鼠腹腔巨噬细胞表达IL-12p35、IL-12p40、IL-23p19 mRNA的影响 RAW细胞和小鼠腹腔巨噬细胞表达IL-12p35、IL-12p40、IL-23p19 mRNA的水平,单独apo刺激组只表现出基础表达量,LPS刺激组明显升高且高于LPS+apo组(P<0.05),见表1,2。
活化后2种细胞表达IL-12p35、IL-12p40、IL-23p19 mRNA的变化趋势相似。

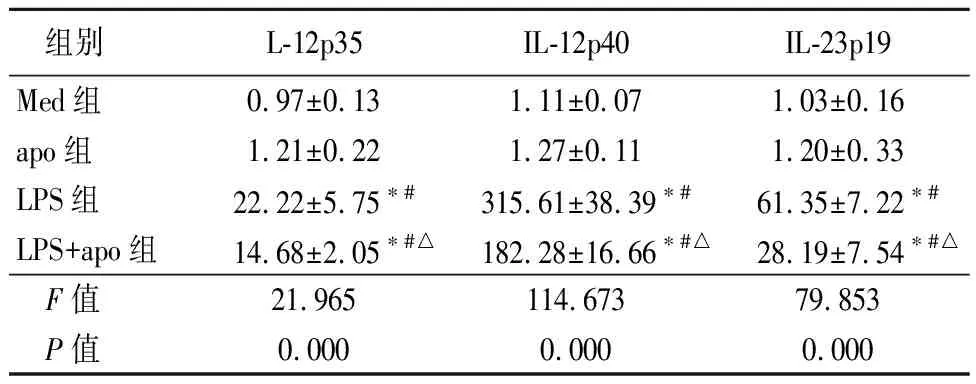
组别L-12p35IL-12p40IL-23p19Med组0.97±0.131.11±0.071.03±0.16apo组1.21±0.221.27±0.111.20±0.33LPS组22.22±5.75∗#315.61±38.39∗#61.35±7.22∗#LPS+apo组14.68±2.05∗#△182.28±16.66∗#△28.19±7.54∗#△F值21.965114.67379.853P值0.0000.0000.000
*P值<0.05与Med组比较 #P值<0.05与apo组比较 △P值<0.05与LPS组比较(SNK-q检验)

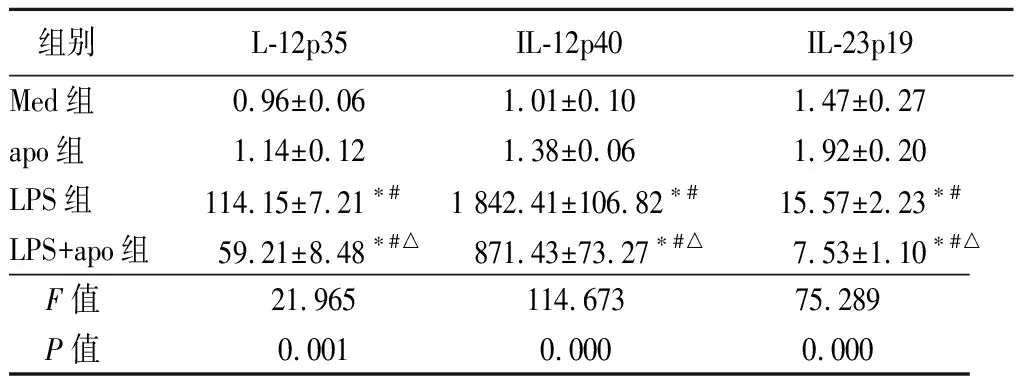
组别L-12p35IL-12p40IL-23p19Med组0.96±0.061.01±0.101.47±0.27apo组1.14±0.121.38±0.061.92±0.20LPS组114.15±7.21∗#1 842.41±106.82∗#15.57±2.23∗#LPS+apo组59.21±8.48∗#△871.43±73.27∗#△7.53±1.10∗#△F值21.965114.67375.289P值0.0010.0000.000
*P值<0.05与Med组比较 #P值<0.05与apo组比较 △P值<0.05与LPS组比较(SNK-q检验)
2.2LPS和apo对RAW细胞分泌IL-10、PGE2、TGF-β浓度的影响 LPS组IL-10、PGE2、TGF-β浓度高于Med组,LPS+apo组TGF-β浓度高于Med组和LPS组,差异有统计学意义(P<0.05);LPS组和LPS+apo组IL-10、PGE2浓度差异无统计学意义(P>0.05)。见表3。
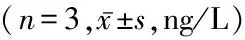
组别IL-10PGE2TGF-βMed组52.59±10.2443.42±8.4619.55±4.15LPS组275.77±10.66∗1 442.39±145.55∗73.24±9.90∗LPS+apo组278.20±9.28∗1 485.07±201.05∗179.23±15.45∗#F值100.617.98642.116P值0.0000.0050.001
*P值<0.05与Med组比较 #P值<0.05与LPS组比较(SNK-q检验)
3 讨 论
细胞凋亡是多细胞生物为维持机体内环境稳定由基因调控的细胞主动死亡过程。当细胞生长到逐渐老化、发育特征异常、有害成分暴露等情况时,其会发出凋亡信号激活吞噬细胞系统,最终被吞噬、消化、吸收。此过程对于维持机体稳态、避免炎症反应发生和组织过度增生至关重要。细胞凋亡过程及吞噬细胞吞噬消化凋亡细胞的过程中出现任何异常,均会与某些疾病的发生发展相关,如系统性红斑狼疮患者的皮肤经紫外线照射后,会出现凋亡细胞大量堆积,其淋巴结和血液中的凋亡细胞也逐渐增多[3-4];急性髓系白血病患者和慢性粒性细胞白血病患者体内的肿瘤细胞异常高表达“Don′t eat me”信号躲避吞噬细胞的识别[5]。研究细胞凋亡清除机制、凋亡细胞清除障碍导致疾病发生发展的机制,可以为开发新的疾病治疗途径和药物提供分子学理论基础。
细胞凋亡时发出“Eat me”信号可被吞噬细胞识别,这种信号主要以细胞膜结构或成分改变表现的,包括细胞膜内层磷脂酰丝氨酸翻转暴露于细胞膜外层[6-7]、细胞间黏附分子3(intercellular adhesion molecule-3,ICAM-3)[8-9]和ICAM-1[10-11]异常表达以及钙网蛋白暴露与重新分布[12-13]等形式,其中磷脂酰丝氨酸外翻被认为是最明确的“Eat me”信号。巨噬细胞快读准确识别凋亡细胞发出的“Eat me”,通过巨噬细胞吞噬受体结合凋亡细胞相关配体的方式开启吞噬过程[14-15]。实验以凋亡细胞作为影响因素,某些疾病的某些时期机体组织中凋亡细胞逐渐增多,巨噬细胞被活化、识别、吞噬、分解凋亡细胞的过程中,表达和分泌的细胞因子发生变化,其中包括代表促炎因子IL-12家族的IL-12、IL-23,通过检测p35、p40和p19亚基分析IL-12、IL-23表达量的变化,还有代表抑炎因子的IL-10、PGE2和TGF-β的变化。促炎/抑炎因子表达失衡是很多疾病发生发展的分子基础。
本研究使用小鼠腹腔巨噬细胞和RAW264.7细胞,腹腔巨噬细胞更接近人类原代细胞,更能代表人体内的情况。刺激因子使用LPS,LPS是存在于革兰阴性菌细胞壁的内毒素成分,可以通过刺激巨噬细胞等炎症效应细胞产生炎性因子或者直接导致靶细胞损伤,激活全身炎症反应。结果显示凋亡细胞抑制了LPS诱导的巨噬细胞表达IL-12p35、IL-12p40、IL-23p19 mRNA水平,凋亡细胞对IL-10和PGE2无影响,但促进TGF-β分泌。说明炎症发生时体内产生大量凋亡细胞,凋亡细胞反过来可以适当抑制一些促炎因子的表达,促进部分抑炎因子分泌,起到了维持促炎/抑炎因子平衡的作用。并且发现,不同刺激因素作用于2种巨噬细胞,细胞因子表达变化情况无明显差异,故在后续研究过程中,能够使用更加易得的RAW264.7细胞。
吞噬细胞包括了组织中可以在一定范围内移动的巨噬细胞和循环系统中招募的吞噬细胞。机体各组织新陈代谢产生的凋亡细胞释放“Eat me”趋化因子吸引邻近巨噬细胞,吞噬可能是巨噬细胞吞噬整个凋亡细胞后胞内分解消化,也可能先将凋亡细胞分解为小碎片再吞噬[16-17]。但吞噬作用均不会影响周围的正常组织细胞,可能是因为正常数量的凋亡细胞诱导吞噬分解,不启动免疫反应,但在某些病理状态下,如炎症、肿瘤、自身免疫病等大量凋亡细胞产生时,会负向调节IL-12家族等促炎因子,并促进TGF-β等抑炎因子分泌,发挥了维持细胞因子平衡的作用。妇科肿瘤患者肿瘤细胞生长迅速,凋亡的肿瘤细胞增多,血清中TGF-β含量明显高于非肿瘤患者,而化疗后随着肿瘤细胞减少,血清TGF-β减低[18]。当然,这种作用力度有多大?这种调节作用是如何作用于巨噬细胞的?影响了哪些细胞传导通路?均需要进一步研究。细化作用机制、明确作用途径可以为很多疾病的基因靶向治疗提供分子基础。
