木犀草素与白藜芦醇联合应用对人肝癌细胞凋亡的影响及机制
2020-02-21乐炜王超邓波章永
乐炜,王超,邓波,章永
咸宁市中心医院,湖北咸宁437000
肝癌发病率在癌症中排名第六,致死率排名第三[1]。据报道,全球每年肝癌死亡患者超过70万人,其中约50%发生在中国,严重危害了我国公民的身体健康[2]。手术切除和化疗是临床治疗肝癌的主要手段,但由于肝癌局部复发转移、耐药性及化疗药物的不良反应严重影响了疗效[3]。因此寻找安全有效的抗肿瘤药物及治疗方案是目前研究的重点。研究显示,木犀草素(Lut)具有抗炎、抗氧化、心血管保护等作用[4~6],且Lut也是一种有效的肿瘤防治剂,对肝癌、乳腺癌和结肠癌均有显著抑制作用[5,7]。白藜芦醇(Res)是一种普遍存在于藜芦、葡萄和花生等植物中的非黄酮类多酚化合物,具有心血管保护和改善代谢的作用[8,9],其通过作用于不同的信号通路,对前列腺癌、乳腺癌、肺癌等癌症发挥抑制作用,具有较好的抗肿瘤活性[10]。Lut和Res对细胞内过度激活的核因子κB(NF-κB)均有抑制作用,但Lut和Res是否通过抑制NF-κB表达发挥抑制肝癌的作用,目前鲜见报道。2018年7月~2019年2月,本研究对此做了探讨。
1 材料与方法
1.1 材料 人肝癌细胞(HepG2)、人正常肝细胞(LO2)分别购自北京协和细胞库、中科院上海细胞库。Res(溶于DMSO,母液浓度为50 mmol/L)购自美国Sigma公司;Lut(溶于DMSO,母液浓度为40 mmol/L) 购自美国MCE公司;索拉非尼购自美国Adooq公司;MTT和DAPI购自上海Beyotime公司;FBS和DMEM培养基购自美国Hyclone公司;DMSO购自美国Thermo公司;RT-PCR试剂盒购自日本TaKaRa公司;NF-κB、磷酸化NF-κB(p-NF-κB)、B细胞淋巴瘤/白血病-2基因(Bcl-2)、Bcl-2联接X蛋白(Bax)、半胱氨酸蛋白酶3(Caspase-3)抗体购自美国Cell Signaling Technology公司;β-actin和GAPDH购自英国Abcam公司;ECL购自美国Pierce公司。
1.2 HepG2、LO2细胞培养 HepG2、LO2细胞培养于含10% FBS和双抗的DMEM完全培养基中,培养条件为37 ℃、5% CO2的饱和湿度培养箱。根据细胞生长情况定时换液和传代。
1.3 药物处理 将生长状态良好且处于对数生长期的HepG2、LO2细胞以1×105/mL接种于96孔板、24孔板、6孔板和T25细胞瓶中,待细胞生长融合至60%~80%,将培养基更换为含(终浓度0、5、10、20 μmol/L)Lut、(0、12.5、25、50 μmol/L)Res及5 μmol/L Lut+12.5 μmol/L Res、5 μmol/L Lut+25 μmol/L Res、5 μmol/L Lut+50 μmol/L Res、10 μmol/L Lut+12.5 μmol/L Res、10 μmol/L Lut+25 μmol/L Res、10 μmol/L Lut+50 μmol/L Res、20 μmol/L Lut+12.5 μmol/L Res、20 μmol/L Lut+25 μmol/L Res、20 μmol/L Lut+50 μmol/L Res、10 μmol/L索拉非尼的无血清DMEM培养基,继续培养24 h。
1.4 细胞活力检测 采用MTT实验。药物处理结束后,于96孔板中每孔加入浓度为5 mg/mL的MTT母液10 μL,37 ℃培养箱孵育4 h,酶标仪测定490 nm波长处的吸光度(OD)值,用空白孔校准。计算细胞相对存活率,细胞相对存活率=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
1.5 细胞形态观察 取对数生长期的HepG2、LO2细胞,以1×105/mL的接种于6孔板中,细胞生长融合80%时,分别给予20 μmol/L Lut、25 μmol/L Res、20 μmol/L Lut+25 μmol/L Res处理24 h。于倒置显微镜下观察细胞的生长及形态变化。
1.6 细胞凋亡检测 采用DAPI染色法。取对数生长期的HepG2、LO2细胞,以1×105/mL的接种于6孔板中,细胞生长至融合80%时,分别给予20 μmol/L Lut、25 μmol/L Res、20 μmol/L Lut+25 μmol/L Res处理24 h。药物处理结束后,吸去培养基,PBS洗涤5 min×3次,4%多聚甲醛室温固定15 mim,PBS洗涤5 min×3次,DAPI室温染色5 min,PBS洗5 min×3次,洗涤结束后,Zeiss倒置荧光显微镜观察细胞核形态变化。
1.7 NF-κB入核情况观察 采用免疫荧光实验。药物处理结束后,吸去培养基,PBS洗涤5 min×3次,4%多聚甲醛室温固定15 mim,PBS洗涤5 min ×3次,0.5% Triton X-100室温透膜3~5 min,PBS洗5 min×3次,5%牛血清白蛋白(BSA)室温封闭1 h,一抗4 ℃孵育过夜,PBS洗5 min ×3次,Alexa Fluor 594标记的荧光二抗室温孵育1 h,PBS洗5 min×3次,DAPI室温复染5 min,PBS洗5 min×3次,洗涤结束后,用眼科弯镊轻轻将孔板内爬片取出,抗荧光淬灭剂和指甲油封固,OLYMPUS正置荧光显微镜拍照,观察NF-κB的入核情况。
1.8 细胞内NF-κB及凋亡相关蛋白(Bcl-2、Bax、Caspase-3)表达检测 采用Western blotting法。药物处理结束后,收集细胞,RIPA强裂解液冰上裂解30 min,4 ℃ 12 000 r/min离心15 min,吸取上清液,BCA法测定样本中蛋白含量。用10% SDS-聚丙烯酰胺凝胶电泳分离蛋白,将蛋白电转移至硝酸纤维素膜上,5%BSA室温封闭2 h,一抗4 ℃孵育过夜,TBST洗5 min×3次,辣根过氧化物酶标记二抗,室温孵育2 h,TBST洗5 min×3次,用ECL显色液显色。用Image J进行半定量分析。蛋白相对表达量=目的蛋白电泳条带灰度值/内参蛋白电泳条带灰度值。
1.9 细胞内凋亡相关蛋白(Bcl-2、Bax、Caspase-3)mRNA表达检测 采用qRT-PCR技术。药物处理结束后,收集细胞,用TRIzol(Invitrogen公司,美国)提取细胞总RNA,NanoDrop 1000测定RNA浓度(A260/A280为1.8~2.0),逆转录参照TaKaRa RT-PCR说明书进行操作。RT-PCR引物序列由Invitrogen公司设计合成,NF-κB上游引物序列5′-CTGTCTTGTGGACAACGCAGTGGAATTTTAGG-3′,下游引物序列5′-CACTTATGGACAACTATGAGGTCTCTGG-3′;Bcl-2上游引物序列5′-CAGATGCCGGTTCAGGTACTCAGTC-3′,下游引物序列5′-CTCGTCGCTACCGTCGTGACTTGG-3′;Bax上游引物序列5′-CAGATGCCGGTTCAGGTACTCAGTC-3′,下游引物序列5′-AAGCTGAGCGAGTGTCTCCGGCG-3′;Caspase-3上游引物序列5′-GCATACTGTTTCAGCATGGCA-3′,下游引物序列5′-CAAACTTTTTCAGAGGGGATCG-3′;GAPDH上游引物序列5′-AGCCTTCTCCATGGTCGTGA-3′,下游引物序列5′-CGGAGTCAACGGATTTGGTC-3。使用SYBR Premix Ex Taq(TaKaRa)试剂盒进行RT-PCR反应,反应体系10 μL(cDNA 2 μL、引物3 μL、SYBR 5 μL),反应条件:95 ℃ 30 s预变性,95 ℃ 4 s、60 ℃ 30 s,循环40次。以GAPDH作为内参。目标基因相对表达量用2-ΔΔCt法计算。
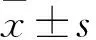
2 结果
2.1 Lut、Res对HepG2、LO2细胞活力的影响 0、5、10、20 μmol/L Lut处理后HepG2细胞相对存活率分别为(100.00±4.05)%、(93.50±4.23)%、(88.33±4.84)%、(79.00±6.20)%,LO2细胞相对存活率分别为(100.00±4.94)%、(99.17±7.11)%、(97.17±3.13)%、(96.00±5.83)%;0、12.5、25、50 μmol/L Res处理后HepG2细胞相对存活率分别为(100.00±4.05)%、(93.17±6.18)%、(84.33±6.06)%、(73.83±4.88)%,LO2细胞相对存活率分别为(98.83±4.02)%、(96.67±3.88)%、(96.93±4.96)%;5 μmol/L Lut+12.5、25、50 μmol/L Res处理后HepG2细胞相对存活率分别为(80.33±5.50)%、(74.67±4.89)%、(66.83±5.56)%,LO2细胞相对存活率分别为(96.67±4.50)%、(95.46±4.73)%、(97.67±3.88)%;10 μmol/L+12.5、25、50 μmol/L Res处理后HepG2细胞相对存活率分别为(78.33±5.39)%、(68.17±7.22)%、(60.17±3.31)%,LO2细胞相对存活率分别为(96.83±4.54)%、(95.67± 4.37)%、(98.66±7.20)%;20 μmol/L Lut+12.5、25、50 μmol/L Res处理后HepG2细胞相对存活率分别为(75.17±5.00)%、(45.83±4.92)%、(47.17±6.31)%,LO2细胞相对存活率分别为(95.33±5.68)%、(95.31±4.73)%、(95.67±4.18)%。索拉非尼处理后HepG2、LO2细胞相对存活率分别为(49.33±6.12)%、(76.34±7.17)%。与未处理的细胞相比,分别经10、20 μmol/L Lut及25、50 μmol/L Res单独处理后HepG2细胞相对存活率低(P均<0.05);Lut与Res联合处理24 h后HepG2细胞相对存活率低(P均<0.05);20 μmol/L Lut+25 μmol/L Res处理后HepG2细胞相对存活率最低(P均<0.05)。各浓度Lut、Res及二者联合处理24 h对LO2细胞相对存活率差异无统计学意义(P均>0.05);而索拉非尼处理24 h后LO2细胞相对存活率低(P<0.05)。
2.2 Lut、Res对HepG2、LO2细胞形态及凋亡的影响 未经药物处理的HepG2细胞生长旺盛,细胞透亮,胞体肥厚,边界清晰;而分别经20 μmol/L Lut、25 μmol/L Res、20 μmol/L Lut+25 μmol/L Res处理后,HepG2细胞逐渐固缩,膜局部破损,死亡细胞多。DAPI染色发现,药物处理后,HepG2细胞核出现不同程度的核固缩和染色体片段化,经20 μmol/L Lut+25 μmol/L Res处理后的HepG2细胞变化更明显。同时,药物处理对LO2的细胞形态和DAPI染色后核形态均无明显影响。
2.3 Lut、Res对HepG2细胞内NF-κB蛋白表达的影响 未经药物处理及经Lut 20 μmol/L、Res 25 μmol/L、Lut 20 μmol/L+Res 25 μmol/L处理后HepG2细胞内NF-κB蛋白相对表达量分别为1.00±0.08、0.96±0.10、1.00±0.12、0.95±0.12;p-NF-κB蛋白相对表达量分别为1.00±0.06、0.74±0.04、0.63±0.05、0.36±0.08。药物处理对HepG2细胞内NF-κB蛋白表达差异无统计学意义(P>0.05),但可下调细胞内p-NF-κB蛋白表达,经Lut 20 μmol/L+Res 25 μmol/L处理后HepG2细胞内p-NF-κB蛋白相对表达量最低(P均<0.05),HepG2细胞内NF-κB入核被明显抑制。
2.4 Lut、Res对HepG2细胞内Bcl-2、Bax、Caspase-3表达的影响 与未经药物处理的细胞相比,经药物处理后HepG2细胞内Bax、Caspase-3表达上调,Bcl-2表达下调,经Lut 20 μmol/L+Res 25 μmol/L处理后HepG2细胞内Bax、Caspase-3表达最高,Bcl-2表达最低 (P均<0.05)。见表1。

表1 Lut、Res对HepG2细胞内Bcl-2、Bax、Caspase-3相对表达量的影响
3 讨论
近年来,药物联合治疗肝癌成为研究热点,一方面联合用药可降低给药剂量,减少药物的不良反应;另一方面又可对抗肝癌的耐药性,发挥协同抗癌作用。研究发现,Lut和索拉非尼联用可增加肝癌细胞对索拉非尼的敏感性,通过激活c-Jun氨基末端激酶,促进细胞凋亡,有效解决了临床治疗中肝癌对索拉非尼的耐药性问题[11]。姜黄素与低剂量的塞来昔布联用可通过抑制蛋白激酶B/NF-κB/前列腺素E2/活性氧信号通路,协同促进HepG2细胞凋亡,抑制细胞增殖,有效避免了塞来昔布单独治疗时因剂量较高引起的严重心血管不良反应[12]。除此之外,葫芦素B与姜黄素联用二者可在低剂量下实现安全、高效协同抑制人肝癌细胞BEL-7402/5-Fu的生长,这与抑制P-糖蛋白和多药耐药性,促进细胞凋亡有关[13]。因此,药物联用是治疗肝癌的有效措施。
Lut和Res对细胞内过度激活的NF-κB均有抑制作用。Lut可抑制脂多糖诱导的小鼠单核巨噬细胞RAW246.7内NF-κB的激活,发挥抗炎作用[14];也可抑制肿瘤坏死因子α刺激的人肝癌细胞HepG2内NF-κB表达,抑制炎症相关通路激活[15]。Res则可通过抑制人结肠癌细胞HCT-15和人非小细胞肺癌细胞A549中NF-κB的活性,发挥抗肿瘤的作用[16,17]。但Lut和Res是否通过抑制NF-κB发挥抑制肝癌的作用及联用是否具有协同作用,目前鲜见研究报道。本研究发现,Lut和Res体外联合使用较单独使用对HepG2的生长具有更强的抑制作用,20 μmol/L Lut+25 μmol/L Res对HepG2生长的抑制作用最强。重要的是,Lut和Res单独及联合处理下,LO2细胞活力和形态均无显著变化,说明Lut、Res可选择性抑制肝癌细胞生长而对正常肝细胞的生长无影响。Lut与Res联合使用具有低毒性、高药效的特点。
NF-κB作为重要的核转录因子,激活后将从细胞质转移到细胞核内。肝癌细胞内NF-κB被过度激活,因此可通过上调IκBα表达抑制NF-κB的激活,显著减缓肿瘤的发展[18]。同时,化疗药物可通过激活肿瘤细胞内的NF-κB而使肿瘤细胞产生耐药性[19]。研究发现,Lut和Res均可抑制肿瘤细胞内NF-κB的激活,具有一定的抗肿瘤活性,但单独使用需要的剂量较大且药效不佳[9,11,15,16]。p-NF-κB是NF-κB的活性形式,本研究发现,低剂量的Lut和Res联用可显著抑制HepG2内NF-κB的激活,诱导凋亡相关基因和蛋白的表达,发挥协同抗肝癌的作用。这种协同作用一方面可能与抑制肿瘤细胞的生长有关,另一方面可能与增加肿瘤细胞对药物的敏感性有关。
综上所述,体外低剂量Lut与Res联用应用可协同抑制HepG2细胞的生长,且这种抑制作用强于阳性对照药索拉非尼;同时其对LO2细胞生长无影响,安全性优于索拉非尼,具有良好的临床应用价值。其作用机制可能与抑制HepG2细胞内NF-κB的激活,下调Bcl-2表达、上调Bax、Caspase-3表达有关。这为天然产物联合用药及靶向NF-κB抗肝癌的研究提供新思路。但本研究仅检测了单一靶点(NF-κB),未考察其上游的调控蛋白,机制研究过于单一;本研究仅考察了联合用药体外抗肝癌的作用,考虑到药物的体内吸收和代谢,其体内抗肿瘤活性需进一步研究。同时,LO2是一种转化后的正常肝细胞,不具备正常肝细胞的所有特性,药物的安全性需在原代肝细胞上进一步验证。
