铁基离子液体/NHD吸收氧化H2S的反应动力学
2020-02-19钱明超刘雪珂高帅涛谢海深王宏斌孙风江苏向红
张 丽, 钱明超, 刘雪珂, 高帅涛, 余 江, 谢海深,王宏斌, 孙风江, 苏向红
(1. 北京化工大学化学工程学院, 能源环境催化北京市重点实验室, 北京 100029;2. 河钢宣钢有限责任公司焦化厂, 张家口 075100;3. 张家口天龙科技发展有限公司研发部, 张家口 075100)
离子液体(IL)具有热稳定性好、 饱和蒸气压低、 选择性高等优点, 广泛应用于电化学、 分离、 催化等领域[1~5]. 随着国家对工业废气排放标准的提高, 在处理酸性气体的过程中发现离子液体表现出良好的性能[6,7].
Lv等[8]采用胺基功能化离子液体([APmim][Gly])吸收CO2, 其吸收容量可达1.23 mol CO2/mol IL(4.31 mol CO2/kg IL). Kazmi等[9]采用1-丁基-3-甲基咪唑甲基硫酸盐([Bmim][CH3SO4])和1-丁基-3-甲基咪唑六氟磷酸([Bmim][PF6])作为溶剂吸收天然气中的酸性气体, 替代传统的胺基吸收技术, 结果表明, 酸性气体的去除效率可达99%以上, 且显著降低了总年化成本和溶剂再生所需的热负荷.
近年来, 一些铁络合离子被引到离子液体结构中, 所得到的铁基离子液体(Fe-based ionic liquids, Fe-IL)具有离子液体普遍的优点外, 还具有催化氧化等特殊功能[10~13]. 何义等[14]以FeCl3·6H2O和氯化1-丁基-3-甲基咪唑(BmimCl)为原料制备了Fe-IL, 并率先将其应用于H2S的脱除; 研究发现Fe-IL不仅能将H2S氧化为硫磺, 且因其良好的疏水性和适当的氧化还原电位, 脱硫过程中无需调节pH值且无副产物产生, 规避了传统湿法脱硫中脱硫液消耗量大、 产生二次污染等问题, 由此提出非水相湿法氧化脱硫工艺新思路, 具有很大的应用潜力.
铁基离子液体因为具有优良的催化氧化性能已被广泛应用于H2S的脱除, 并取得了显著的效果. 王建宏等[15]研究了Fe-IL氧化脱除H2S的性能, 结果表明, Fe-IL在脱硫过程中表现出高效稳定的性能, 经过空气再生后的Fe-IL仍然具有良好的脱硫能力, 但是其实际硫容远小于理论硫容. Wang等[16]发现Fe-IL对H2S的脱除效果>99%, 且体系的酸度和Fe(Ⅲ)的浓度是Fe-IL催化氧化脱硫的主要影响因素, 但影响程度随温度的变化而变化. Guo等[17]研究发现Fe-IL在453 K左右具有较强的稳定性, 随着温度的升高脱硫效率显著提高, 同时H2S可以迅速被氧化为斜方晶型的硫单质并从脱硫剂中分离出来.
研究发现, Fe-IL呈现的高黏度及强酸性特征不利于脱硫反应过程中H2S的气液传质过程[15,16], 且实际硫容为0.31 g/L, 远小于理论硫容, 严重影响铁基离子液体的工业化应用. 针对铁基离子液体存在的高黏度、 强酸性、 低硫容等问题, 研究发现, 在Fe-IL中加入低黏度的N,N-二甲基甲酰胺(DMF)、 聚乙二醇二甲醚(NHD)或1,3-二甲基咪唑啉酮(DMI)等有机溶剂, 能显著降低Fe-IL的黏度及酸性, 强化气液传质过程, 且破坏体系中Fe—Cl键的稳定性, 促使Fe—Cl键在脱硫过程中断裂, 同时H2S中的H与Cl易发生相互作用, 推动Fe活性中心与H2S中S的键合作用, 提高H2S与脱硫体系间的化学反应推动力, 从而达到强化脱硫的目的[18,19]. 其中, NHD因对酸性气体(如H2S, COS等)有较强的吸收选择性、 无腐蚀性、 无毒性等优点[20~22]被广泛运用于物理吸收H2S方面, 在工业上已得到有效应用[23~25], 更为重要的是, NHD具有高沸点、 低蒸汽压且热稳定好的特性, 与Fe-IL复配后所形成的混合液仍保留离子液体的优异物化特性, 对非水相湿法氧化脱硫工艺的发展至关重要.
有机溶剂的加入会影响Fe-IL脱硫动力学, 且当前Fe-IL/有机溶剂复合体系的脱硫动力学研究尚未见报道. 本文将NHD与Fe-IL复合构成Fe-IL/NHD脱硫液, 研究了反应物浓度、 温度、 传质系数对共溶体系吸收H2S的影响, 确立了Fe-IL/NHD的脱硫反应动力学方程, 判断了脱硫过程的主要限制因素, 为强化Fe-IL脱硫提供了科学指导.
1 实验部分
1.1 试剂与仪器
N-甲基咪唑(分析纯, 上海三微有限公司); 氯代正丁烷(分析纯, 北京益利化学品有限公司); 六水合三氯化铁(FeCl3·6H2O)、 聚乙二醇二甲醚(NHD)(分析纯, 国药集团化学试剂有限公司), 1, 10, 100和1000 mL/L硫化氢(氮气配气, 北京永圣气体有限公司).
WOL-94型微量硫分析仪(西南化工研究设计院); 877 Titrino plus型氧化还原电位滴定仪(瑞士万通公司). 85-1A型恒温磁力搅拌器(巩义市予华仪器有限公司).
1.2 实验过程

Fig.1 Static absorption reactor1. H2S gas tank; 2. gas reducing valve; 3. pressure flange; 4. precision pressure gauge; 5. thermostat water bath; 6. high pressure absorption reactor; 7. magneto; 8. thermometer; 9. speed controller; 10. inlet valve; 11. outlet valve; 12. tail gas treatment unit.
1.2.1 实验装置 静态吸收反应装置主要包括进气系统、 静态吸收反应釜和尾气吸收系统(图1). 主体为容积200 mL内衬为聚四氟乙烯的316 L不锈钢高压反应釜, 采用水浴锅控制反应釜的温度及液相搅拌.
1.2.2 脱硫液的制备 参照文献[14]方法合成铁基离子液体, 并与NHD分别以质量比1∶0, 4∶1, 6∶1, 8∶1混合制备脱硫液.
1.2.3 动力学区域的确定 Fe-IL/NHD吸收H2S是传质和反应的综合过程, 在研究该体系前首先要确定其动力学区域. 采用Levenspiel提出的动力学区域确定方法, 具体如表1所示.
1.2.4 H2S吸收速率的计算方法 H2S吸收速率通过单位时间、 单位反应釜截面积吸收H2S的量计算.
v=nH2S/(τ·t)
(1)
式中,v(mol·m-2·min-1)为Fe-IL/NHD吸收H2S的速率;nH2S(mol)为Fe-IL/NHD在一定时间内吸收H2S的摩尔数;τ(m2)为反应釜气/液吸收截面面积;t(min)为吸收H2S的时间.
1.2.5 Fe(Ⅲ)反应速率的计算方法 反应速率指脱硫过程中发生氧化还原反应的瞬时变化量, 依据单位时间内Fe(Ⅲ)浓度的变化计算. Fe(Ⅲ)浓度采用磺基水杨酸-紫外分光光度法测量, 具体方法参照文献[26].
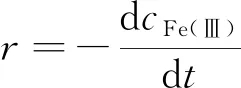
(2)
式中,r(mol·L-1·min-1)为Fe(Ⅲ)与H2S的反应速率;cFe(Ⅲ)(mol/L)为Fe(Ⅲ)的浓度.

Table 1 Determination method of dynamic region*
* A: instantaneous reaction; B: interfacial instantaneous reaction; C: fast reaction; D: fast pseudo-m order reaction; E: medium speed reaction; F: pseudo-m order medium speed reaction; G: slow reaction; H: extremly slow reaction in liquid subject; +: affected by the factor; -: not affected by the factor; ?: maybe affected by the factor.
2 结果与讨论
2.1 动力学区域的确定
依据动力学区域的确定方法分别对Fe-IL/NHD吸收H2S过程中各影响因素进行考察. 实验初始条件: 于200 mL反应釜中加入60 mL以上的脱硫液, 并通入0.2 MPa, 1 mL/L的H2S标准气体, 以此保持相对H2S而言的高浓度Fe(Ⅲ), 从而将Fe(Ⅲ)浓度作为一个不变常数. 此外, 反应釜内液相最大搅拌速率需保持吸收液面稳定.
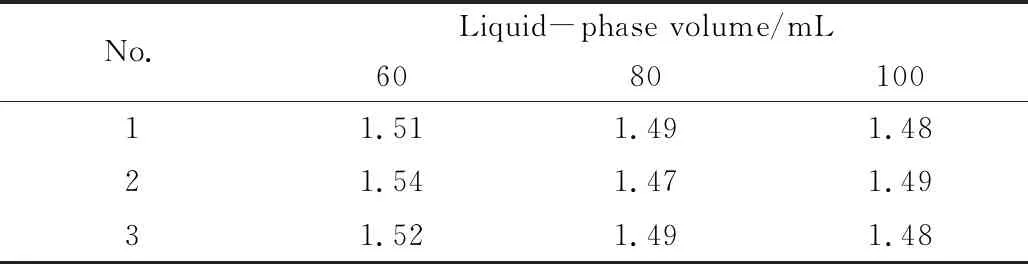
2.1.1 液相体积的影响 改变液相体积并保持其它条件不变, 测定吸收达到平衡时H2S的含量, 计算吸收速率. 为减小实验误差, 每组实验重复3次. 由表2可知, 吸收速率不随脱硫液体积的改变而改变. 因此, 动力学区域限定至A~D.
Table2Effectofliquid-phasevolumeonH2Sabsorptionrate(mol·m-2·min-1)*
No.Liquid-phase volume/mL608010011.511.491.4821.541.471.4931.521.491.48
* Other test conditions: 40 ℃,nG=0 r/min,nL=100 r/min,m(Fe-IL)∶m(NHD)=4∶1,cH2S=1 mL/L;nG: stirring rate in gas phase;nL: stirring rate in liquid phase.
Table3EffectofkLonH2Sabsorptionrate(mol·m-2·min-1)*

No.KL/(r·min-1)10015011.481.5021.491.5231.481.52
* Other test conditions: 40 ℃,nG=0 r/min,V=100 mL,m(Fe-IL)/m(NHD)=4∶1,cH2S=1 mL/L.
2.1.2 液相传质系数的影响 改变液相传质系数kL(由液相搅拌速度控制)并保持其它条件不变, 测定吸收达到平衡时H2S的含量, 计算吸收速率. 由表3可知, 吸收速率基本不随液相传质系数的变化而变化. 因此, 动力学区域限定为B和D.
2.1.3 Fe-IL/NHD复配质量比的影响 改变Fe-IL/NHD复配质量比并保持其它条件不变, 测定吸收达到平衡时H2S的含量, 计算吸收速率. 由表4可知, 适当增加NHD含量, 可提高吸收速率, 故动力
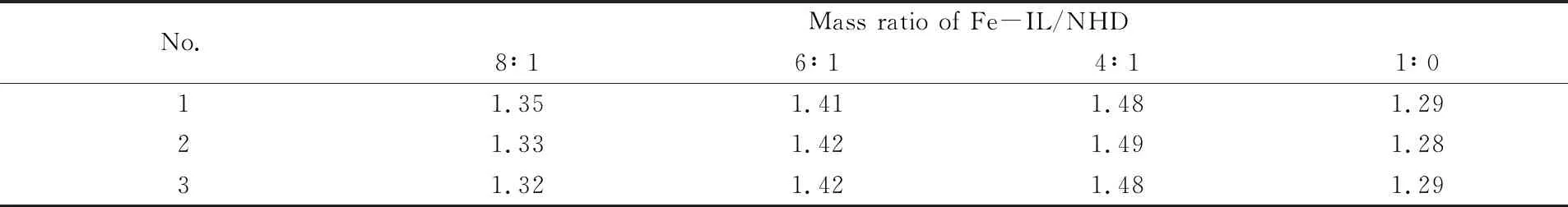
Table 4 Effect of different mass ratios of Fe-IL/NHD on H2S absorption rate(mol·m-2·min-1)*
* Other test conditions: 40 ℃,nG=0 r/min,nL=100 r/min,V=100 mL,cH2S=1 mL/L.
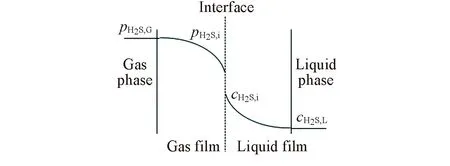
Fig.2 Model of double membrane theory about H2S absorption in Fe-IL/NHD
学区域限定为D.
由上述实验结果可推断出Fe-IL/NHD脱除H2S反应为快速拟m级反应, 即脱硫过程受到传质控制, 且主要是液膜控制(图2).
2.2 动力学模型的建立
基于双膜理论, 建立Fe-IL/NHD吸收H2S的动力学模型[27], 对于快速拟m级反应, 其吸收速率可表达为
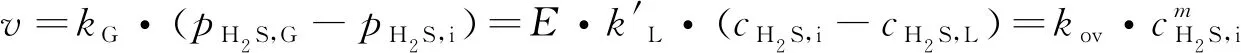
(3)
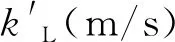
依据界面上相平衡关系, 即亨利定律, 界面处H2S的浓度可用下式表达:

(4)
式中,H(MPa·L·mol-1)为亨利系数.


(5)
式中,cH2S(mol·L-1)为H2S的浓度;a和b为反应级数;k2为本征反应速率常数, 与反应物浓度无关[28], 与反应温度、 介质和催化剂本身相关. 对于Fe-IL/NHD与H2S之间的反应速率常数与温度的关系可用阿伦尼乌斯方程表示:
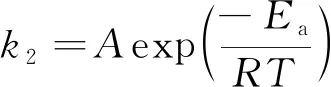
(6)
式中,A(L·mol-1·min-1)为阿伦尼乌斯常数;Ea(kJ/mol)为活化能;R(0.008315 kJ·mol-1·K-1)为气体常数;T(K)为温度.
2.3 动力学常数的计算
2.3.1 反应级数和表观速率常数 向200 mL吸收反应釜中加入100 mL脱硫液, 并通入0.2 MPa、 一定浓度的H2S标准气体, 液相温度设定为40 ℃, 搅拌速率100 r/min, 反应10 min. 分别考察初始浓度为1, 10和100 mL/L的H2S和不同Fe(Ⅲ)含量的脱硫液(Fe-IL/NHD复配质量比为8∶1, 6∶1, 4∶1, 1∶0)条件下的吸收速率, 结果如图3所示.
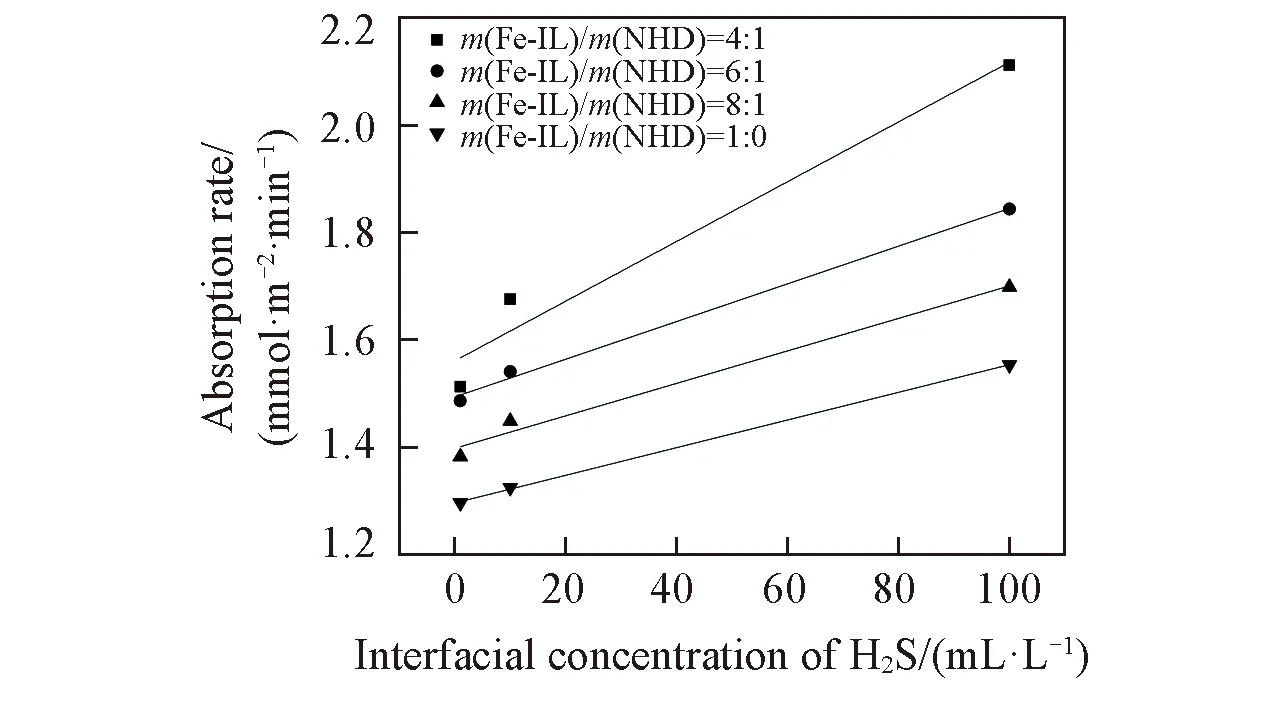
Fig.3 Fitting relation of interfacial concentration of H2S with absorption rate at different mass ratios of Fe-IL/NHD
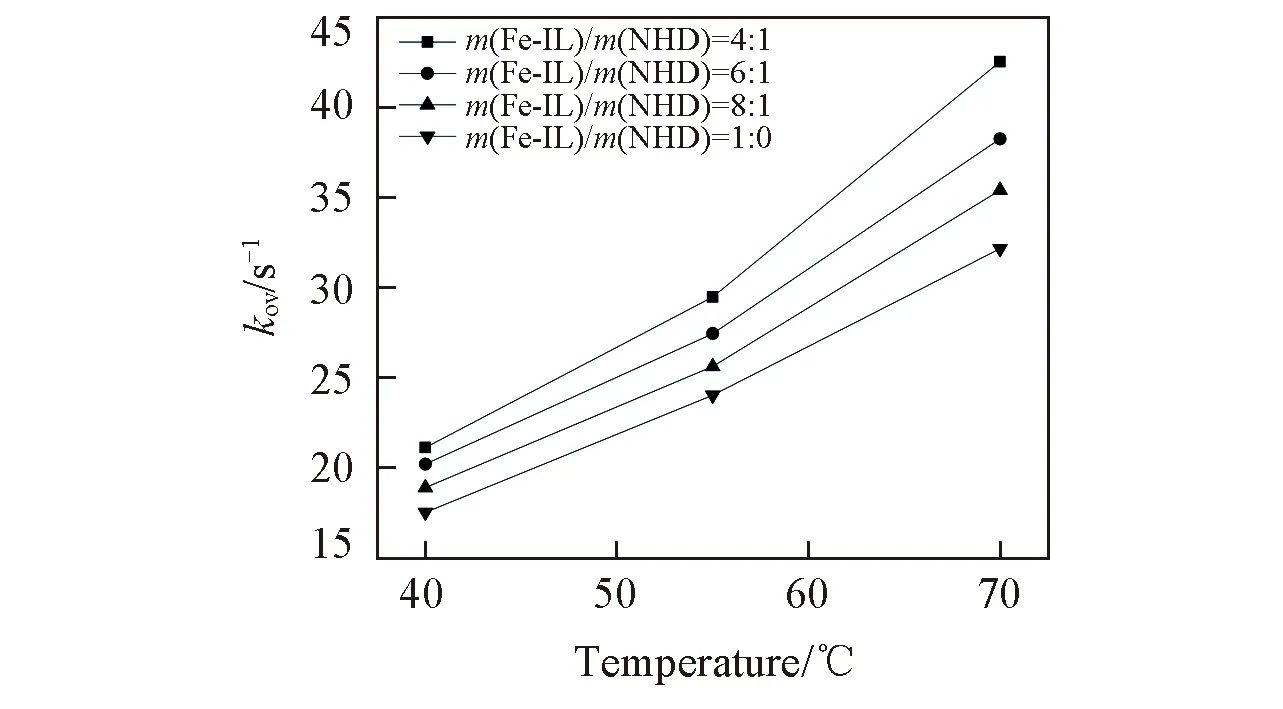
Fig.4 Relationship between kov and temperature at different mass ratios of Fe-IL/NHD
由图3可见, 不同质量比Fe-IL/NHD和界面H2S浓度具有良好的线性关系, 表明Fe-IL/NHD对H2S的吸收为一级反应, 且可得到不同质量比Fe-IL/NHD吸收H2S的表观速率常数(kov). 图4是不同质量比Fe-IL/NHD体系中温度对常数kov的影响, 由图4可知, 在同一温度下,kov随NHD含量的增加而增大; 在同一Fe-IL/NHD质量比下,kov随温度的升高而增大.
综上, Fe-IL/NHD吸收H2S主要受液膜控制, 提高温度和NHD的复配比可强化脱硫过程.
2.3.2 本征反应速率常数和活化能 Fe-IL/NHD吸收H2S为拟一级反应, 将反应速率方程(5)两边取自然对数得下式:
lnr=lnk2+lncH2S+blncFe(Ⅲ)
(7)
为考察Fe(Ⅲ)浓度的反应级数, 设定实验条件: 向200 mL反应釜中添加60 mL不同复配比的脱硫液, 通入0.4 MPa、 纯H2S(1000 mL/L), 液相温度设定为40 ℃, 液相搅拌速率100 r/min, 反应时间30 min, 间隔10 min取液体样测定Fe(Ⅲ)浓度, 结果如图5所示.
由图5可知, 纯Fe-IL体系在脱硫过程中, Fe(Ⅲ)的利用率较低, 说明Fe(Ⅲ)的活性低, 而复配NHD后可有效提高Fe(Ⅲ)的利用率.
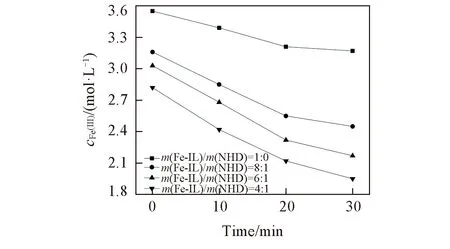
Fig.5 Relationship between cFe(Ⅲ) and time at different mass ratios of Fe-IL/NHD
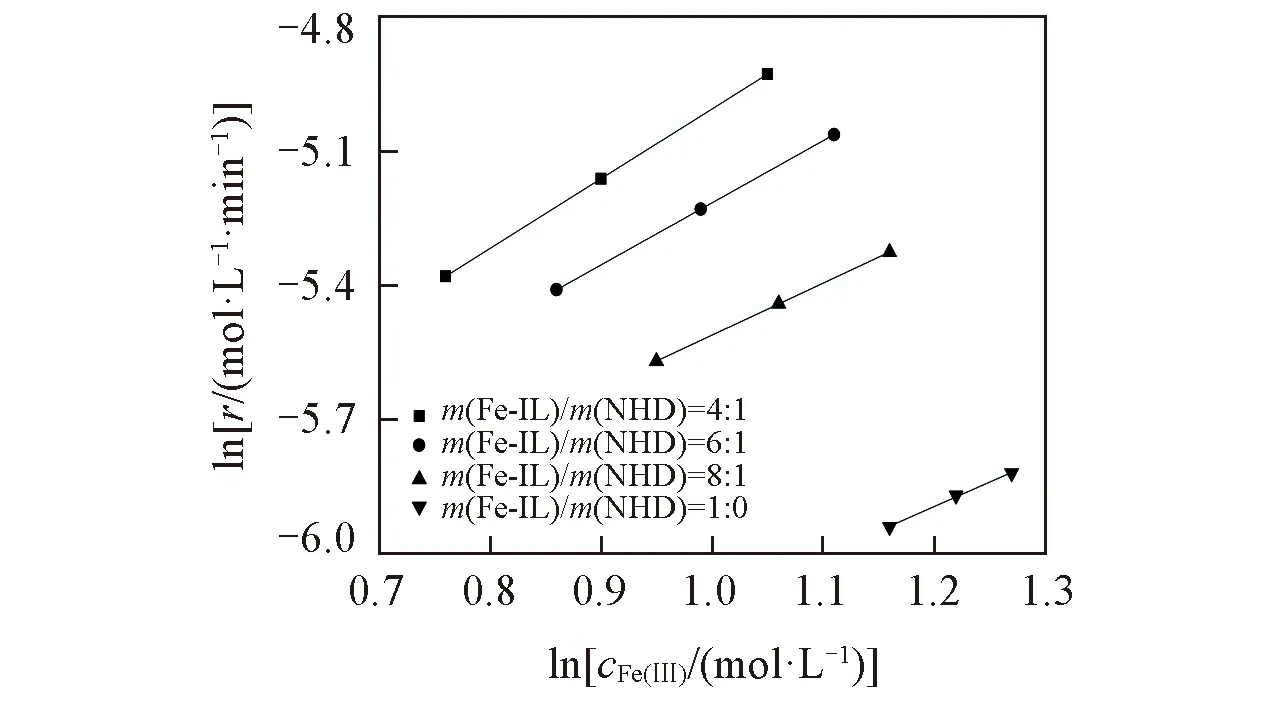
Fig.6 Fitting relation of lnr with lncFe(Ⅲ) at different mass ratios of Fe-IL/NHD
依据图5中的数据计算反应速率r, 以lnr对lncFe(Ⅲ)作图(如图6所示), 可得到Fe(Ⅲ)浓度的反应级数, 拟合的相关参数(b)及方差(R2)如表5所示.
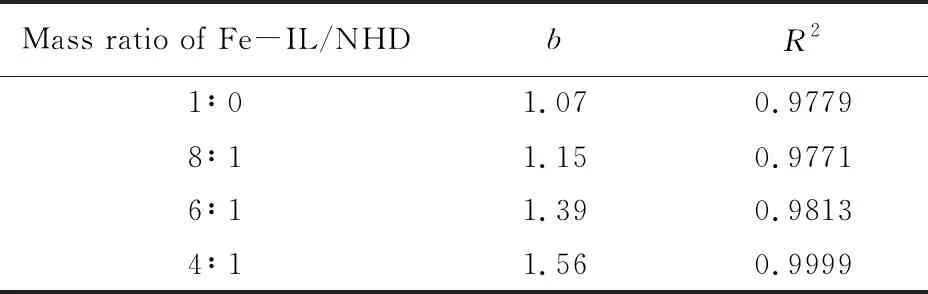
Table 5 Ftting relation of lnr with lncFe(Ⅲ)
由此可见, 不同复配比的Fe-IL/NHD体系中lnr与lncFe(Ⅲ)均呈良好的线性关系. 纯Fe-IL脱硫过程中对Fe(Ⅲ)的反应级数接近1, 复配NHD后对Fe(Ⅲ)的反应级数随NHD含量的增大而增大. 反应级数越大, 反应速度越快, 即Fe-IL/NHD复配体系的反应速度大于纯Fe-IL的反应速度. 由此可知, NHD不仅强化了H2S的传质过程, 而且强化了进入脱硫体系中的H2S与Fe(Ⅲ)之间的化学反应推动力, 即由于NHD的溶剂化作用, 提高了Fe(Ⅲ)的活性, 促进其与H2S反应过程中硫元素向Fe(Ⅲ)活性中心转移, 进而促使最终产物硫磺的产生.
本征反应速率是一个与温度有关的常数, 为考察温度的影响, 设定实验条件为: 向200 mL反应釜中添加60 mL纯Fe-IL, 在一定温度下, 通入0.4 MPa的纯H2S, 液相搅拌速率100 r/min, 反应时间30 min, 间隔10 min取液体样测定Fe(Ⅲ)浓度, 实验结果如图7所示.

Fig.7 Relationship between Fe(Ⅲ) content and time at different temperatures

Fig.8 Fitting relation of lnr with 1/T
依据图7计算不同温度下反应速率r, 将r,a=1,b=1代入本征反应速率方程(5), 结合阿伦尼乌斯公式, 以lnr对1/T作图进行拟合, 结果如图8所示.
由图8可知, 直线的斜率-Ea/R=-1409.1, 截距为ln(A·cFe(Ⅲ)·cH2S)=-1.8636, 因此,Ea=11.72 kJ/mol,A=54.62 L·mol-1·min-1.
则Fe-IL/NHD吸收氧化H2S的反应动力学方程为
r=54.62exp(-11720/RT)·cH2S·cFe(Ⅲ)
(8)
3 结 论
将有机溶剂NHD引入Fe-IL中, 强化了H2S的传质过程, 提高了H2S与Fe(Ⅲ)之间的化学反应推动力. 选用Fe-IL/NHD作为非水相脱硫体系, 探究了其吸收氧化H2S的动力学特性. 结果表明, Fe-IL/NHD脱除H2S的宏观吸收动力学属于快速拟一级反应, 增大NHD的含量和提高温度可强化传质过程. 纯Fe-IL吸收氧化H2S的反应动力学方程为r=54.62exp(-11720/RT)·cH2S·cFe(Ⅲ). 复配NHD后, 随着NHD含量的增加, 混合体系对Fe(Ⅲ)的反应级数增大, 即NHD的加入提高了脱硫过程的反应速率. 通过对Fe-IL/NHD共溶体系吸收H2S的动力学研究发现, 脱硫过程主要受液膜控制, 有机溶剂的加入提高了体系对Fe(Ⅲ)的反应级数, 强化了脱硫过程, 为未来的工业应用提供了一定的理论依据.