适用于结核分枝杆菌微测序耐药基因芯片的多重PCR体系的优化与评价
2020-02-19孙照刚李自慧张洪静孙琦潘丽萍张宗德许绍发
孙照刚 李自慧 张洪静 孙琦 潘丽萍 张宗德 许绍发
结核病耐药性的快速诊断和全面诊断是当前结核病诊断领域的研究热点。目前世界卫生组织(WHO)主要推荐基于PCR基础上的Xpert MTB/RIF检测和线性探针检测(line probe assays,LPAs)技术作为耐药结核病主要的分子检测方法。前者虽然能快速、简便地检测利福平耐药,但其主要缺点是费用十分昂贵,检测耐药种类少[1];后者可以同时检测利福平和异烟肼耐药,以及新一代的GenoType MTBDRsl可以检测氟喹诺酮类、氨基糖苷类和乙胺丁醇耐药,但目前价格昂贵,需要专业技术人员操作,敏感性也略欠缺[2-4]。由此可见PCR技术是分子检测的基础,优化PCR技术不但可以降低成本,减少误差,而且减轻技术操作人员的工作量,提高用户体验效果。
基因芯片技术是一类高通量分子检测技术,对于PCR操作的每一步节省或减轻工作量都将大大提高工作效率。耐药结核病基因芯片检测是WHO认可的用于结核分枝杆菌(M.tb)耐药性检测的分子生物学方法[5]。前期我们报道了本课题组研发的微测序基因芯片技术[6]以及相应的一种多重PCR方法[7],本研究拟进一步对前期建立的多重PCR反应体系进行优化,并评价其在利用结核分枝杆菌微测序耐药基因芯片进行耐药性临床检测中的优缺点。
资料与方法
一、标本来源
结核分枝杆菌临床分离株来源于本单位的北京结核病临床数据和样本资源库。痰标本来源于临床检验后的剩余标本。
二、临床分离株基因组DNA的提取
采用DNA小量提取试剂盒(51304,Qiagen公司)按操作说明提取菌株DNA。简单操作如下:用TE缓冲液(pH8.0,含Tris-Cl 0.1 mmol/ L),EDTA 0.5 mmol/ L重悬细菌,加入溶菌酶至5 mg/mL,37℃过夜振荡消化,加入蛋白酶K至终浓度1 mg/mL,加入10% SDS至终浓度1%,37℃振荡1小时,之后根据操作说明书进行过柱分离纯化基因组DNA,并最终溶解于适量无菌去离子水,用Nanodrop2000(美国Thermo Scientific)进行定量检测后,贮存于-20℃。
三、耐药相关基因的引物合成
参考文献[7],由生工生物工程(上海)股份有限公司进行引物合成。扩增的基因包括rpoB(409bp)、katG(635bp)、mabA/inhA(248bp)、embB(1111bp)、gyrA(423bp)、rpsL(373bp)、rrs(516 bp)和eis(567 bp),以及pncA(上游:5′-GGTCATGTTCGCGATCGTCG-3′和下游:5′-ACAGTTCATCCCGGTTCGGC-3′,689 bp)各引物对扩增的条带大小在凝胶电泳时区分较为明显。
四、PCR扩增及测序
PCR扩增采用的Taq酶购于北京康为世纪生物科技有限公司(CW0654A),dNTP购于天根生化科技(北京)有限公司(CD111-02)。由生工生物工程(上海)股份有限公司完成PCR产物的双向测序。采用琼脂糖凝胶进行电泳。为便于计算成本,所用的耗材0.5~10μL盒装灭菌短吸头、200μL枪尖(无RNase)、96孔PCR反应板及其封口膜等均购自Axygen公司。每个样品重复2次,共做了3批144个标本,每批操作为48个标本。采用(NH4)2SO4来调节NH4+的浓度,同时采用二甲基亚砜(DMSO),两者都具有促进特异性PCR反应的作用。
五、主要仪器
生物安全柜(NU-425-300E,美国Nuaire公司),基因扩增仪(My Cycler,美国Bio-rad公司),凝胶成像系统(GelDoc XR,美国Bio-rad公司),核酸分析仪(Nanodrop2000,美国Thermo公司)
结 果
一、九个耐药相关基因扩增的单管PCR扩增
根据引物的设计结果,煺火温度采用62℃,反应体系为常规反应体系(表1),每条引物的摩尔数基本相同。由(图1)可以看出,各基因的PCR产物亮度不同。根据亮度,我们推测在该煺火温度下,各引物对都能正常与模板结合,但是效率不同。因此,为了达到各基因的PCR反应产物接近相同,我们在多重PCR反应体系中需要调整引物的比例。

表1 结核分枝杆菌耐药基因的扩增普通PCR反应体系

图1 浓度为1%的琼脂糖凝胶电泳
1~10分别为:空白对照、katG、inhA reg、rpoB、gyrA、rrs、embB、rpsL、pncA、eis。M,marker,条带分别2000/1000/750/500/250/100 bp。
二、多重PCR扩增
1 多重PCR(2管扩增9个目的基因) 根据所扩增的9个目的基因的片段大小,我们对多重PCR所用的引物进行了合理组合。图2 显示的是分别采用6:3组合(图2 A)和5:4组合(图2 B)都能收到良好的扩增效果。但是5:4组合的电泳结果更清楚。经二代测序证明,各产物之间比例恰当,产物为需要扩增的目的基因。

图2 浓度为2%的琼脂糖凝胶电泳
1包含6对基因引物(具体名称省略);2包含3对基因引物(具体名称省略);3包含5对基因引物(具体名称省略);4包含4对基因引物(具体名称省略)。 M1,marker,条带分别600/500/400/300/200/100 bp;M2,marker,条带分别2000/1000/750/500/250/100 bp。

3 耐药基因扩增多重PCR体系的痰标本验证 采用135株临床分离株进行DNA提取后的PCR扩增,结果所有标本均能清楚的看到9条目的基因条带。对150个临床痰标本进行DNA提取,经Nanodrop测定核酸的量发现有DNA的阳性标本为36个,PCR扩增和电泳的结果证明有大约29(80.56%)的标本能够扩增出目的条带,其余标本扩增不全,缺少个别的条带。
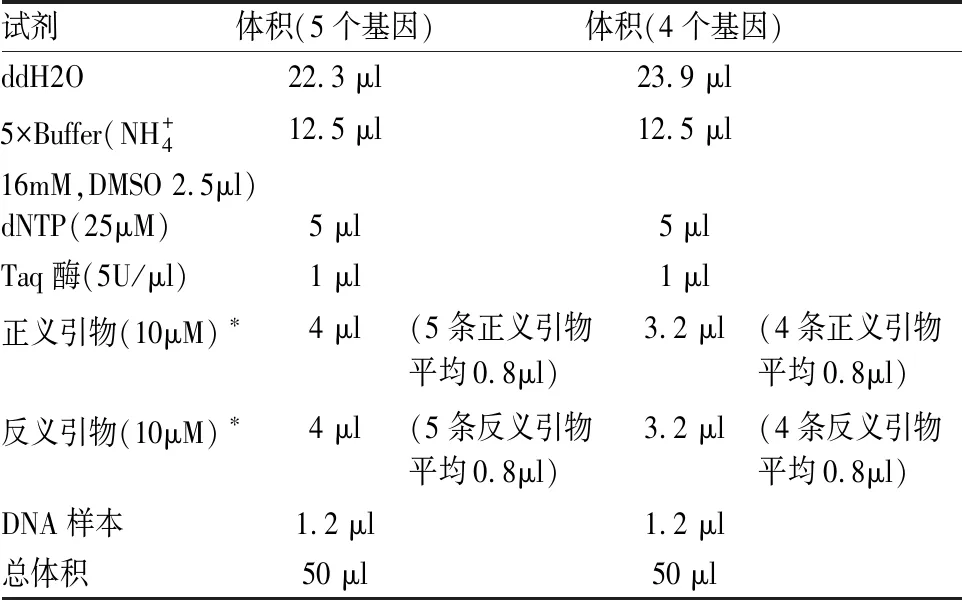
表2 结核分枝杆菌耐药基因的优化PCR反应体系
注:根据前期PCR产物中各条带的亮度,调整引物的量,增加弱带的引物量,降低强带的引物量。
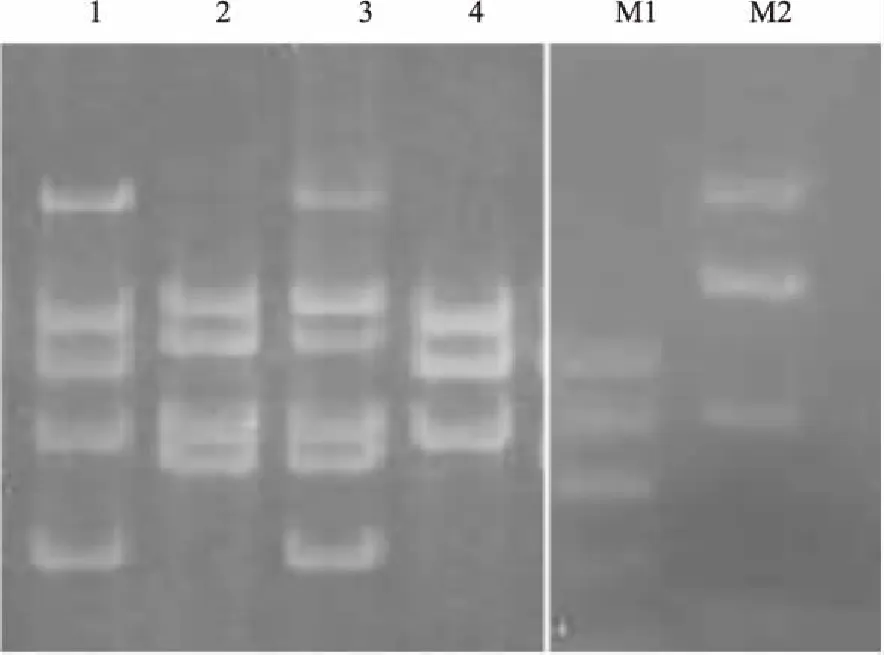
图3 浓度为3.5%的琼脂糖凝胶电泳
1包含5对基因引物;2包含4对基因引物。3包含6对基因引物;4包含3对基因引物; M1,marker,条带分别600/500/400/300 bp;M2,marker,条带分别1000/750/500/250 bp。
4 耐药基因扩增多重PCR体系的效率优势 与每个耐药基因都需要单管PCR扩增相比,本研究创立的多重PCR扩增方法能够缩短操作时间,减少所用耗材,提高扩增效率,减少人为操作失误率。此外,在需要样品运输至第三方检验时还可以节省物流成本。
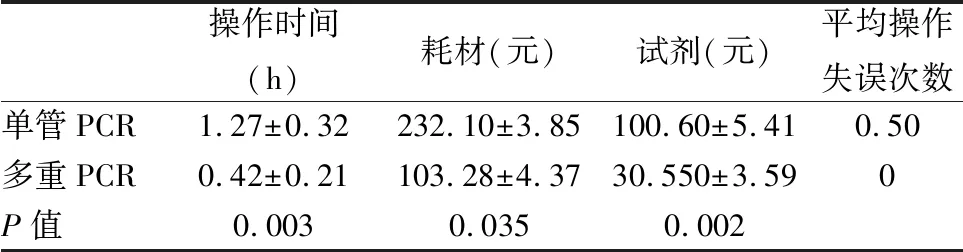
表3 平均每48个标本的操作效率比较
讨 论
结核分枝杆菌耐药检测芯片是一种高通量的检测多药耐药的芯片技术,该技术目前主要以杂交法为主[8-10],但是杂交法具有操作复杂、耗时长等缺点,而以微测序技术为原理的芯片技术,能够较好的克服了芯片检测技术的多数缺点。前期我们的研究结果表明微测序耐药基因检测芯片具有较好的敏感性、特异性和一致性,此外,微测序芯片技术传统的杂交法芯片检测技术具有操作方面、快速等优点。本研究针对微芯片耐药检测技术中利用PCR制备芯片检测样本环节进行了优化操作和成本计算等评价,以提高对微测序基因芯片检测结核耐药性的认识。

为了验证优化后的多重PCR反应体系,本研究分别以罗氏培养的菌体和痰菌为研究对象,经过Nanodrop验证,全部的培养菌株都可以提取到基因组DNA并且多重PCR能够扩增出所有条带;而经nanodrop确认后的痰标本有80.56%能够扩增出全部条带,多重PCR不能扩增出的条带没有规律性,是否与模板量有关尚需进一步研究[13]。本研究虽然对多重PCR的成本进行了计算,但是本研究中的计算仅仅是为了有一个比较,并不具有完全的价格代表性。例如,多重PCR操作时间受所用加样设备和试验条件的影响较大;耗材和试剂受产地以及供货渠道的影响也较大,而失误次数更是与操作人员有密切关系。但是这并不影响对多重PCR具有优势的判断。对多重PCR体系的优化应当还具有一定的进步空间,但是本研究只做了关键部分尝试,今后还需进一步完善和改进。
