响应面法优化超声微波联合提取杏鲍菇中麦角硫因工艺
2020-02-18莫宇丽李亚欢胡晶晶张怡馨
莫宇丽,李亚欢,王 艳,胡晶晶,张怡馨,王 杰
(华南农业大学食品学院,广东广州 510642)
麦角硫因学名为2-巯基-L-组氨酸三甲基内盐,1909年,Tanret C首次从麦角中分离得到麦角硫因,它是一种无色无味的天然氨基酸[1],具有有效的抗氧化[2]、抗炎[3]、细胞保护[4]、护色[5]和抵抗紫外线辐射[6]等功能。作为一种新型的天然强抗氧化剂,麦角硫因在食品添加剂、保健品、化妆品等领域具有巨大的应用潜力,在市场上存在着巨大需求[7-8]。
麦角硫因不能由动物机体或者人体自身合成,主要存在于一些细菌和真菌中[1]。在合成麦角硫因的微生物中,杏鲍菇、金针菇等常见食用菌中麦角硫因的含量高且具有天然安全性,是制备麦角硫因的良好资源[9-11]。目前,国内外对麦角硫因的研究多集中于功能研究[1-7],提取方面的报道一般为水或其它溶剂对常见食用菌的简单浸提[12-14]。对于生物体内活性物质的提取,合适的工艺条件可大大提高目标产物的提取量,缩短提取时间,减少提取过程中对目标产物的损耗[15-16]。而食用菌麦角硫因的得率亦会受溶剂、温度等因素的影响[16]。因此,有必要对食用菌麦角硫因的提取工艺提取条件进行深入研究。本研究以杏鲍菇为对象,使用单因素实验和响应面试验对杏鲍菇中麦角硫因的条件进行优化,以期为杏鲍菇麦角硫因的开发和利用提供理论依据。
1 材料与方法
1.1 材料与仪器
杏鲍菇 取无虫害、无机械损伤、大小均一的样品用于实验,广东蓝田农业有限公司;麦角硫因标准品 美国Sigma公司;乙醇、甲醇、丙酮(分析纯),甲醇、乙腈(色谱纯) 广州丛源试剂公司。
LC2130高效液相色谱仪 上海天美科学仪器有限公司;FD-1-50真空冷冻干燥机 天津比朗实验仪器制造有限公司;XY-8000电热恒温鼓风干燥箱 上海紫裕生物科技有限公司;MAS-Ⅱ微波萃取仪 上海新仪微波化学科技有限公司;低温连续相变萃取装置 珠海共同机械有限公司;JY92-2D超声细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 试验方法
1.2.1 干燥方式的选择 对照组:取100 g新鲜杏鲍菇,使用粉碎机将其充分粉碎成粉末状,加入适量的70%乙醇与其充分混匀、溶解,接着8000 r/min离心10 min,取上清液用70%乙醇定容,用HPLC法测定麦角硫因含量。
热风干燥:取100 g新鲜杏鲍菇放置于烘箱中干燥至恒重(温度设置为50 ℃),然后使用粉碎机将其充分粉碎成粉末状,加入适量的70%乙醇与其充分混匀、溶解,接着8000 r/min离心10 min,取上清液用70%乙醇定容,用HPLC法测定麦角硫因含量。
真空冷冻干燥:取100 g新鲜杏鲍菇置于超低温冰箱12 h迅速降温冷冻后,进行真空冷冻干燥至恒重(冷阱温度-57 ℃,真空度200 Pa)。然后使用粉碎机将其充分粉碎成粉末状,加入适量的70%乙醇与其充分混匀、溶解,接着8000 r/min离心10 min,取上清液用70%乙醇定容,用HPLC法测定麦角硫因含量。
1.2.2 超声微波联合提取杏鲍菇中麦角硫因的单因素实验
1.2.2.1 液料比的选择 取2 g真空冷冻干燥后的杏鲍菇粉末与70%乙醇分别按照液料比20∶1、30∶1、40∶1、50∶1、60∶1 (mL/g)进行混匀,微波处理(400 W,4 min,70 ℃)、超声处理(500 W,5 min),然后8000 r/min离心10 min,取上清液用70%乙醇定容,测定麦角硫因含量。
1.2.2.2 乙醇浓度的选择 取2 g真空冷冻干燥后的杏鲍菇粉末按照液料比50∶1 (mL/g)分别与40%、55%、70%、85%、100%乙醇进行混匀,微波处理(400 W,4 min,70 ℃)、超声处理(500 W,5 min),然后8000 r/min离心10 min,取上清液用相应浓度的乙醇定容,测定麦角硫因含量。
1.2.2.3 微波功率的选择 取2 g真空冷冻干燥后的杏鲍菇粉末与55%乙醇按照液料比50∶1 (mL/g)进行混匀,分别置于微波功率100、200、300、400、500、600、700 W处理(4 min,70 ℃),超声处理(500 W,5 min),然后8000 r/min离心10 min,取上清液用55%乙醇定容,测定麦角硫因含量。
1.2.2.4 微波温度的选择 取2 g真空冷冻干燥后的杏鲍菇粉末与55%乙醇按照液料比50∶1 (mL/g)进行混匀,分别置于微波温度50、55、60、65、70 ℃处理(500 W,4 min),超声处理(500 W,5 min),然后8000 r/min离心10 min,取上清液用55%乙醇定容,测定麦角硫因含量。
1.2.2.5 微波时间的选择 取2 g真空冷冻干燥后的杏鲍菇粉末与55%乙醇按照液料比50∶1 (mL/g)混匀,于微波(500 W,70 ℃)分别处理3、5、10、15、20、25、30 min,超声处理(500 W,5 min),然后8000 r/min离心10 min,取上清液用55%乙醇定容,测定麦角硫因含量。
1.2.2.6 超声功率的选择 取2 g真空冷冻干燥后的杏鲍菇粉末与55%乙醇按照液料比50∶1 (mL/g)混匀,微波处理(500 W,4 min,70 ℃),然后分别置于超声功率200、300、400、500、600 W处理5 min,最后8000 r/min离心10 min,取上清液用55%乙醇定容,测定麦角硫因含量。
1.2.2.7 超声时间的选择 取2 g真空冷冻干燥后的杏鲍菇粉末与55%乙醇按照液料比50∶1 (mL/g)混匀,微波处理(500 W,5 min,70 ℃),然后500 W超声分别处理5、10、20、30、40、50 min,最后8000 r/min离心10 min,取上清液用55%乙醇定容,测定麦角硫因含量。
1.2.3 响应面法优化杏鲍菇中麦角硫因的提取工艺 根据单因素实验分析结果,固定微波条件500 W、65 ℃、5 min,超声波处理5 min,选择液料比(A)、乙醇浓度(B)和超声功率(C)为试验因素,以麦角硫因含量为响应值,设计响应面试验进行工艺优化,其试验设计见表1。
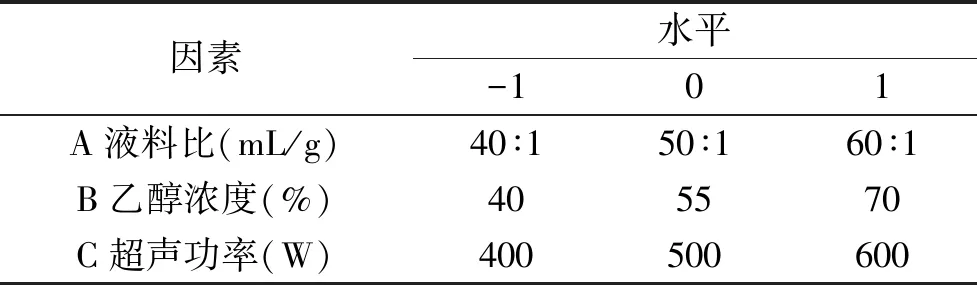
表1 响应面试验因素水平表Table 1 Factors and levelsTable of response surface experiment
1.2.4 麦角硫因含量的测定 利用高效液相色谱法测定麦角硫因含量[17]。检测条件:色谱柱为Phenomenex公司生产的5 μm C18色谱柱(250 cm×4.6 mm,5μm),流动相为水∶甲醇=98∶2 (V/V),流速为1 mL/min,取20 μL样品液进行上样,设置检测波长为254 nm。
标准曲线的制作:取1 mg 麦角硫因标准品用10 mL提取溶剂溶解,制成浓度为0.1 mg/mL(100 μg/mL)的标准品原液,再将原液分别稀释成75、50、25和5 μg/mL的麦角硫因标准品溶液,标准品和提取液使用以上检测条件用HPLC法检测;以麦角硫因浓度(mg/mL)为纵坐标,以峰面积(μAU·s)为横坐标,绘制麦角硫因标准曲线,得到麦角硫因标准回归方程为:y=1.80×10-8x+0.0002,R2=0.9995,其中y为麦角硫因浓度,x为峰面积。
1.3 数据处理
2 结果与分析
2.1 干燥方式的选择
由图1可知,热风处理后提取得到杏鲍菇的麦角硫因含量为(0.11±0.02) mg/g湿重,显著低于(P<0.05)其它两种处理方法;而新鲜杏鲍菇和经真空冷冻处理后的杏鲍菇干粉中麦角硫因含量分别为(0.21±0.01)、(0.20±0.02) mg/g湿重,二者无显著差异(P>0.05)。利用热风干燥对样品进行干燥时,组织部的水分会迅速蒸发,这会对组织结构造成很大的破坏[18],因此热风干燥容易导致杏鲍菇中营养物质的损失。新鲜的杏鲍菇含水量高,易发生腐败变质,不耐贮藏,不适于工业生产。而使用真空冷冻处理后的杏鲍菇含水量降低,并且低温处理可减少营养成分的损失,对处理后的材料进行充分粉碎后,也可提高麦角硫因在溶剂中的浸出率。故采用真空冷冻干燥对杏鲍菇进行干燥处理。
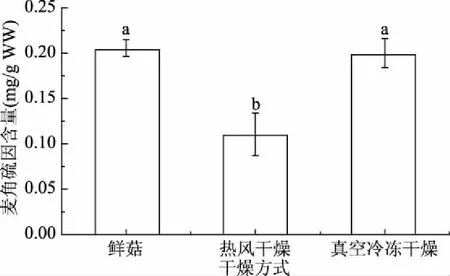
图1 干燥方式对麦角硫因含量的影响Fig.1 Effect of drying methods on the content of ergothioneine注:不同小写字母表示具有差异 显著性(P<0.05),图2~图8同。
2.2 单因素实验结果分析
2.2.1 液料比的选择 由图2可知,随着加入提取溶剂体积的增大,液料比升高,得到的麦角硫因含量逐渐升高;在液料比50∶1时,其含量达到最大值,为(2.46±0.21) mg/g干重,显著高于其它处理组(P<0.05);但其后随着溶剂体积的增加,其含量显著减少(P<0.05)。这有可能是由于在液料比50∶1之前,随着提取溶剂体积的增加,料液间的浓度差逐渐增大,同时料液彼此间接触面积更大[19-20],使得更多的麦角硫因浸出;而在液料比50∶1之后,杏鲍菇中麦角硫因的浸出已趋于饱和状态,故其提取量不会再上升。而且液料比过大,会消耗更多的能量和时间,故选择液料比为50∶1。

图2 液料比对麦角硫因含量的影响Fig.2 Effect of liquid to material ratio on content of ergothioneine
2.2.2 乙醇浓度的选择 由图3可以看出,其它条件相同的情况下,麦角硫因含量在乙醇浓度为40%和55%时没有显著性差异(P>0.05),分别为(2.86±0.03)、(2.93±0.05) mg/g干重,显著高于其它处理组(P<0.05);然后随着乙醇浓度的升高,其含量反而急速减少。这可能是因为麦角硫因可溶于多种溶剂,当乙醇浓度达到55%时,麦角硫因能最大程度地溶出,而后乙醇浓度升高则有可能促进某些脂溶性杂质的溶出,抑制了麦角硫因在提取溶剂中的浸出。Nguyen等[16]使用不同浓度的乙醇提取金针菇中的麦角硫因,同样发现这两者不成正比关系,而是出于一个先上升后下降的趋势。同时乙醇浓度的提高可一定程度上减少提取液中杂质的含量,因此乙醇浓度选择为55%。
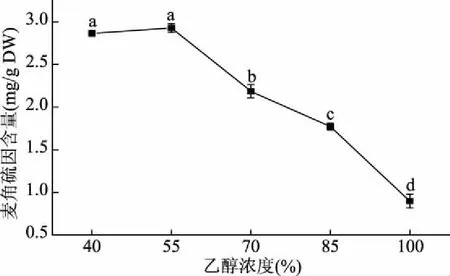
图3 乙醇浓度对麦角硫因含量的影响Fig.3 Effect of ethanol concentration on content of ergothioneine
2.2.3 微波功率的选择 从图4可以看出,麦角硫因的含量随着微波功率的升高整体呈上升趋势;在微波功率为500 W时,其达到最高值,为(2.02±0.03) mg/g干重;继续增大功率,其含量缓慢下降,但其差异不显著(P>0.05)。这有可能是因为当微波功率达到一定值时,可以提供足够的能量来打破细胞的细胞壁,使得有效成分可从细胞中充分浸出[21-22]。但当微波功率超过一定的范围后,则有可能加速麦角硫因的氧化,损耗了溶液中的一部分麦角硫因,使得其含量降低。故微波功率选用500 W。
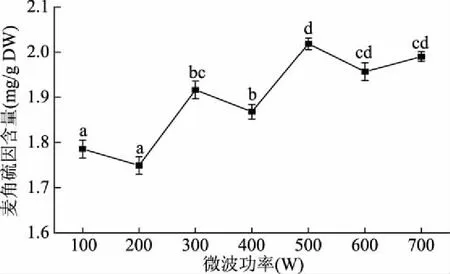
图4 微波功率对麦角硫因含量的影响Fig.4 Effect of microwave power on content of ergothioneine
2.2.4 微波温度的选择 有研究表明使用微波对物质进行处理时,温度的升高可加速细胞壁的破裂,促进活性成分的浸出[23-24]。由图5可知,在微波温度50~70 ℃范围内,随着温度的升高,麦角硫因含量逐渐增加;当温度达到70 ℃时,其含量达到最大值。在本研究中65、70 ℃时麦角硫因含量分别为(2.72±0.11)、(2.73±0.07) mg/g干重,两者间无显著差异(P>0.05),但在70 ℃时提取液呈沸腾状态,这会造成提取液中乙醇的挥发,从而影响麦角硫因的含量,故微波温度选择为65 ℃。
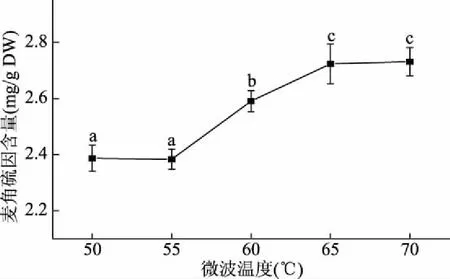
图5 微波温度对麦角硫因含量的影响Fig.5 Effect of microwave temperature on content of ergothioneine
2.2.5 微波时间的选择 如图6所示,在实验所选的微波处理时间3~30 min范围内,一开始随着微波处理时间的延长,麦角硫因含量上升,在5 min时达到最大值,为(3.21±0.07) mg/g干重。微波处理可在短时间内提供热量,使细胞内部迅速升温,促使细胞快速破裂[23],从而有可能增加了麦角硫因的浸出量。但在5 min后,麦角硫因含量随着微波处理时间的延长反而下降,这可能是因为微波处理的时间过长,对麦角硫因的结构造成了一定程度的破坏。故微波时间选择为5 min。

图6 微波时间对麦角硫因含量的影响Fig.6 Effect of microwave time on content of ergothioneine
2.2.6 超声功率的选择 由图7可知,在超声功率200、300 W时,麦角硫因的含量有所下降,但差异不显著(P>0.05),超声功率300~600 W范围内,随着超声功率的增加,麦角硫因的含量呈逐渐上升趋势;在500 W时,麦角硫因含量达最大值(3.07±0.05) mg/g干重;随后继续增加超声功率,其含量略有降低,但是差异不显著(P>0.05)。这有可能是由于超声功率升高,机械剪切力增强,因此细胞破裂,麦角硫因从细胞内流出,与此同时超声波产生的振动作用可加强物质的扩散及溶解。但当超声功率过高时,能量过大会引起温度的升高,会使得一些不稳定的抗氧化物质结构发生改变[25-26],麦角硫因的结构有可能因此而发生改变,故选用超声功率500 W。
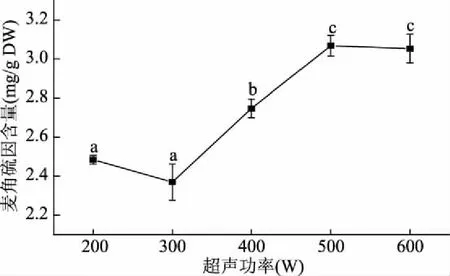
图7 超声功率对麦角硫因含量的影响Fig.7 Effect of ultrasonic power on content of ergothioneine
2.2.7 超声时间的选择 由图8可知,当超声波处理5 min时,麦角硫因含量达到最高,为(3.70±0.08) mg/g干重,显著高于其它处理组(P<0.05);随着超声处理时间的延长(10~50 min),麦角硫因含量呈下降趋势,但差异不显著(P>0.05)。适当的超声波处理可增加麦角硫因的溶出,但是随着时间的延长,所消耗的能量就会越多,并且产生的热量也会越高,同时杏鲍菇中的其它成分也会溶出,这些都有可能使溶出的麦角硫因发生分解,从而使麦角硫因的含量降低。故超声时间选择为5 min。
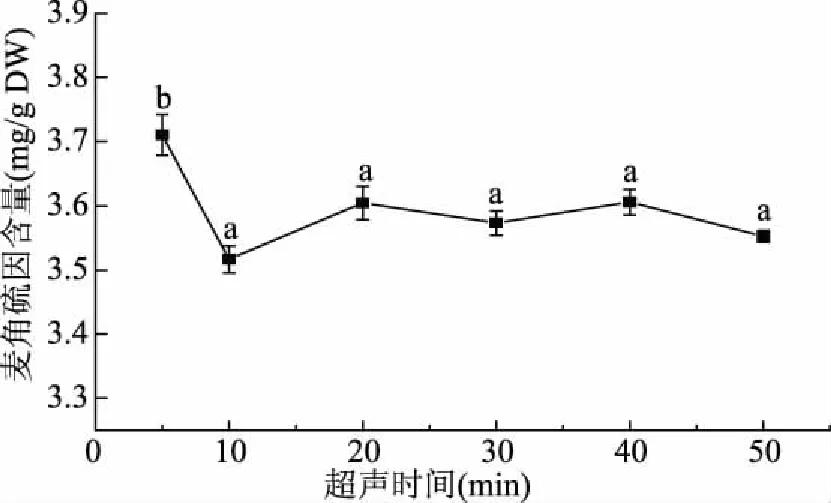
图8 超声时间对麦角硫因含量的影响Fig.8 Effect of ultrasonic time on content of ergothioneine
2.3 响应面法优化杏鲍菇麦角硫因的提取工艺
2.3.1 响应面试验结果及分析 利用Design-Expert中的Box-Benhnken对麦角硫因的提取进行优化实验设计及分析,其响应面实验方案及结果见表2,方差分析结果见表3。

表2 响应面试验结果Table 2 The results of response surface experiment
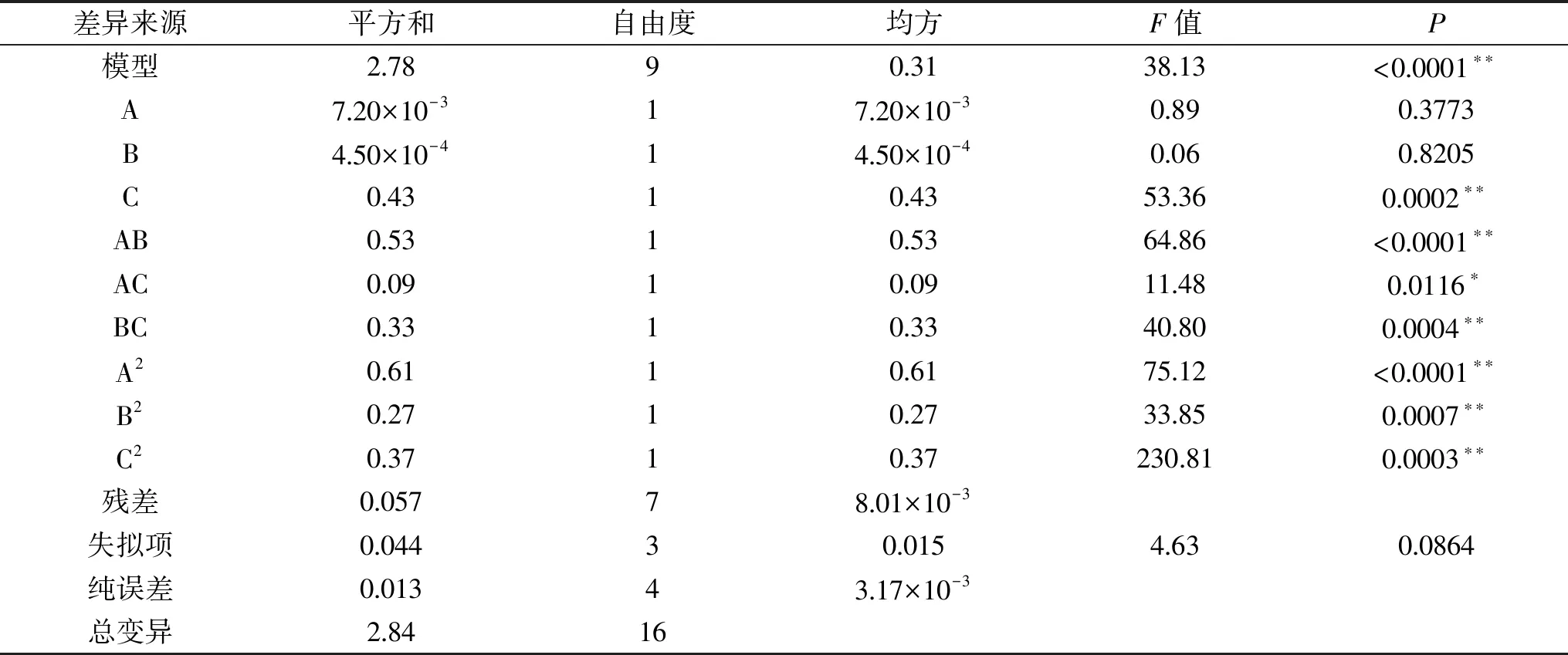
表3 方差分析结果Table 3 The results of variance analysis
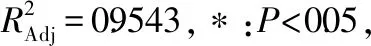
通过多元回归分析,得到二次多项式拟合方程为:
Y=-12.87+0.43A+0.15B+0.009C-2.42×10-3AB+1.52×10-4AC+1.92×10-4BC-3.80×10-3A2-1.13×10-3B2-2.95×10-5C2。
对数据进行方差分析,从表3中可以看出,多元二次模型P<0.0001,表明该回归模型是极显著的,具有统计学意义;失拟项P=0.0864(P>0.05),不显著,说明试验误差小,可以真实地反映试验的情况;决定系数R2=0.9800,表明该方程拟合度较好,可以用该模型分析和预测麦角硫因的提取量。从显著性检验项可以看出,对于响应值即麦角硫因含量,C、AB、BC、A2、B2、C2影响极显著(P<0.01),AC影响显著(P<0.05),A、B影响不显著(P>0.05)。各因素影响程度从大到小依次为C>A>B,即超声功率对提取麦角硫因影响程度最大。
响应面曲线和等高线图可以反映出交互效应的强弱和大小。响应面曲面弯曲弧度越大,两因素间交互效应越强,其相对应的等高线即越椭圆,两因素间的交互作用越强。图9~图11为两两因素之间的响应面曲线及等高线。由图9~图11可知,AB、AC、BC交互作用对于麦角硫因的提取量的影响均显著,与方差分析结果一致。
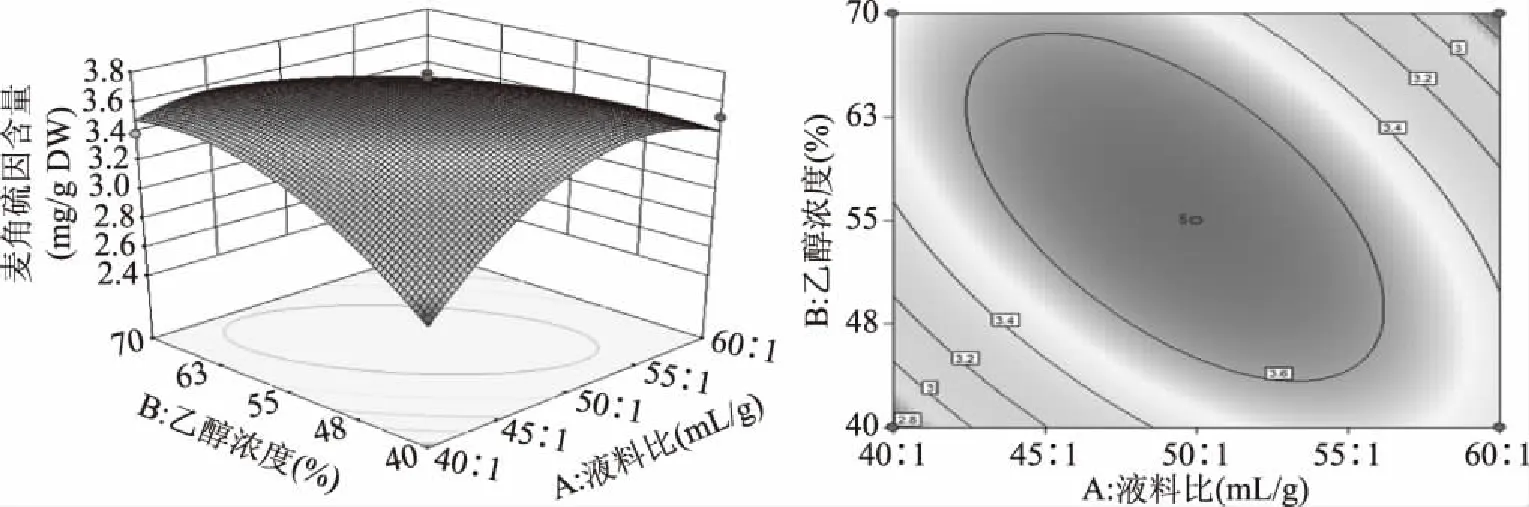
图9 液料比和乙醇浓度互作用的响应面图及等高线Fig.9 Response surface curve and contour of the interaction of liquid to material ratio and ethanol concentration
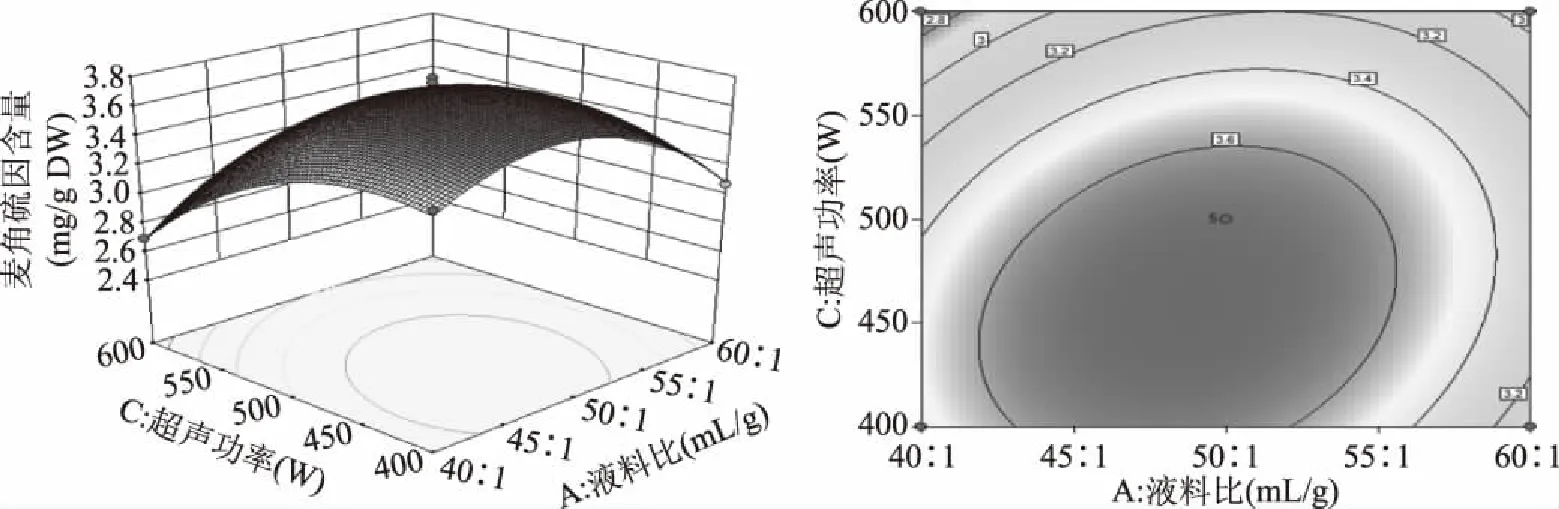
图10 液料比和超声功率的响应面曲线及等高线Fig.10 Response surface curve and contour of liquid to material ratio and ultrasonic power

图11 乙醇浓度和超声功率的响应面曲线及等高线Fig.11 Response surface curve and contour of ethanol concentration and ultrasonic power
2.3.2 最佳提取工艺条件的确定及验证 通过解回归方程,得到最佳工艺条件为:液料比48.12∶1、乙醇浓度为53.46%、超声功率447.87 W,此时麦角硫因预测值为3.78 mg/g干重。为方便实验的进行,对该条件进行细微的调整,取液料比48∶1、乙醇比为53%、超声功率450 W。使用该调整条件进行3次平行试验,所得的麦角硫因含量为(3.79±0.02) mg/g干重,与预测值(3.78 mg/g干重)误差在1%以内,证明该结果合理可靠。
3 结论
真空冷冻干燥对杏鲍菇中麦角硫因造成的损失很少,适用于对杏鲍菇进行前处理;采用经真空冷冻干燥后的杏鲍菇粉末作为原材料,运用单因素实验和响应面法对杏鲍菇麦角硫因提取工艺进行优化,确定液料比48∶1、53%乙醇、微波条件(500 W、65 ℃、5 min)、超声条件(450 W、5 min)为最佳工艺条件,该条件下可从杏鲍菇中提取得到麦角硫因(3.79±0.02) mg/g干重,与预测值误差在1%以内,得到的二次回归方程合理可靠,具有一定的可行性。本研究得到的提取方法可为食用菌中麦角硫因的提取提供参考,具有广阔的应用前景。
