白藜芦醇通过调控Keap1-Nrf2/HO-1信号通路抑制大鼠肾草酸钙结石的形成
2020-02-14邸彦橙王志龙张智慧南锡浩郭振海
邸彦橙,王志龙,张智慧,宋 静,高 强,吴 影,南锡浩,郭振海,田 河
肾结石是一种常见的泌尿系统疾病,多因晶体物质在肾脏中异常聚积所致,其中以草酸钙晶体最为常见[1]。草酸在肾脏中的积累可诱导肾脏损伤,产生大量活性氧(reactive oxygen species,ROS),进一步损伤肾小管上皮细胞,促使草酸钙晶体更易黏附于肾小管上皮细胞表面,对草酸钙结石的形成具有促进作用[2-3]。而Kelch样ECH相关蛋白1(Kelch-like ECH associated protein 1,Keap1)-核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)/血红素氧合酶 1(heme oxygenase 1,HO-1)是细胞内最为重要的一条内源性抗氧化应激途径。大量研究[4-5]显示,激活Keap1-Nrf2/HO-1信号通路可显著降低机体内ROS水平,并对维持机体内氧化/抗氧化平衡起着重要作用。白藜芦醇(resveratrol,Res)是一种多酚类化合物,常见于花生、葡萄、虎杖等植物中,具有多重生物学活性。多项研究[6-7]表明,白藜芦醇可激活Keap1-Nrf2/HO-1信号通路,发挥抗氧化作用。该研究拟采用1%乙二醇+2%氯化铵诱导法制备大鼠肾草酸钙结石模型,初步探讨Res对草酸钙结石形成的影响以及与Keap1-Nrf2/HO-1信号通路的关系。
1 材料与方法
1.1 实验动物SPF级雄性SD大鼠60只,体质量240~260 g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号:SYXK(湘)2014-0012。大鼠饲养于相对湿度50%~60%,温度(22±2)℃,通风良好的环境中,自由饮食。
1.2 主要试剂与仪器白藜芦醇,纯度≥98%,购自甘肃益生祥生物技术有限公司;Nrf2抑制剂ML385购自美国MedChemExpress公司;丙二醛(MDA)含量检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒购自北京索莱宝科技有限公司;ROS测定试剂盒购自南京建成生物工程研究所;细胞核蛋白质提取试剂盒、HRP标记的山羊抗兔IgG均购自生工生物工程(上海)股份有限公司;兔抗人Keap1单克隆抗体、兔抗人HO-1单克隆抗体、兔抗人GAPDH单克隆抗体均购自美国Cell Signaling Technology公司;Von Kossa染色试剂盒、兔抗人Nrf2多克隆抗体、兔抗人Histone H3多克隆抗体均购自英国Abcam公司;全自动生化分析仪购自美国Beckman Coulter公司;全自动数码凝胶图像分析系统购自上海天能科技有限公司;FACSCalibur流式细胞仪购自美国BD Biosciences公司。
1.3 方法
1.3.1动物造模与分组处理 60只雄性SD大鼠,适应性饲养1周后,随机分成5组,即对照组、模型组、Res低剂量组(L-Res组)、Res高剂量组(H-Res组)和Res高剂量联合Nrf2抑制剂ML385组(H-Res + ML385组),每组12只。除了对照组,其他各组均参考文献[8]采用1%乙二醇+2%氯化铵诱导法制备大鼠草酸钙肾结石模型,具体为采用1%乙二醇兑水用于自由饮水,2%氯化铵用于灌胃,每次1 ml,每日2次,连续造模4周。造模的同时进行给药处理,对照组和模型组给予等体积生理盐水灌胃,L-Res组给予40 mg/(kg·d)Res灌胃,H-Res组给予160 mg/(kg·d)Res灌胃,H-Res+ML385组在H-Res组的基础上给予30 mg/kg ML385腹腔注射,2 d/次,连续给药4周。
1.3.2尿液、血液相关指标检测 实验结束前1 d,使用代谢笼收集所有大鼠24 h空腹尿液,采用量筒测定24 h排尿量,以精密pH计测定尿液pH值,全自动生化分析仪检测尿液中Ca2+浓度,采用铬酸钾氧化甲基红催化光度法测定尿草酸(Ox)含量。实验结束前采集各组大鼠空腹静脉血,采用全自动生化分析仪检测血清中尿氮素(BUN)、肌酐(Cr)、Ca2+含量。
1.3.3Von Kossa染色观察大鼠肾脏组织草酸钙晶体形成 实验结束后断颈处死各组大鼠,取左肾石蜡包埋切片后,65 ℃恒温烘干,经二甲苯、梯度浓度乙醇脱水,滴加1%硝酸银溶液,在紫外线照射下孵育30 min,蒸馏水洗涤3次,滴加5%硫代硫酸钠孵育3 min,蒸馏水洗涤3次,置于核固红染液中孵育3 min,流水冲洗2 min,梯度浓度乙醇脱水,二甲苯透明,中性树胶封片,显微镜观察。
1.3.4大鼠肾脏组织中MDA含量与SOD活性检测 取约0.1 g右肾组织,加入1 ml蛋白抽提液,冰浴条件下碾碎,12 000 r/min离心10 min,取上清液,按照试剂盒操作说明书加入相应试剂,孵育后测各样品吸光度值,根据试剂盒操作说明书提供的计算公式分别计算MDA含量和SOD活性。
1.3.5大鼠肾脏组织中ROS水平检测 取约1 mm3右肾组织,在预冷的PBS中漂洗,加入适量胰酶消化液,37 ℃消化30 min,间断性吹打已消化组织,用预冷PBS终止消化,采用300目尼龙网过滤,收集细胞,500 r/min离心10 min,弃上清液,重悬细胞,加入10 μmol/L 荧光探针2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA),37 ℃孵育30 min,PBS洗涤2次,流式细胞仪上机检测,记录每组荧光强度值(fluorescence intensity,FI),结果以相对于对照组荧光强度值表示。
1.3.6Western blot检测大鼠肾脏组织中Keap1、Nrf2和HO-1等蛋白表达 取右肾组织,加入适量RIPA裂解液,冰上碾磨组织,12 000 r/min离心10 min,取上清液即为组织总蛋白溶液。另取部分右肾组织,根据核蛋白提取试剂盒说明书操作步骤提取肾脏组织细胞核蛋白,均采用考马斯亮蓝法测定蛋白浓度。均取20 μg蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并将蛋白转至PVDF膜上,5%脱脂牛奶室温封闭2 h,对于总蛋白检测分别加入兔抗人Keap1单克隆抗体(1 ∶1 000)、兔抗人HO-1单克隆抗体(1 ∶1 000)和兔抗人GAPDH单克隆抗体(1 ∶1 000);对于核蛋白检测分别加入兔抗人Nrf2多克隆抗体(1 ∶500)、兔抗人Histone H3多克隆抗体(1 ∶1 000),均4 ℃孵育过夜。洗涤后加入HRP标记的山羊抗兔IgG(1 ∶10 000)室温孵育1 h,ECL化学发光液孵育1 min后,使用全自动数码凝胶图像分析系统拍照观察。目的蛋白相对表达量以目的蛋白光密度值与内参蛋白光密度值的比值表示。

2 结果
2.1 Res对草酸钙肾结石模型大鼠尿液指标的影响与对照组比较,模型组大鼠24 h尿量、尿pH值降低,而24 h尿Ox含量和尿Ca2+含量增加,差异有统计学意义(P<0.05);与模型组比较,L-Res组和H-Res组大鼠24 h尿量和尿pH值增加,而24 h尿Ox含量和尿Ca2+含量降低,差异有统计学意义(P<0.05),且H-Res组优于L-Res组。H-Res+ML385组与模型组各指标比较差异无统计学意义。见表1。
2.2 Res对草酸钙肾结石模型大鼠血清生化指标的影响与对照组比较,模型组大鼠血清BUN、Cr和血Ca2+含量增加,差异有统计学意义(P<0.05);与模型组比较,L-Res组和H-Res组大鼠血清BUN、Cr和血Ca2+含量降低,差异有统计学意义(P<0.05),并且H-Res组各指标下降幅度均优于L-Res组。H-Res+ ML385组大鼠血清BUN、Cr和血Ca2+含量与模型组比较差异无统计学意义。见表2。

表1 各组大鼠24 h尿量及尿液生化指标比较
与对照组比较:*P<0.05,**P<0.01,***P<0.001;与模型组比较:#P<0.05,##P<0.01,###P<0.001
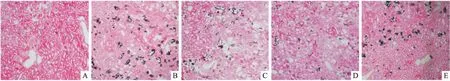
图1 各组大鼠肾脏组织Von Kossa染色 ×40

表2 各组大鼠血清生化指标比较
与对照组比较:**P<0.01,***P<0.001;与模型组比较:#P<0.05,##P<0.01,###P<0.001
2.3 Res对草酸钙肾结石模型大鼠肾脏草酸钙结晶形成的影响Von Kossa染色后草酸钙晶体呈现黑色着色,如图1所示,与对照组比较,模型组大鼠肾脏组织中黑色着色增多;与模型组比较,随着Res给药浓度的增加,L-Res组和H-Res组大鼠肾脏组织中黑色着色减少;H-Res+ ML385组与模型组比较依旧可见大鼠肾脏中存在较多的黑色着色。
2.4 Res对草酸钙肾结石模型大鼠肾脏组织氧化应激水平的影响与对照组比较,模型组大鼠肾脏组织中ROS水平、MDA含量增加,SOD活性降低,差异有统计学意义(P<0.05);与模型组比较,L-Res组和H-Res组大鼠肾脏组织中ROS水平、MDA含量降低,SOD活性增加,差异有统计学意义(P<0.05),且H-Res组优于L-Res组。H-Res+ML385组与模型组各指标比较差异无统计学意义。见表3。

表3 各组大鼠肾脏组织SOD活性、MDA含量
与对照组比较:**P<0.01,***P<0.001;与模型组比较:#P<0.05,##P<0.01,###P<0.001
2.5 Res对草酸钙肾结石模型大鼠Keap1-Nrf2/HO-1信号通路的影响与对照组比较,模型组大鼠肾脏组织中核蛋白Nrf2及全蛋白Keap1、HO-1表达减少;与模型组比较,L-Res组和H-Res组大鼠肾脏组织中核蛋白Nrf2及全蛋白Keap1、HO-1则又呈浓度依赖式上调,而H-Res+ML385组与模型组比较各蛋白表达差异无统计学意义(P>0.05)。见图2。
3 讨论
导致泌尿系统结石形成的病因可大致归纳为四个主要因素,即遗传因素、代谢因素、饮食因素和局部因素。而有关该疾病的发病机制目前还尚无定论,但从结石成分分析来看,以草酸钙为主要成分的结石占比最高,且其复发率也保持较高水平[9-10]。在草酸钙结石形成初期,高浓度草酸会刺激肾小管上皮细胞发生氧化应激反应,产生大量的氧自由基,后者可改变细胞膜磷脂选择性,促进膜表面草酸钙晶体附着及成核,形成结石[11]。此外,形成的结石可进一步损伤肾小管上皮细胞,发生氧化应激反应,进而形成恶性循环。同时,Ma et al[3]也证实,在肾结石患者体内存在较高的氧化应激水平。因此,抗氧化疗法或许能够为肾结石的预防和治疗提供新的思路。

图2 Western blot检测各组大鼠肾脏组织Nrf2、Keap1和HO-1蛋白的表达
A:Nrf2、Keap1和HO-1蛋白表达;B:蛋白相对表达量;1:对照组;2:模型组;3:L-Res组;4:H-Res组;5:H-Res+ML385组;与对照组比较:*P<0.05,**P<0.01;与模型组比较:##P<0.01,###P<0.001
目前,1%乙二醇+2%氯化铵诱导法是制备肾草酸钙结石动物模型的常用方法。乙二醇是草酸的前体物质,在体内可代谢成草酸,引起高草酸尿症,造成肾小管上皮细胞发生损伤,导致肾结石。而氯化铵可酸化尿液,促进草酸钙晶体的析出,加快肾结石的形成[12]。本研究结果显示,与对照组比较,造模后模型组大鼠尿pH值和24 h尿量均降低,而尿草酸含量、血清BUN和Cr以及尿Ca2+、血Ca2+含量均显著升高,并且肾脏组织中存在大量草酸钙晶体析出。说明肾草酸钙结石模型制备成功。而采用Res干预后,与模型组比较,Res组大鼠尿pH值和24 h尿量均升高,而尿草酸含量、血清BUN和Cr以及尿Ca2+、血Ca2+含量均显著降低,且大鼠肾脏组织中草酸钙晶体析出量减少。说明Res干预可抑制肾草酸钙结石的形成。
Res具有天然的强抗氧化能力,不仅能够抑制氧自由基的产生,还能够清除氧自由基以及抑制脂质过氧化,对多种病理状态下的氧化应激水平均有改善作用[13],提示Res抑制肾草酸钙结石形成的机制可能与其抗氧化作用有关。本研究结果显示,模型组大鼠肾脏组织中ROS水平和MDA含量显著增加,SOD活性显著降低。说明草酸钙结石模型大鼠肾脏组织确实存在较高的氧化应激水平。而Res干预后可显著降低大鼠肾脏组织中ROS水平和MDA含量,并显著提高SOD活性。说明Res可降低大鼠肾脏组织内的氧化应激水平,但在肾草酸钙结石形成过程中Res通过何种途径发挥抗氧化作用目前还未知。
Keap1-Nrf2/HO-1信号通路是近几年来新发现的机体抵抗外界氧化刺激的防御性转导通路。正常情况下,Nrf2与细胞骨架相关蛋白Keap1结合以二聚体的形式存在于细胞浆中,当受到外界氧化应激因子刺激后,Nrf2与Keap1解离并转位进入细胞核,然后通过与抗氧化应激反应元件AR相互作用,诱导抗氧化蛋白(如HO-1)等蛋白的表达,进而发挥抗氧化作用[14]。已证实,Res可激活Keap1-Nrf2/HO-1信号通路发挥抗氧化作用[6-7]。本研究结果显示,模型组大鼠肾脏组织中细胞核中Nrf2蛋白及全蛋白Keap1、HO-1表达减少,采用Res干预后核蛋白Nrf2及全蛋白Keap1、HO-1又显著上调。然而,采用ML385阻断Keap1-Nrf2/HO-1信号通路传导后,Res干预效果则被显著抑制,表明Res可能是通过激活Keap1-Nrf2/HO-1信号通路介导的抗氧化作用抑制草酸钙结石的形成。
