供核细胞对绵羊体细胞克隆效率的影响
2020-02-14郭延华徐方野李迎利张译元王立民皮文辉
郭延华,徐方野,李迎利,张译元,王立民,唐 红,皮文辉,周 平
(1.省部共建绵羊遗传改良与健康养殖国家重点实验室/新疆农垦科学院畜牧兽医研究所,新疆石河子 832000;2 .石河子市兽医卫生检疫所,新疆石河子 832000)
0 引 言
【研究意义】自从克隆动物多莉羊[1]诞生以来,相继有17种克隆动物[2-3]出现。目前克隆技术已经广泛应用于家畜育种,但效率低下制约着克隆技术的应用,这种效率的低下是由供核细胞不完全重编程和胚胎发育异常引起的。在众多影响克隆效率的因素当中,核供体细胞作为一种关键因素,不仅在类型,年龄,状态和细胞周期方面对克隆效率产生巨大的影响[4],而且制作克隆动物的原代细胞和从克隆动物身上取得继代细胞在克隆效率方面也存在差异[5]。这种差异是由供核细胞表观遗传差异引起的,成纤维细胞作为核移植供核的常用细胞,对其进行优化选择与处理在进行克隆显得十分必要。【前人研究进展】成纤维细胞的选择除了上述方面的差异之外,在不同个体之间也有较大差异[6],但绵羊依据品种有肉用、毛用、乳用方面的差异,这种差异是否会引起克隆效率的差异尚未可知。在同一供体方面,转基因细胞与原代细胞在克隆效率方面是否有差异比较有争议[7-8],但应用基因编辑技术筛选获得的同一供体细胞多个克隆株之间在克隆效率方面的差异尚未可知。成纤维细胞传代次数高并不利于克隆,而传代次数低因个各实验室操作规范不同就造成克隆效率差异较大,因此传代次数的多少与汇合法抑制时间上的处理对克隆效率影响就不得而知。【本研究切入点】前期研究发现供核细胞膜的贴壁特性对重构胚融合效率有很大影响[9],并未获得较为充分的胚胎发育数据。研究从供核细胞的静置时间与状态,传代次数与汇合期生长时间,相同来源个体和不同来源个体细胞株之间进行比较,优化供核细胞的处理与选择。【拟解决的关键问题】从供核细胞的静置时间,研究传代次数与周期处理,供核细胞不同克隆株,不同羊源细胞等,以重构胚融合率和囊胚发育率为检测指标,判定单因素供核细胞对克隆胚胎的影响。为获得更多数量的克隆胚胎材料奠定科学依据。
1 材料与方法
1.1 材 料
试剂除特别说明外,均为日本和光药业株式会社药品。M199 (GIBCO),、DMEM (GIBCO)、FCS (Hyclone),胰酶替代物 (Gbico),四孔板 (NUNC),60 mm 培养皿(NUNC),显微操作针(Narishige),石蜡油(Sigma M8410),体式显微镜(Nikon SMZ800),拉针仪 (NARISHIGE PN-30),磨针仪(NARISHIGEEG-400),煅烧仪(NARISHIGE MF-900),显微操作仪 (Eppendorf Transferman NK2),CO2培养箱(New Branswick Galaxy 170S),融合仪(Voltain EP-1 Australia),0.5 mm 融合槽(BTX)。
1.2 方 法
1.2.1 卵母细胞的采集
从新疆石河子市活畜屠宰场收集绵羊卵巢,投入生理盐水中,用0.4 L 保温壶收集卵巢后 0.5~3 h 内运回实验室。室温平衡30 min 后,清洗1次后剪去输卵管连接部及多余的结缔组织,用生理盐水再清洗3~4 次,供采卵用。刺剖法采集:简述如下,卵巢沥干放入加好采卵液(M199+0.1% BSA+0.1 mg/mL 肝素+0.1 mg/mL庆大霉素)的100 mm 培养皿中,左手持尖头眼科镊子将卵巢固定在采卵液中,右手持手术刀片将突出卵巢皮质、明亮的卵泡刺破并多剖数刀使其进入采卵液中,采完的卵巢在采卵液中轻轻晃动防止黏附。沉淀数分钟后弃去上清液,用手拉巴氏管在体式显微镜下选取形态正常、胞质均匀的卵丘卵母细胞复合体(Cumulus-oocyte complexs,COCs)进行成熟。
1.2.2 卵母细胞的成熟与处理
将采集到的COCs 用采卵液清洗2~3 遍,然后用成熟液清洗1~2 遍,放入预平衡2 h 的四孔板成熟液中 (M199+15% FBS+0.1 IU/mL FSH+0.2 IU/mL LH+1.0 μg/mL 雌二醇),培养密度80 枚/mL,培养条件为38.5℃、5%CO2、饱和湿度。体外成熟18 h 后,将扩散的颗粒细胞用移液器吹打除去,0.1%透明质酸酶消化1 min 后继续吹打以除尽颗粒细胞,用成熟液清洗2~3 次,移入预先平衡于60 mm平皿的成熟培养滴中,在体式显微镜下挑出排有第一极体的成熟卵母细胞以备用。
1.2.3 供体成纤维细胞的处理
用刀片剔除绵羊耳部边缘的绒毛,75%酒精棉球擦洗耳组织2~3 次,棉片“C”包埋耳源消毒30 sec后,用取样钳夹取耳组织投入生理盐水 (含 200 IU/mL 青霉素和220 μg/mL 链霉素)中带回实验室(运输时间:东弗里生羊 6 h 、黑头萨福克 2 h 、哈萨克羊 2 h 、澳洲白 24 h 、白头萨福克 6 h ),移入超净台用眼科剪和镊子剔除软骨组织,生理盐水清洗4~5 次,再投入75%酒精中浸15~20 s,生理盐水清洗2~3次,移入30 mm 平皿中剪碎耳部皮肤组织,组织块法培养在30 mm培养皿中,培养液为DMEM 加15% FBS。原代培养3~5 d后观察组织块贴壁和成纤维细胞迁出情况,每隔2 d换液1次。待原代成纤维细胞生长至80%~90%连成片后,用胰酶替代物消化3~5 min,用含15% FBS的DMEM 培养液 (含EGF 10 ng/mL,IGF10 ng/mL)进行传代培养,每2 d 换液1次,传1~2代之后冻存备用。
供体细胞的静置状态与处理:在前期的研究中[9],发现在15 min内有30%以上的细胞发生贴壁行为具有较好的融合性。为了进一步规范核移植操作,发现 15~30 min 内的供核细胞发生轻度的贴壁行为,而静置时间在 2 h 左右的供核细胞有超过50%以上的贴壁行为。在此区分细胞静置状态并设置分组,15~30 min 内更换1次供核细胞的处理称为悬浮组,而 2 h 左右更换1次供核细胞的处理称为贴壁组。
供体细胞的传代与汇合抑制处理:将供体细胞解冻后,3 d后生长汇集至90% 以上进行1次传代,依据试验要求将解冻后代供体细胞进行1、2、3次传代,细胞生长到平台抑制期24和48 h 收集,200 μL培养液重悬浮供体细胞,4℃保存以备用。
供体细胞单克隆株挑选:将供体细胞用胰酶替代物进行消化3 min,轻拍或圆周运动晃动30 mm培养皿,使供体细胞脱离皿底漂浮,超过消化时间(3~5 min)的供核细胞丢弃。吸出漂浮的细胞2 500 r/mim离心收集至1.5 mL EP管,100 μL 悬浮,用含10%胰酶替代物的PBS清洗液悬浮少量细胞并晃动均匀,以体式显微镜能够观察到松散分离的单个供体细胞为准,贴壁的细胞放弃种植单克隆。在超净台内的体视显微镜下,用口吸巴士玻璃管挑取表面光滑圆润的单克隆细胞,然后种入96孔板,培养皿中含有100 μL 15%FBS的DMEM培养液,3 d换液1次,观察细胞直至长满进行收集。
1.2.4 卵母细胞与供核细胞的重构
用60 mm 培养皿制作操作液(M199+25 mmol/L Hepes+20% FBS) 并覆盖石蜡油,移入显微操作台将注射针与固定针移入操作视野内。将受体卵母细胞用含7.5 μg/mL CB 的成熟液培养10 min,用巴氏管将供体细胞和卵母细胞移入操作液中进行盲吸去核,固定针吸住卵母细胞,第一极体指向12 点方向,去核针刺入剜除极体及周围少量细胞质,吐出卵母细胞质,吸取供体细胞放入11 点方向。
1.2.5 融合、激活与培养
将重构的卵母细胞-供核细胞复合体放入成熟液中恢复30 min 后,移入融合液中平衡2 min,然后把卵子放入覆盖融合液(0.3 mol/L 甘露醇+0.5 mmol/L Hepes+0.1 mmol/L CaCl2+0.1 mmol/L MgCl2) 的融合槽电极之间,调整细胞膜的接触面与电极平行,施加直流电脉冲,融合参数根据试验调整脉冲场强125 V,脉冲次数2 次,脉冲时程20 μs。每批5~8 枚/次,操作完后卵子/供核细胞复合体放入培养液,30~60 min 后观察融合情况,剔除没有融合的复合体。放回培养箱内继续培养,从重构胚融合完计时2 h 后进行激活,激活液与激活时间分别为7%乙醇7 min、2 μmol/L 6-DMAP 4 h,激活完毕后移入SOFaa清洗3 遍。38.5℃、5% CO2、饱和湿度培养,培养7 d 后检查囊胚率并统计。
1.3 数据处理
试验数据用SPASS18.0 进行卡方或方差检验,P<0.01为差异极显著;0.01
2 结果与分析
2.1 供体细胞的悬浮状态对重构胚体外发育的影响
研究表明,在融合率方面,贴壁组2 h更换1次供核细胞的融合效率比悬浮组15~30 min更换1次供核细胞的融合效率要低,差异极显著(78.84% vs 90.10%)(P<0.01),但囊胚率差异不显著(15.58%vs 14.65%)(P>0.05)。表1
表1 供核细胞的静置状态下重构胚体外发育变化
Table 1 Effect of statical state on development of reconstructed embryos in vitro
2.2 复苏的供体细胞传代次数和汇合期抑制时间对克隆胚体外发育的影响
研究表明,在融合率方面,供体细胞生长汇合24和48 h时的差异不显著(70.37%、76.03%、71.92%vs 72.97%)(P>0.05)。在囊胚率方面,解冻的供核细胞d2代比d1代高(9.06% vs 5.96%),但差异不显著(P>0.05);d3代比d2代高(15.85% vs 9.06%),差异显著(P<0.05);d3组与d1组相比(15.85% vs 5.96%)差异极显著(P<0.01)。而d3组,平台期抑制48 h的供核细胞组囊胚率比抑制24 h的供核细胞组囊胚率高(20.16% vs 15.85%),但差异不显著(P>0.05)。表2
2.3 同一细胞不同克隆株对克隆胚胎发育的影响
研究表明,同一供体(东佛里生羊)早期原代细胞挑选2个96孔板即192个单克隆株培养后,其中7株具有较好的传代性。在制作重构胚时,供核细胞在融合方面存在显著(P<0.05)或极显著(P<0.01)的差异性,但无规律可寻。在囊胚率方面,供核细胞对囊胚率的贡献表现为显著(P<0.05)或者极显著性(P<0.01),但无规律可寻。表3
表2 供核细胞的传代和汇合期G0/G1抑制时间下重构胚发育变化
Table 2 Effect ofpassages and G0/G1 phase period of confluency cell on development of reconstructed embryos in vitro
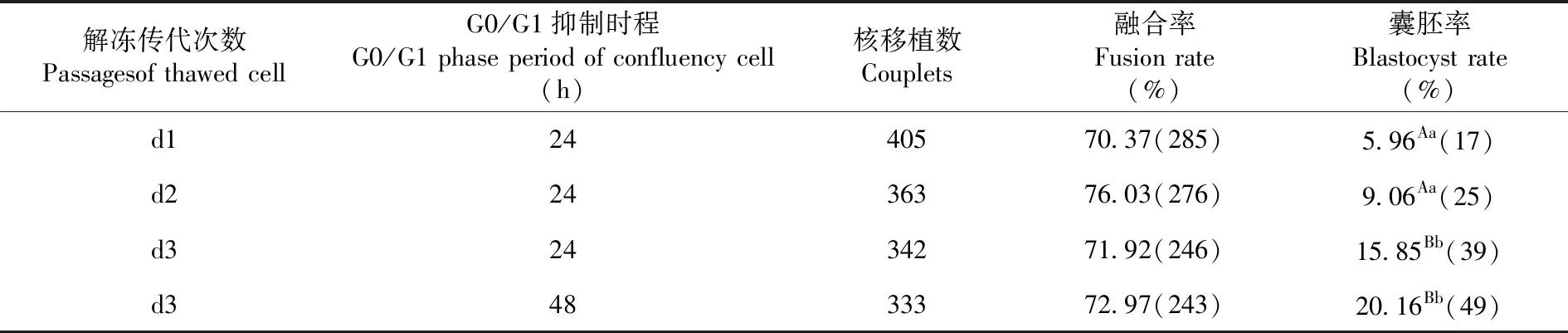
解冻传代次数Passagesof thawed cell G0/G1抑制时程G0/G1 phase period of confluency cell(h)核移植数Couplets融合率Fusion rate(%)囊胚率Blastocyst rate(%)d12440570.37(285)5.96Aa(17)d22436376.03(276)9.06Aa(25)d32434271.92(246)15.85Bb(39)d34833372.97(243)20.16Bb(49)
表3 同一细胞不同克隆株下重构胚体外发育变化
Table 3 The developmental of reconstructed embryos in vitro from Different line of mono adult fibroblast cell
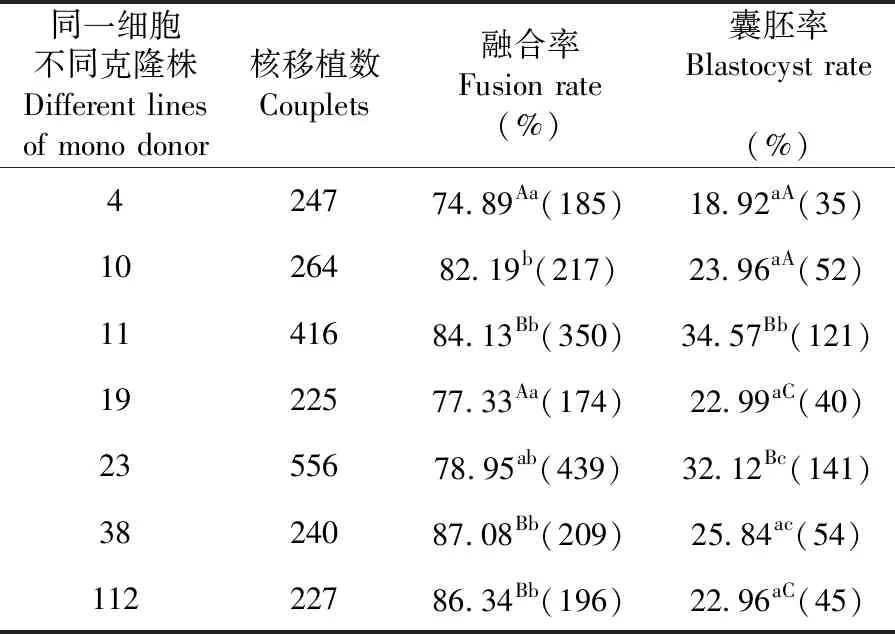
同一细胞不同克隆株Different lines of mono donor核移植数Couplets融合率Fusion rate(%)囊胚率Blastocyst rate(%)424774.89Aa(185)18.92aA(35)1026482.19b(217)23.96aA(52)1141684.13Bb(350)34.57Bb(121)1922577.33Aa(174)22.99aC(40)2355678.95ab(439)32.12Bc(141)3824087.08Bb(209)25.84ac(54)11222786.34Bb(196)22.96aC(45)
2.4 不同供体羊细胞株对克隆胚胎发育的影响
研究表明,由不同供体羊建立的细胞株,在细胞直径方面存在差异性,在融合率方面存在极显著的差异性(P<0.01)。在囊胚率方面,肉羊重构胚囊胚率极显著(P<0.01)高于其他品种的囊胚率。表4
3 讨 论
目前用于构建克隆动物和胚胎的供核细胞主要有乳腺上皮细胞[1]、颗粒细胞[10]、输卵管上皮细胞、幼龄或成年动物成纤维细胞[11-12],以及小鼠脑组织细胞[5]。但在这些供核细胞建立时,每种细胞都有自己的培养特性和传代特性,尤其是2种类型以上的细胞在同一组织中,在细胞建系时通常用到差速贴壁法建立并纯化细胞[13],在早期的研究中依据该原理发现成纤维细胞通过差速消化获得的供核细胞对重构胚的融合率有影响[8],后来通过进一步的研究发现在贴壁效率上有差异的供核细胞其生长曲线也有差异性[9],因此,试验进一步规范操作过程,发现15~30 min内悬浮的供核细胞用于重构胚的融合效率极显著高于长时间静止在操作液中的供体细胞制作重构胚的融合效率。推断重构胚的融合效率与供核细胞在短时间内的细胞膜贴壁粘性有较大的关系,而长时间的静置造成供核细胞膜粘性降低,而不利于couplets细胞膜的融合,但与克隆胚胎的囊胚率没有显著的相关性。
表4 不同供体羊细胞株下克隆胚胎发育变化
Table 4 The developmental of reconstructed embryos in vitro from Different line of multiple adult fibroblast cell
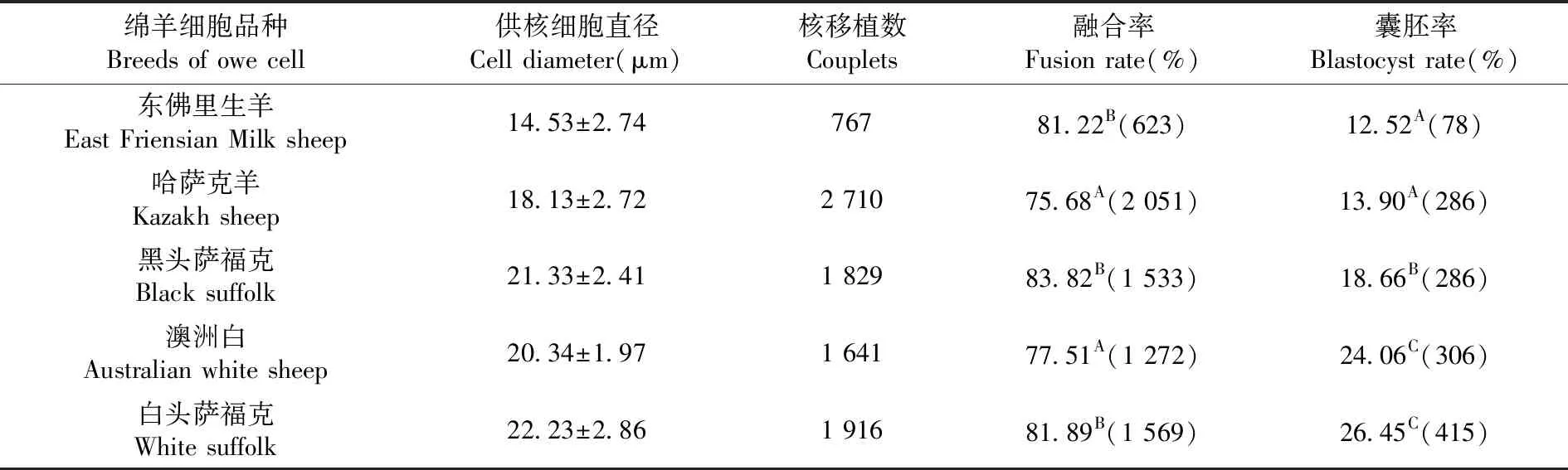
绵羊细胞品种Breeds of owe cell供核细胞直径Cell diameter(μm)核移植数Couplets融合率Fusion rate(%)囊胚率Blastocyst rate(%)东佛里生羊East Friensian Milk sheep14.53±2.7476781.22B(623)12.52A(78)哈萨克羊Kazakh sheep18.13±2.722 71075.68A(2 051)13.90A(286)黑头萨福克Black suffolk21.33±2.411 82983.82B(1 533)18.66B(286)澳洲白Australian white sheep20.34±1.971 64177.51A(1 272)24.06C(306)白头萨福克White suffolk22.23±2.861 91681.89B(1 569)26.45C(415)
供核细胞在生长阶段G0、G1、S、G2/M期中、G1期停留的时间较长,为了使核移植供核细胞达到同期化,主要有血清饥饿法和生长汇合抑制法。多数研究人员支持血清饥饿处理法[14]以提高G0/G1期中G0期供核细胞比例,而生长抑制法并不能显著提高G0的供核细胞比例[15],却是G1期细胞比例增加。随着传代次数的增加,这种处理不仅增加了染色体的异常率,而且会降低克隆胚胎和动物的制作效率[16],同时血清饥饿法随着血清饥饿时间的增加,会逐渐引起供核细胞的凋亡和克隆囊胚凋亡小体比例增加[17-18],因此,降低传代次数,如何改善供核细胞以提高效率就成为一个重要的问题。通过试验发现,解冻的早期供核细胞随着传代次数的增加其重构胚囊胚率越来越高,尤其是增加汇合期生长时间,囊胚率有渐进性的提高,推测随着汇合期生长时间的延长能够提高G1期细胞的比例。Sangho Roh等[16]研究供核细胞随着汇合时间的延长,G1期的细胞比例有所增加,而LiBing Ma等[19]用改进的先汇合再饥饿法也有提高G0/G1期细胞比例从而改善克隆效率,这就表明汇合期增加供核细胞接触抑制的时间能促进重构囊胚的发育。此外目前的观点认为传代次数的增加不利于提高克隆效率,但Chikara Kubota等[20]将体细胞连续传代后再进行血清饥饿反而提高了克隆动物的效率,换句话说这是否解释为原代细胞或者解冻细胞通过短暂的几次传代能够得到改善,但不是因为传代多次染色体的异常而提高了克隆囊胚的效率[21],上述试验证实这种假设是成立的。此外值得注意的是生长期阶段的细胞通过控制时间差拍打法(shake-off,30~60 sec at medium speed)也能够获得较高G1期的细胞比例[16],从而促进克隆效率。
生长状态良好的细胞不仅表现出良好的传代贴壁特性,而且后期凋亡的细胞数量也小[9]。同时随着短暂传代次数的增加也逐渐表现出供体细胞对克隆囊胚的贡献特性如试验2结果。对于单细胞克隆株,依据观察记录来看,传代过程中尤其需要注意定时、及时更换液体以除去早期凋亡、生长能力差或者衰老的细胞。在制作转基因克隆动物时,不论是那种转基因方法,单一细胞的稳定遗传信息更有助于研究,那么同一细胞不同细胞株之间是否有差异,通过研究发现,同一成纤维细胞来源不同单细胞株之间不仅在融合方面表现出较大的差异性,而且在重构胚囊胚率方面也表现出较大的差异性,这就进一步表明同一供核细胞株在传代过程中,更多因为人为的因素而造成细胞株之间的差异性,但也有研究表明转基因与否并不影响克隆动物的获得[22]。此外试验结果也表明,融合特性较好的供体细胞组在囊胚率方面也稍微高于融合特性较差的细胞组,但不排除融合特性差的供体细胞能够获得较多数量的克隆囊胚。
在同一细胞来源不同单细胞株之间进行了比较,而且在不同个体羊建立的细胞株之间也进行了比较。结果表明,不同品种的羊不仅在供核细胞直径方面是有差异性的,而且在重构胚制作效率方面也具有差异性。在制作重构胚时,因供核细胞的选择具有较大的随意性,与操作人员有很大的关系,也直接影响着克隆胚的效率,研究表明,进行小中大区分的供核细胞中,同批次细胞直径越小的细胞G1期(生长汇合法)或者G0(血清饥饿法)比例越高[15],这就解释了重构胚囊胚率差异较大的试验现象。此外,Nisar A也发现不同个体之间的供体细胞在克隆效率和动物妊娠方面存在较大的差异[23-34]。克隆胚效率不仅受到细胞直径(或人为判断)的影响,而且受到供体细胞株本身的影响,研究中,肉羊细胞株的克隆效率高于其他品种绵羊细胞株的克隆效率,进一步讲这是否说明克隆效率是否与采样时供体的营养水平或肉用品种有直接关系有待进一步证实,但可以肯定的是克隆胚效率的高低具有较大的随机性。
4 结 论
复苏的供核细胞经过短暂的3次传代,延长汇合期细胞生长时间至48 h,在操作液中短时间(15~30 min)的静置,为避免细胞培养时的人为因素,同批次供核细胞或不同个体多选择几株供核细胞更有利于克隆胚的制作,可以获得较多数量的克隆胚。
