辣椒素对消化系统肿瘤防治的研究进展
2020-02-14马乃箐陈世钻俞富祥
马乃箐, 陈世钻, 俞富祥
马乃箐, 陈世钻, 俞富祥, 温州医科大学附属第一医院肝胆外科 浙江省温州市 325000
核心提要: 目前辣椒素(capsaicin, Cap)进行预防和治疗肿瘤是目前研究的热点, 其抗肿瘤作用机制复杂, 可引起肿瘤细胞增殖抑制、凋亡、自噬, 抑制肿瘤细胞迁移及侵袭, 抗血管生成, 以及增加其他化疗药物疗效等作用, 是抗肿瘤的潜在药物, 具有广阔前景.本文就Cap对消化系统肿瘤的防治作用及机制进行综述.
0 引言
辣椒素(capsaicin, Cap)是辣椒中的主要辛辣成分, 为香草酰胺衍生物, 它在辣椒中的含量为0.1%-1%, 约占Cap类物质的70%.Cap的热稳定性高, 通常条件下晶体颜色为白色, 针状微晶体, 无毒性, 但刺激性强.随着分子生物学的发展, 近年来, 对于Cap在肿瘤防治方面的研究更是引起了广泛关注.许多研究表明, Cap在非小细胞肺癌、乳腺癌、结肠癌、肝癌(hepatocellular carcinoma,HCC)和前列腺癌等多种恶性肿瘤细胞系中都显示了较强地抗肿瘤作用[1,2].本文就Cap对消化系统肿瘤防治作用及机制的相关研究进展进行综述.
1 Cap抗肿瘤机制
近年来国内外研究结果表明, Cap可通过抑制肿瘤细胞增殖、诱导肿瘤细胞周期阻滞、促进肿瘤细胞凋亡、抑制肿瘤细胞迁移、侵袭和转移及抑制肿瘤血管生成、调控肿瘤细胞自噬和增加抗癌药物的敏感性[3-7], 从而产生抗癌的生物活性.有研究发现, 肿瘤相关的NADH氧化酶(tumor-associated NADH oxidase, tNOX)是Cap的细胞靶点, Cap与tNOX结合, 并触发tNOX的蛋白酶体降解, 减少还原的NADH转化为氧化的NAD+, 从而抑制NAD+依赖的SIRT1去乙酰化酶, 最终致使c-Myc和p53的乙酰化水平增强, 从而抑制G1细胞周期蛋白/周期蛋白依赖性激酶(cyclin-dependent kinases, CDK)复合物的激活, 并触发癌细胞的细胞周期阻滞, 抑制肿瘤细胞增殖[3].Lin等[4]研究报道, Cap能通过增加自噬标志物LC3-Ⅱ和Atg5水平, 明显降低自噬特异性底物p62和Fap-1的表达, 并增加半胱氨酸天冬氨酸蛋白酶3(caspase-3)活性诱导细胞凋亡, 产生抑制人鼻咽癌细胞的生长并诱导自噬的疗效.Chakraborty等[5]发现, Cap通过诱导p53-SMAR1自调节环, 下调非小细胞肺癌血管内皮生长因子(vascular endothelial growth factor, VEGF), 从而抑制血管生成.Xu等[6]报道, Cap是一种强效的瞬时受体电位型(transient receptor potential vanilloid type 1, TRPV1)激动剂, Cap可通过调节TRPV1通道抑制人甲状腺乳头状癌细胞的转移.还有报道指出Cap通过激活膀胱癌细胞上的TRPV1诱导S期阻滞, 提高了吡柔比星(一种蒽环类药物)的化疗疗效, 产生协同抗癌的活性[7].总而言之, Cap可通过多种机制发挥其抗肿瘤活性, 本文就将探讨Cap在消化道肿瘤中的防治进展及机制.
2 Cap与消化道肿瘤
2.1 Cap与食管癌 食管癌是世界上最致命的恶性肿瘤之一, 因为缺乏早期临床症状, 在诊断时往往已是食管癌晚期.与此同时也越来越多地采用由新辅助放化疗和食管切除术联合的治疗方式.而天然生物制剂已被用作辅助治疗, 以减轻化疗或放疗的副作用, 并提高癌症患者的生活质量.众所周知, 基质金属蛋白酶(matrix metalloproteinase, MMP)家族参与细胞外基质(extracellular matrix, ECM)的降解.其中, MMP家族的MMP-2和MMP-9在肿瘤侵袭转移过程中具有降解Ⅳ型胶原的作用, 促进肿瘤细胞的迁移.Guo等[8]报道, Cap不仅能抑制食管鳞癌的增殖, 还能通过激活腺苷酸活化蛋白激酶(adenosine 5'-monophosphate-activated protein kinase, AMPK)-抑制核因子κB(nuclear factor-κB, NF-κB)信号通路, 从而下调MMP-9的表达, 抑制食管鳞癌的迁移与侵袭, 从而通过抑制食管癌细胞增殖及浸润侵袭而达到抗癌作用.
2.2 Cap与胃癌 胃癌(gastric cancer, GC)是癌症死亡的第三大原因[9], 外科手术目前被认为是唯一的根治性治疗方法, 且早期GC术后5年生存率可达95%.虽然随着内镜技术的发展, 早期GC的诊断率上升, 但其早期诊断率仍是偏低, 多为晚期疾病, 错过了最佳手术时机.因此,晚期GC的主要治疗方法是新辅助放化疗、分子靶向治疗和免疫治疗相结合的联合治疗方式.Fei等[10]研究报道, 在MGC-80以及SGC-7091 GC细胞系中, Cap可以重新激活GC细胞中低表达的表观遗传调控酶(h-males absent on the first, hMOF), 提高其蛋白表达量并催化组蛋白H4K16乙酰基化的酶活性, 从而抑制GC细胞的增殖.有研究发现, 人类GC细胞中Pit-Oct-Unc(POU)域转录因子(POU domain, class 3, transcription factor 2,POU3F2)超表达可上调tNOX的表达, POU3F2介导的tNOX表达不仅缩短了细胞倍增时间, 还可增强细胞迁移和侵袭; 而Cap则通过抑制POU3F2的表达起到抑制GC细胞的增殖及迁移侵袭的作用[11].Meral等[12]报道,Cap不但具有明显的抗癌作用, 还可以增强GC细胞对化疗药5-氟尿嘧啶(5-flourouracil, 5-FU)的敏感性, 从而减低有效5-FU的使用剂量, 减少化疗副反应, 提高GC患者生活质量.
2.3 Cap与结直肠癌 结直肠癌(colorectal cancer, CRC)发病率排名第三, 但死亡率排名第二[9], 许多无法切除的患者接受无症状原发性肿瘤的手术, 有证据表明这通常是无效的干预, 故而全身性化疗是转移性CRC患者的主要治疗手段, 但也存在疗效不持久、毒副作用有限等缺点, 寻找更多的低毒性、少副作用的化疗药正是未来的目标.Caspases是一类半胱氨酸蛋白酶, 在细胞凋亡的执行阶段起核心作用[13].祝丽丽等[14].报道, Cap通过抑制肿瘤细胞中热休克蛋白27的表达, 从而促进了细胞色素C从线粒体释放到细胞质中, 进而激活了凋亡关键因子caspase-3介导的凋亡途径, 对裸鼠体内CRC HT-29细胞移植瘤的生长产生抑制作用.Caetano等[15]报道, Cap可抑制1, 2-二甲肼诱导的细胞毒性和基因毒性, 其作用是通过表达结肠粘膜上参与细胞凋亡、细胞周期抑制和细胞/组织分化的基因, 促进抗增殖和促凋亡反应.Clark等[16]发现, Cap与3, 3'-二吲哚甲烷在人类中的协同抗癌作用.
2.4 Cap与HCC HCC在全球病例中排名第五, 在男性死亡中排名第二[9], HCC有放化疗、介入治疗、外科手术治疗、肝移植等综合治疗的手段, 但患者仍需要新的治疗方案, 使用天然化合物可能为患者提供更好的结果, 更低的系统毒性和更少的副作用, 改进的治疗可以导致更好的预后.Chen等[17]研究报道, 抑制自噬可增强Cap诱导的人HCC细胞凋亡, Cap可以在HCC细胞中触发活性氧(reactive oxygen species, ROS)的生成, 并破坏线粒体膜电位, 促进HCC细胞凋亡, 同时刺激活性氧清除剂n -乙酰半胱氨酸(N-acetyl-cysteine, NAC)的作用, NAC消除了Cap对信号转导子和转录3依赖性自噬的影响, 从而增强人HCC细胞凋亡.Bu等[18]亦有类似发现, Cap通过ROS生成和激活JNK和p38 MAPK通路诱导HCC细胞SMMC-7721凋亡.并且在Cap诱导HCC凋亡的同时, 还能增强化疗药物的敏感性.Dai等[19]报道, Cap与索拉非尼联合处理HCC细胞LM3系, 增加凋亡相关的关键蛋白caspase 3、Bax和聚腺苷二磷酸核糖聚合酶[the poly(ADP-ribose) polymerases, PARPs]活性,抑制抗凋亡蛋白(B cell lymphoma-2, Bcl 2), 通过上调自噬相关基因beclin 1和LC3A/B Ⅱ的水平, 促进特殊自噬蛋白P62降解, 显著增强了凋亡的诱导作用; 其联合还可通过上调钙粘蛋白E、下调钙粘蛋白N、波形蛋白、MMP-2和MMP-9来抑制癌细胞的侵袭和转移.
2.5 Cap与胆管癌 胆管癌是最难治愈的恶性肿瘤之一.转移是一个重要的影响预后因素, 它妨碍了根治性手术切除, 且对目前可用的化疗药物具有耐药性, 故寻找一种新的抗癌药物迫在眉睫.Wutka等[20]研究发现, Cap通过阻断Hedgehog基因通路的激活, 可降低人胆管癌细胞的生存能力, 诱导细胞凋亡; 与此同时, 还可抑制人胆管癌细胞的迁移、侵袭和集落形成, 破坏人胆管癌细胞系上皮间质转化.Lee等[21]报道, Cap通过抑制AMPK-SIRT1和AMPK-IκBα信号通路抑制核转录因子NF-κB p65, 随后导致MMP-9表达被抑制, 从而抑制胆管癌细胞的迁移和侵袭.Hong等[22]发现, 胆管癌细胞对5-FU的耐药性(multi-drug resistance, MDR)可能与自噬有关, 而Cap可以通过激活胆管癌细胞的自噬的关键调控因子(protein kinase B/mammalian target of rapamycin, Akt/mTOR)通路,抑制5-FU诱导的自噬, 从而增强胆管癌的药物敏感性.
2.6 Cap与胰腺癌 胰腺腺癌对目前所有的抗癌治疗方法都具有高度的耐药性, 因此有必要采用促进细胞死亡的新方法.Zhang等[23]实验报道, Cap是胰腺癌细胞PANC-1细胞生长的抑制剂,通过激活caspase-3胰腺癌细胞PANC-1细胞凋亡; 与此同时还发现另一个通路, 磷酸肌醇激酶3/Akt(The phosphoinositide 3-kinase/Akt, PI3K/Akt)通路, Cap诱导的细胞凋亡还可能与Cap致使PI3K/Akt通路的下调有关.还有研究报道[24], Cap通过抑制核转录因子NF-κB的表达, 下调多耐药基因MDR1的表达,最终使胰腺癌细胞膜上的多耐药蛋白P-糖蛋白表达下降, 使化疗药物的外排作用减弱, 药物在细胞内的浓度增加, 从而增强了吉西他滨化疗效果.
3 结论
综上所述, 对于消化道肿瘤而言, Cap主要是通过抑制增殖、促进凋亡、促进自噬、抑制迁移和侵袭、增加抗癌药物的敏感性等多种途径产生了抗消化道肿瘤的作用(图1).在Cap抗不同消化道肿瘤机制中可发现许多重复出现的Cap发挥作用的靶点, 比如凋亡关键因子caspase 3、核转录因子NF-κB.凋亡关键因子caspase 3是Cap发挥其致使肿瘤细胞凋亡的重要关键因子, Cap激活caspase 3, 启动肿瘤细胞的凋亡通路, 从而引起肿瘤整体的生长抑制与凋亡.核转录因子NF-κB具有多条下游通路, 下调MMP-9的表达, 从而抑制肿瘤细胞的迁移与侵袭; 还可下调多耐药基因MDR1的表达, 增强肿瘤细胞对化疗药物敏感性.这或许就是Cap可应用于临床的通路.
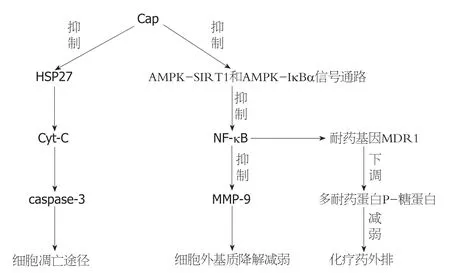
图1 Cap的作用途径.Cap: 辣椒素; AMPK: 腺苷酸活化蛋白激酶; NF-κB: 抑制核因子κB; MMP: 基质金属蛋白酶.
Cap是良好的癌症预防和治疗的潜在药物, 具有广泛的应用前景.与许多昂贵的、副反应大的传统化疗药物相比, Cap及其衍生物作为世界普遍使用的香辛料, 具有成本低、毒性小、取材方便的优点, 且能从多个方面及机制发挥其抗消化系统肿瘤的作用.然而Cap抗消化系统肿瘤作用机制十分复杂, 目前确切的机制尚未完全清楚, 还需深入研究, 立足已知的Cap靶点, 深入探究其有效机制, 才可将Cap及其衍生物作为新辅助化疗药物引入临床.因此, 未来的研究方向是更加全面系统地阐明Cap抗肿瘤作用的具体有效的机制, 细化到其分子机制, 进一步的探索如何应用Cap使其发挥最大抗肿瘤活性, 直至全面地应用于临床, 让“谈癌色变”成为历史.
