土著AMF与氮形态对辣椒||菜豆间作系统植株氮利用及其影响因素研究*
2020-02-13刘圆圆赵乾旭张乃明宗庆富夏运生
刘圆圆, 赵乾旭, 邓 曦, 王 豹, 张乃明, 宗庆富, 夏运生
土著AMF与氮形态对辣椒||菜豆间作系统植株氮利用及其影响因素研究*
刘圆圆1,2, 赵乾旭1, 邓 曦3, 王 豹1,2, 张乃明1,2, 宗庆富1, 夏运生1,2**
(1. 云南农业大学资源与环境学院 昆明 650201; 2. 云南省土壤培肥与污染修复工程实验室 昆明 650201; 3. 厦门安防科技职业学院 厦门 361000)
近年来设施辣椒连作障碍日益突出, 其中氮肥的大量不合理施用和高残留是限制辣椒高产、优质栽培的主要因素之一。研究土著丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)与间作体系强化蔬菜对不同形态氮(N)的利用并结合土壤菌丝密度、N形态及酶活性的反馈作用, 可为设施土壤N素的高效利用和降低土壤N残留提供依据。本研究采用盆栽试验, 设置辣椒||菜豆间作和各自单作种植模式, 不同AMF处理[不接种(NM)、接种土著AMF]和不同形态N处理[不施N(N0)、无机氮(碳酸氢铵120 mg·kg-1, ION)和有机氮(谷氨酰胺120 mg·kg-1, ON)], 探讨了设施条件下接种土著AMF、施用不同形态N与间作对辣椒、菜豆根围土壤菌根建成、酶活性及N利用的影响。结果表明, 与NM相比, 接种土著AMF使设施辣椒、菜豆植株生物量及N吸收量显著增加(除菜豆单作-ON处理), 显著降低土壤NH4+-N、NO3--N含量。无论施用何种形态N, 均显著增加辣椒、菜豆植株生物量(除菜豆单作-AMF处理)及N吸收量, 表现为ON>ION。与单作-ON-AMF处理相比, 间作-ON-AMF处理下的辣椒N吸收量显著增加39.9%、菜豆N吸收量显著增加93.0%。对N利用影响因子的分析结果表明, 间作协同接种土著AMF较大程度上增加了土壤有机质含量及蛋白酶、脲酶、硝酸还原酶活性。相关性分析显示, 辣椒、菜豆植株N吸收量与AMF侵染率呈极显著正相关关系, 而土壤NH4+-N和NO3--N含量则与AMF侵染率呈现一定的负相关关系。此外, 土壤蛋白酶、脲酶和硝酸还原酶活性与辣椒、菜豆植株N吸收量呈正相关关系。可见, 所有复合处理中, 以间作体系接种土著AMF与施用适量有机氮的组合明显促进了设施辣椒、菜豆生长和N素利用。
土著AMF; 氮形态; 间作; 辣椒; 菜豆; 氮素利用
氮(N)素在作物产量和品质形成中起着关键作用[1], 我国设施条件下作物化肥投入量远高于露地, 按照各作物单位面积化肥用量排序, 设施辣椒位居前列, 而氮肥表观利用率平均仅10%左右[2]。土壤-植物系统中高含量硝态氮残留不仅造成施氮增产效应不明显、作物品质下降, 导致农户习惯施肥条件下N素大量损失及氮肥利用率降低[3], 而且大量无法利用的N素以淋溶或径流的形式流失, 污染地表和地下水[4]。因此, 提高土壤N素利用率成为当前农业领域的研究热点[3]。
大量研究表明, 丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是土壤中与植物关系最为密切的微生物之一, 能够与地球上80%的植物根系形成共生关系[5], 并能帮助寄主植物获取根围土壤不同形态N素养分[6-8], 减少因淋溶或反硝化导致的N素损失[9]。同时, 能改善土壤酶活性, 进一步强化寄主植物对无机氮的吸收和有机氮的矿化等, 而促进植物的生长发育[10-11]。豆科(Leguminosae)||非豆科作物间作模式运用不同作物吸收利用土壤不同养分的特点, 充分发挥间作优势, 结合豆科植物生物固氮的优点, 合理的作物搭配将强化豆科的生物固氮作用[12], 并对间作作物的N利用产生重要影响[13-14], 同时减少化学氮肥施用量。另外, 间作可以通过伴生作物根系分泌物释放化感物质, 从而影响土壤酶活性[15-16], 促进植物对速效养分的吸收利用。
目前, 菌根技术在间作土壤N吸收利用方面的研究受到广泛关注。赵乾旭等[17]在紫色土上研究了接种与间作大豆(L. Merr.)对玉米(L.)生长的影响, 发现菌根真菌能强化玉米的种间竞争能力, 提高了N素获取能力而促进植物生长。相关研究表明, AMF可以提高辣椒(L.)栽培土壤脲酶等N素转化相关酶活性[18], 加速土壤中有机态氮的转化, 为辣椒生长发育提供充足的N素养分。Anitha等[19]证实辣椒与菜豆(L.)间作后, 辣椒N、P、K吸收量明显增加。但关于土著AMF与N形态对辣椒||菜豆植株生长、N利用及主要土壤影响因素方面的研究尚鲜见报道。基于此, 本文以设施条件下辣椒||菜豆间作种植模式为研究对象, 研究了不同形态N施用对间作作物接种土著AMF后植株生长、N利用与菌根特征、土壤酶活性及速效氮等因素间的关系, 以期探讨土著AMF和间作对土壤酶活性及不同形态N的影响, 反过来揭示其协同强化辣椒、菜豆对土壤N素转化利用的贡献与效应。
1 供试材料与方法
1.1 供试材料
供试土壤为紫色土, 采集于昆明市滇池流域宝象河水库附近坡耕地。其土壤基本理化性质为pH 7.75, 有机质18.68 g∙kg-1, 全氮0.88 g∙kg-1, 碱解氮40.25 mg∙kg-1, 有效磷23.27 mg∙kg-1, 速效钾92.17 mg∙kg-1。经自然风干后磨碎, 过2 mm筛, 混匀后装入灭菌袋中进行高压蒸汽灭菌(121 ℃间歇灭菌2 h), 置于牛皮纸上晾置2~3 d, 然后装入密封塑料袋中备用, 避免微生物污染。
供试植物辣椒为‘绿先锋215’、菜豆为‘太空地豆王’, 均购买于云南省昆明市小板桥种子交易市场。挑选籽粒均匀饱满的种子, 用10% H2O2进行表面消毒10 min, 再用蒸馏水冲洗多次, 然后置于放有湿润定量滤纸的培养皿中, 于25 ℃恒温培养箱中催芽2 d后播种。
供试土著AMF采集于云南省昆明市官渡区小哨乡坡耕地(102°96′E, 25°16′N, 坡度为8°)玉米||大豆间作试验田间根围土壤, 本试验所用菌根菌剂是以高粱[(L.) Moench]和苜蓿(L.)为寄主植物, 以紫色土、粗砂和细沙按3∶1∶1比例混合均匀经过121 ℃湿热间歇灭菌2 h后的混合基质, 接种间作根围土壤培育5个月收获后获得包含菌根真菌孢子和植物根段的扩繁菌剂, 其中每100 g菌剂约含有1.0×103个真菌孢子。
供试N化合物均为分析纯, 无机氮选用碳酸氢铵, 有机氮选用谷氨酰胺。种植容器为5 L白色塑料花盆, 洗净晾干, 在塑料袋及花盆上统一编号。
1.2 试验设计
试验于2017年5—8月在云南农业大学科研大棚内进行, 大棚内昼夜温度分别为(23±3) ℃和(17±2) ℃, 采用自然光照, 用称重法确保土壤含水量。本试验设置种植模式、接种方式和施氮处理3因素, 共涉及辣椒单作、辣椒||菜豆间作和菜豆单作3种种植方式和2种菌根处理[不接种AMF(NM)、接种AMF], 同时设不添加N、添加无机氮和添加有机氮共3个处理, N添加量为120 mg∙kg-1, 分别用N0、ION和ON表示。共计18个处理, 每个处理重复4次, 共72盆。
试验所用花盆先用塑料袋衬于花盆内壁, 之后装土, 共装土4 kg。每个花盆盛装底层土2.6 kg, 中间土层装入0.9 kg灭菌土, 其中土著AMF处理每盆添加100 g菌剂, NM处理下每盆添加等量的灭菌菌剂及经过接种剂浸泡后的滤液10 mL, 再覆盖土400 g, 表层再均匀撒25 g细沙。
挑选出芽1 cm左右颗粒饱满的辣椒和菜豆种子, 单作辣椒和单作菜豆每盆分别播种6粒和8粒, 出苗1周后, 分别间苗至4株辣椒和6株菜豆; 间作处理每盆播种辣椒4粒、菜豆6粒, 辣椒和菜豆种植面积比例为1∶1, 出苗1周后, 分别间苗至2株和3株。为保证植物生长期间免受养分缺失的胁迫, 试验前以溶液形式向混合土壤加入基础肥料, 基础肥料种类分别为NH4NO3、KH2PO4、K2SO4、CaCl2·2H2O、MgSO4·7H2O、MnSO4·H2O、CuSO4·5H2O、ZnSO4·7H2O、(NH4)6Mo7O24·4H2O, 按N 60 mg∙kg-1、P 30 mg∙kg-1、 K 67 mg∙kg-1、Ca 20 mg∙kg-1、Mg 4.5 mg∙kg-1、Mn 0.92 mg∙kg-1、Cu 0.54 mg∙kg-1、Zn 1.24 mg∙kg-1、Mo 0.06 mg∙kg-1施用。待植株生长20 d后, 进行施氮处理。植物生长期间每两天采用称重法浇水, 使土壤含水量保持在田间持水量的80%左右。
1.3 盆栽收获与测定分析
植物生长10周后收获, 将植株地上部与地下部分开收获, 依次分别用自来水和蒸馏水冲洗干净, 晾干, 根样剪成1 cm根段。取部分根样采用曲利苯蓝-方格交叉法[20]测定植株根长和菌根侵染率, 剩余根样及植株地上部经烘干(72 ℃, 72 h)、称重、粉碎后放置待用。
植株含N量参考《土壤农化分析》[21]测定, 植株N吸收量根据单位植株干重所对应的植株N含量计算。
植株收获后收集盆栽土壤过2 mm筛后混匀, 取部分新鲜土样置于4 ℃冰箱待测土壤NH4+-N、NO3--N及蛋白酶活性, 部分土样经风干后分析有机质、菌丝密度及土壤脲酶、硝酸还原酶活性。其中, 土壤NH4+-N、NO3--N含量分别用KCl浸提法、酚二磺酸比色法测定[21], 有机质采用K2Cr2O7-H2SO4氧化法测定[21], 土壤脲酶活性采用靛酚蓝比色法测定[22], 土壤蛋白酶活性采用Folin-Ciocalteu比色法测定[23], 硝酸还原酶活性采用酚二磺酸比色法测定[22]。土壤菌丝密度根据Jakobsen等[24]提供的方法测定。
1.4 数据分析
试验数据使用Excel 2010和SPSS 19.0统计软件对接种方式、施氮处理与种植模式间进行方差分析与LSD多重比较, 检验接种方式、施氮处理与种植模式的差异显著性。
2 结果与分析
2.1 土著AMF与N形态对辣椒||菜豆植株生长及N利用的影响
经多因素方差分析, 接种方式、施氮处理、种植模式的交互作用对辣椒和菜豆根系菌根侵染率、菜豆生物量及N吸收量均具有极显著影响。
由图1可知, 接种土著AMF的辣椒和菜豆根系菌根侵染率为21.0%~41.1%, 均以间作辣椒和间作菜豆种植模式下, ON处理的辣椒和菜豆菌根侵染率最高, 分别为41.1%和36.2%。单作种植模式下, 施氮显著降低了辣椒和菜豆根系菌根侵染率。间作种植方式下, 与N0相比, 施氮显著增加了辣椒和菜豆根系菌根侵染率, 均表现为: ON>ION>N0。

图1 N形态对接种土著AMF的辣椒||菜豆间作系统植株根系菌根侵染率的影响
N0、ION和ON分别指不添加N、添加无机氮120 mg·kg-1和添加有机氮120 mg·kg-1处理。不同小写字母表示不同处理间在<0.05水平差异显著。N0, ION and ON are treatments of no N, addition of inorganic N 120 mg·kg-1and addition of organic N 120 mg·kg-1, respectively. Different lowercase letters indicate significant differences at< 0.05 level among different N treatments.
由图2可知, 无论单作或是间作, 除单作菜豆外, 土著AMF处理促进了植株生物量的增加。间作模式下, N0、ION、ON条件下土著AMF处理的辣椒生物量较NM处理分别显著增加46.7%、66.2%、16.7%; 而AMF处理的菜豆生物量较NM处理明显增加131.3%、77.2%、81.2%。在单作-NM条件下, 对于植株生物量, ON处理均高于N0和ION处理; 在间作-AMF条件下, 植株生物量呈现相同趋势。
由图3可以看出, 无论何种种植模式、施氮处理, 除单作菜豆-ON, 接种土著AMF显著增加植株N吸收量。与N0相比, 施氮有增加植株N吸收量的趋势, 且单作-ION-NM处理与单作-ION-AMF处理下, 辣椒N吸收量分别比单作-N0-NM增加84.4%、323.3%, 对菜豆N吸收量而言, 分别增加71.1%、92.0%; 无论何种接种方式, 相同施氮条件下, 间作辣椒、菜豆(除NM处理)N吸收量显著高于单作, 增幅分别不低于89.1%、29.8%。
2.2 土著AMF与N形态对辣椒||菜豆种植土壤N残留的影响
经多因素方差分析, 接种方式、施氮处理、种植模式3者交互作用对土壤NH4+-N、NO3--N含量的影响均达极显著水平(<0.001)。
由图4可知, 无论何种种植方式下, 相同施氮处理接种土著AMF的土壤NH4+-N、NO3--N含量均低于NM处理, 降低幅度可分别高达66.9%、40.7%。相同菌根处理下, 无论单作或是间作, ION和ON处理的土壤NH4+-N和NO3--N含量均显著高于N0处理。无论接种土著AMF与否, N0、ION和ON条件下间作土壤NH4+-N和NO3--N含量均低于单作辣椒和单作菜豆。
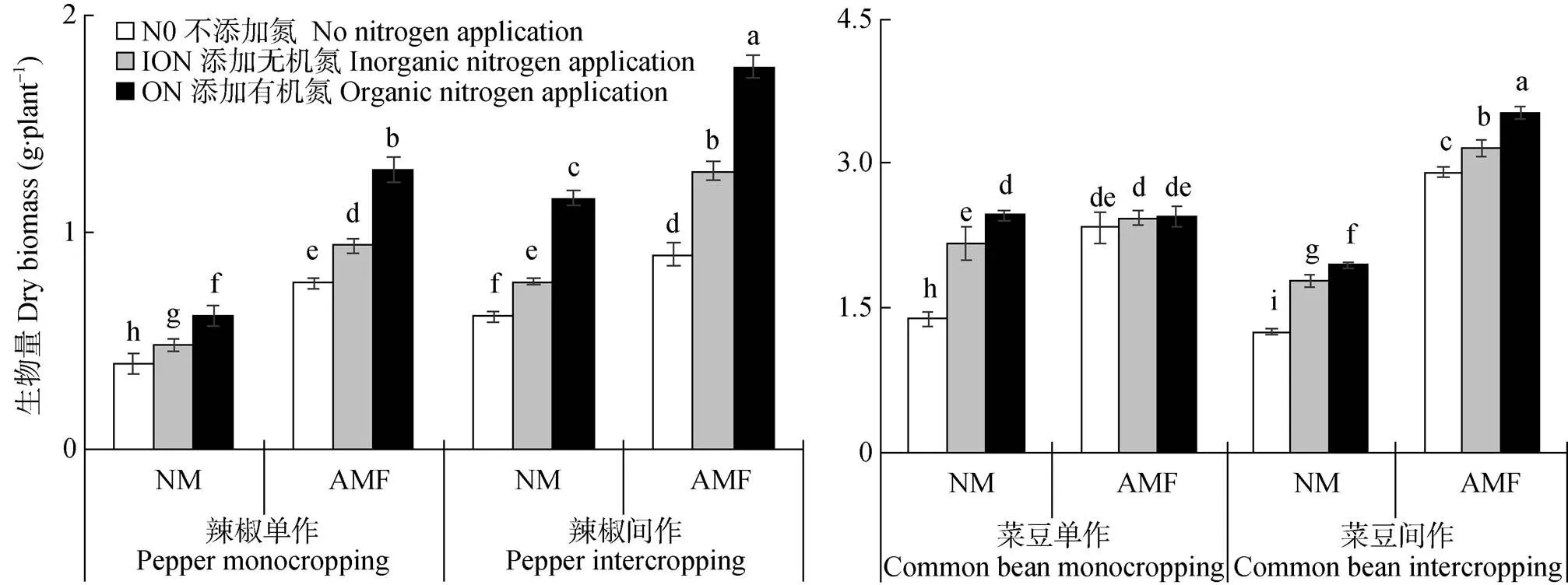
图2 土著AMF与N形态对辣椒||菜豆间作系统植株生物量的影响
N0、ION和ON分别指不添加N、添加无机氮120 mg·kg-1和添加有机氮120 mg·kg-1处理。NM、AMF指不接种土著AMF、接种土著AMF。不同小写字母表示不同处理间在<0.05水平差异显著。N0, ION and ON are treatments of no N, addition of inorganic N 120 mg·kg-1and addition of organic N 120 mg·kg-1, respectively. NM and AMF are treatments of no inoculation and inoculation with indigenous AMF. Different lowercase letters indicate significant differences at< 0.05 level among different treatments.
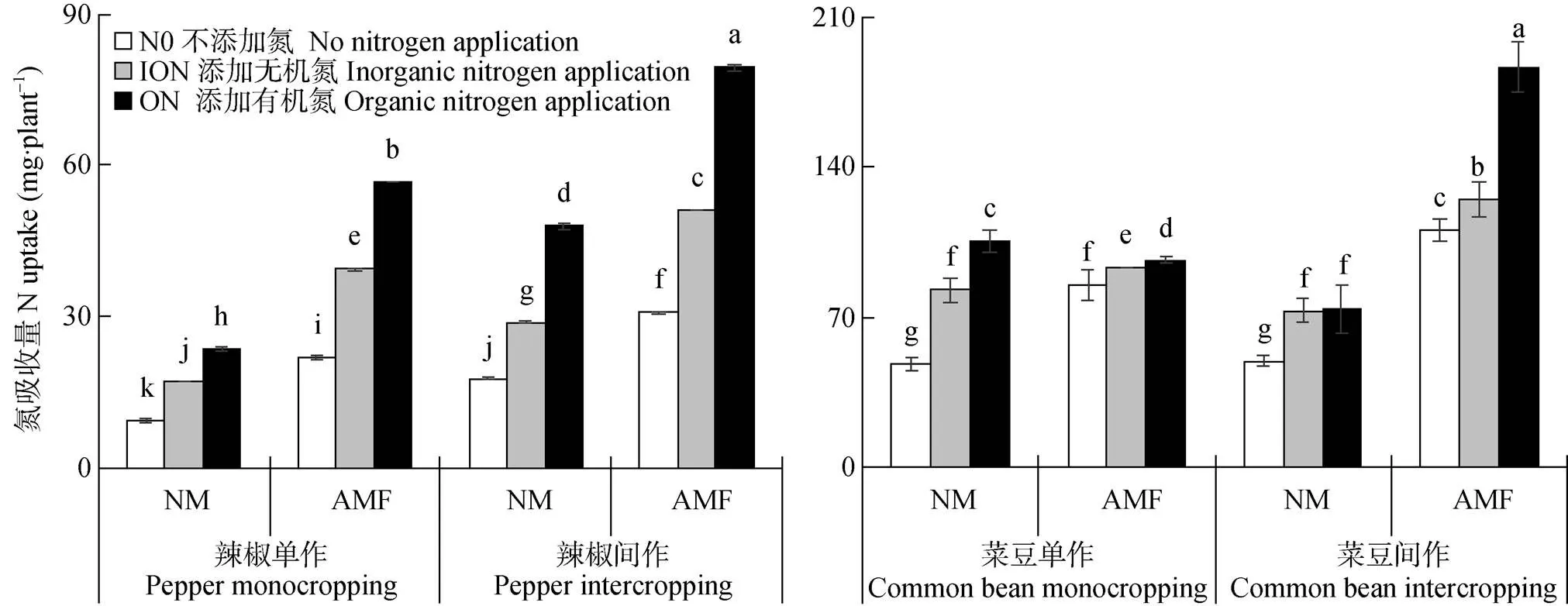
图3 土著AMF与N形态对辣椒||菜豆间作系统植株N吸收量的影响
N0、ION和ON分别指不添加N、添加无机氮120 mg·kg-1和添加有机氮120 mg·kg-1处理。NM、AMF指不接种土著AMF、接种土著AMF。不同小写字母表示不同处理间在<0.05水平差异显著。N0, ION and ON are treatments of no N, addition of inorganic N 120 mg·kg-1and addition of organic N 120 mg·kg-1, respectively. NM and AMF are treatments of no inoculation and inoculation with indigenous AMF. Different lowercase letters indicate significant differences at< 0.05 level among different treatments.
2.3 土著AMF与N形态对辣椒||菜豆种植土壤酶活性的影响
经多因素方差分析, 接种方式、施氮处理、种植模式的交互作用对蛋白酶、脲酶和硝酸还原酶活性均具有极显著的影响。
由表1可以看出, 无论何种种植模式, 相同施氮处理下接种土著AMF根围土壤蛋白酶活性均显著高于NM处理。此外, 相同菌根处理下, 与N0相比, ION和ON处理均可显著提高根围土壤蛋白酶活性。间作-N0-NM和间作-N0-AMF分别比辣椒单作- N0-NM显著增加128.0%和236.0%, 菜豆根围土壤呈现相同趋势。
处理间比较来看, 土壤脲酶活性以间作-ION-土著AMF处理下最高。无论何种种植模式及施氮处理, 接种土著AMF根围土壤脲酶活性均高于NM处理。此外, 相同菌根处理下, 与N0相比, ION和ON处理均显著提高了根围土壤脲酶活性, 其中均以ION处理下增加幅度最大。相同施氮形态下, 无论接种土著AMF与否, 间作根围土壤脲酶活性均显著高于辣椒单作和菜豆单作。

图4 土著AMF与N形态对辣椒||菜豆间作系统土壤N残留的影响
N0、ION和ON分别指不添加N、添加无机氮120 mg·kg-1和添加有机氮120 mg·kg-1处理。NM、AMF指不接种土著AMF、接种土著AMF。不同小写字母表示不同处理间在<0.05水平差异显著。N0, ION and ON are treatments of no N, addition of inorganic N 120 mg·kg-1and addition of organic N 120 mg·kg-1, respectively. NM and AMF are treatments of no inoculation and inoculation with indigenous AMF. Different lowercase letters indicate significant differences at< 0.05 level among different treatments.
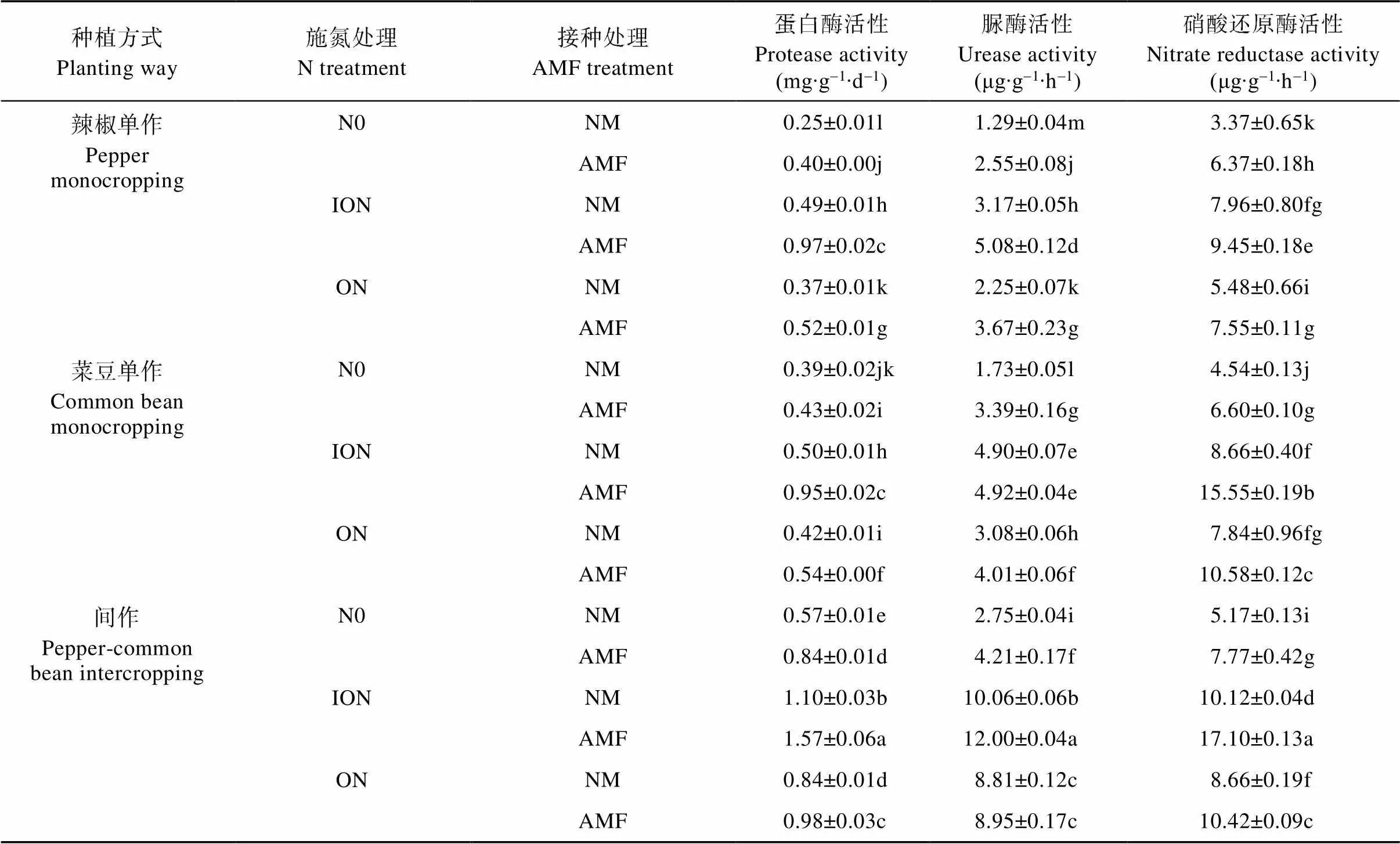
表1 土著AMF与N形态对辣椒||菜豆间作系统土壤酶活性的影响
N0、ION和ON分别指不添加N、添加无机氮120 mg·kg-1和添加有机氮120 mg·kg-1处理。NM、AMF指不接种土著AMF、接种土著AMF。同列不同小写字母表示不同处理间在<0.05水平差异显著。N0, ION and ON are treatments of no N, addition of inorganic N 120 mg·kg-1and addition of organic N 120 mg·kg-1, respectively. NM and AMF are treatments of no inoculation and inoculation with indigenous AMF. Different lowercase letters in a column indicate significant differences at< 0.05 level among different treatments.
对硝酸还原酶而言, 与NM相比, 接种土著AMF均可显著提高其在土壤中的活性。无论是否接种土著AMF, 施氮处理的根围土壤硝酸还原酶活性均显著高于N0处理, 且以ION处理下提高幅度最大。此外, 无论何种施N形态及接种土著AMF与否, 间作根围土壤硝酸还原酶活性均高于辣椒单作和菜豆单作。
2.4 土著AMF与N形态对辣椒||菜豆种植土壤菌丝密度和有机质含量的影响
经多因素方差分析, 接种方式、施氮处理、种植模式3者交互作用对土壤菌丝密度、有机质含量的影响均达极显著水平(<0.001)。
由表2可知, 接种土著AMF, 土壤中均有一定量的菌丝存在, 菌丝密度为0.76~4.21 m∙g-1。间作-ON条件下, 接种土著AMF的土壤菌丝密度最高, 是辣椒单作-ON和菜豆单作-ON的5.5倍和1.7倍。辣椒和菜豆单作条件下, 施氮均显著降低了根围土壤的菌丝密度; 间作条件下, 结果与之相反, 施氮使其显著增加。
单作种植N0条件下, 土著AMF处理的辣椒和菜豆土壤有机质含量较NM处理分别显著增加33.9%和25.8%; 而施氮条件下, 与NM相比, 土著AMF处理显著降低了土壤有机质含量。辣椒单作-NM和菜豆单作-NM条件下, 施氮均显著提高了土壤有机质含量; 而辣椒单作-土著AMF和菜豆单作-土著AMF条件下, 施氮均显著降低了土壤有机质含量。间作种植方式下, 接种土著AMF和施氮均不同程度上提高了土壤有机质含量, 以间作-ON-土著AMF处理下土壤有机质含量最高。
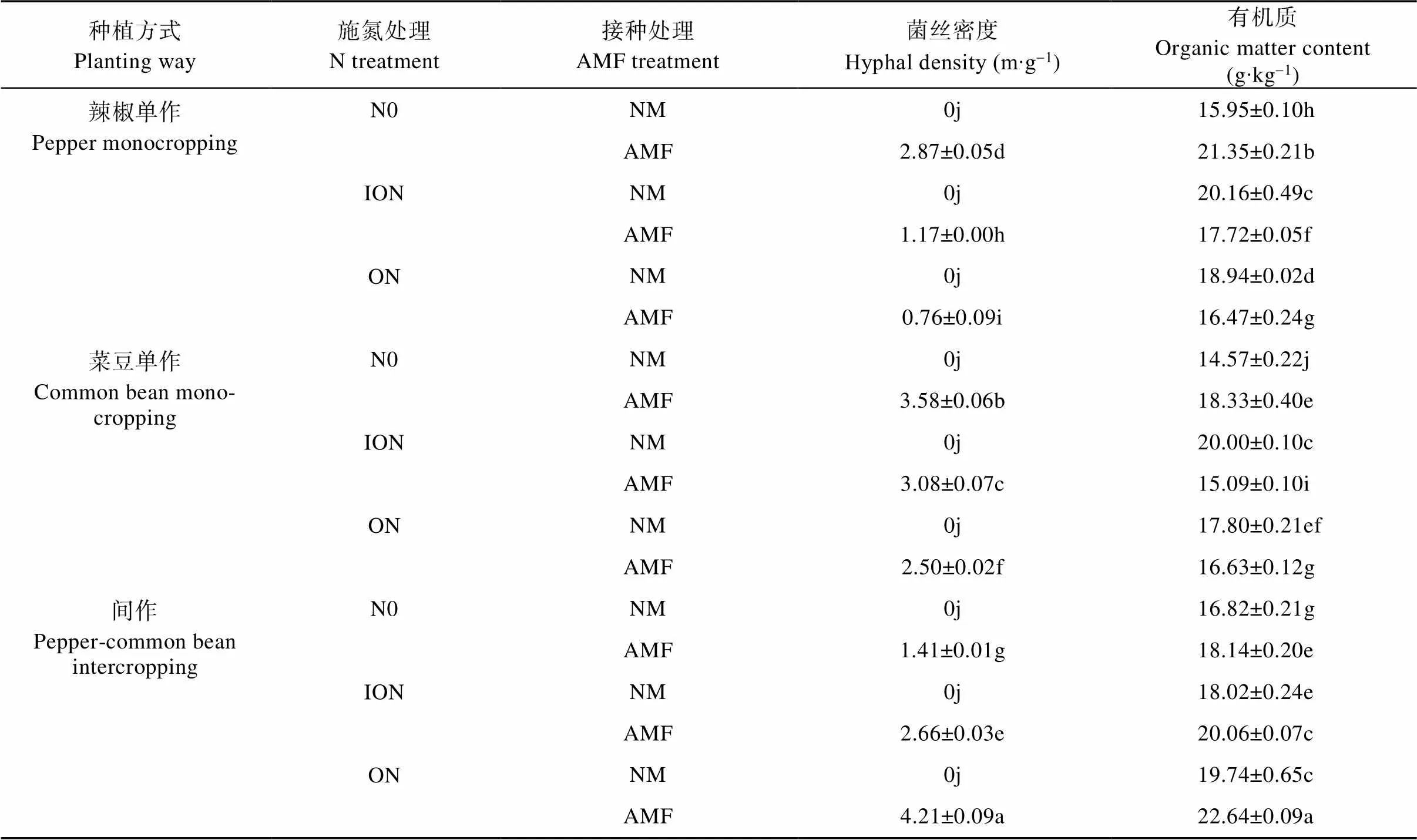
表2 土著AMF与N形态对辣椒||菜豆间作系统土壤菌丝密度和有机质的影响
N0、ION和ON分别指不添加N、添加无机氮120 mg·kg-1和添加有机氮120 mg·kg-1处理。NM、AMF指不接种土著AMF、接种土著AMF。同列不同小写字母表示不同处理间在<0.05水平差异显著。N0, ION and ON are treatments of no N, addition of inorganic N 120 mg·kg-1and addition of organic N 120 mg·kg-1, respectively. NM and AMF are treatments of no inoculation and inoculation with indigenous AMF. Different lowercase letters in a column indicate significant differences at< 0.05 level among different treatments.
2.5 影响辣椒||菜豆植株N吸收利用主要因素间的相关性分析
由表3可知, 辣椒、菜豆根系菌根侵染率均与菌丝密度呈极显著正相关关系(<0.01)。辣椒植株N吸收量与土壤菌丝密度和有机质呈极显著正相关关系(<0.01), 与土壤脲酶和硝酸还原酶活性呈显著正相关关系(<0.05), 与土壤蛋白酶活性呈一定的正相关关系。菜豆植株N吸收量与土壤菌丝密度和有机质呈极显著正相关关系(<0.01), 与土壤蛋白酶、脲酶及硝酸还原酶活性正相关, 但未达到显著水平。土壤NH4+-N和NO3--N含量与菌丝密度呈负相关关系。而土壤蛋白酶、脲酶和硝酸还原酶活性分别与菌丝密度和土壤有机质含量均呈一定的正相关关系, 其中土壤脲酶与有机质、土壤硝酸还原酶与菌丝密度、有机质的相关关系达到显著水平(<0.05)。
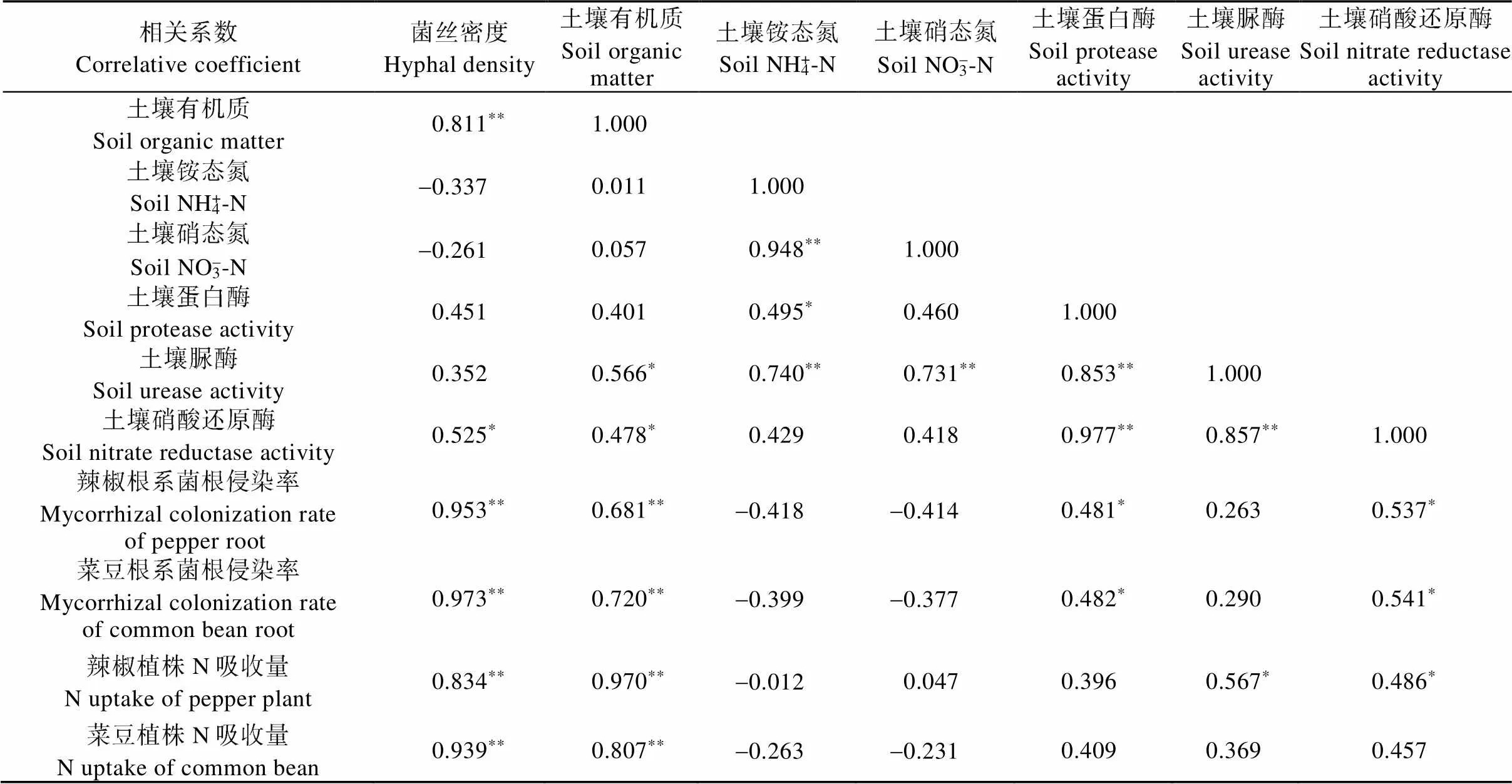
表3 辣椒和菜豆植株N吸收量、菌根侵染率及土壤各指标的相关性
**和*表示相关性分别在0.01和0.05水平上显著。** and * indicate significant correlations at 0.01 and 0.05 levels, respectively.
3 讨论
3.1 土著AMF与N形态对辣椒||菜豆根系菌根侵染率的影响
有关研究[17-18]表明, 大多数豆科、非豆科植物, 如玉米、大豆、辣椒和菜豆均能被AMF侵染。此外, 一定的施氮水平可以促进AMF对寄主植物根系的侵染, 使得AMF在促进植物对N素利用方面发挥最大的有益效应[25]。本研究中, 无论单作或是间作, 接种土著AMF均能与辣椒、菜豆根系形成良好的共生体, 其中单作条件下, 施氮均显著降低了辣椒与菜豆的菌根侵染率, 而在间作条件下施氮均显著提高了AMF对两种植物的侵染能力, 这可能与种植模式有关。单作条件下, 施氮为植物带来了充足的N源, 从而抑制了土著AMF对寄主植物根系的侵染; 而间作条件下, 辣椒与菜豆根系互作使得辣椒从土壤中获得更多的N, 降低土壤N含量, 缓解菜豆生物固氮“氮遏制”作用, 促进豆科作物菜豆根瘤的发育, 固定空气中更多的N素[14], 维持菌丝生长, 反过来增加AMF侵染辣椒、菜豆植株根系的概率。
3.2 土著AMF与N形态对辣椒||菜豆种植土壤N残留的影响
土壤NH4+-N和NO3--N是植物可直接吸收利用的两种主要无机氮形态, 是植物的重要N源。研究表明, AMF根外菌丝在一定程度上扩大了根的吸收面积, 充分吸收远距离土壤养分[6-7]。另外, 菌丝在不同植物种间形成菌丝桥, 将植物根系连接起来, 形成巨大的菌丝网络, 促进植物的N转移[8-9], 并加快土壤中难以利用有机氮的矿化从而增加植物可利用的N素[10], 表明植物可以依赖AMF从更大范围吸收更多的N, 减少土壤N残留。Asghari等[26]在AMF侵染的植物栽培土壤滤出液中, 测得NH4+-N和NO3--N浓度较低。本研究中, 接种土著AMF后, 辣椒、菜豆植株生物量和N吸收量显著增加, 土壤NO3--N含量均不同程度减少, NH4+-N呈现相同趋势。相关性分析也显示, 间作条件下, 辣椒、菜豆根系菌根侵染率越高, 菌丝密度越大, 相对应的根围土壤NH4+-N和NO3--N含量也越低, 并且植株N吸收量与侵染率、菌丝密度呈极显著正相关关系(<0.01)。不难看出, 接种土著AMF和间作的组合在提高辣椒、菜豆对N吸收利用的基础上, 不同程度减少了根围土壤无机氮残留, 在提高土壤养分资源吸收利用的同时可望减少氮肥施用, 或间接减少养分的流失。
3.3 土著AMF与施氮条件下辣椒||菜豆对土壤N利用的协同机制
研究证明, AMF不能进行光合作用, 需要依靠寄主植物提供生长发育所需要的碳, 才得以形成大量菌丝, 庞大的菌丝网不断向土壤分泌各种有机物、无机物和生长激素等物质, 增强土壤酶活性[8], 同时, AMF与微生物相互作用, 直接或间接影响根围土壤酶活性[18]。郑舜怡等[18]的研究发现, 接种AMF提高了辣椒根围土壤脲酶活性, 能加速有机氮的分解与转化, 为辣椒生长发育提供充足养分。本研究中, 接种土著AMF增加了土壤中蛋白酶、脲酶和硝酸还原酶活性, 而这3种酶可以影响土壤N素的矿化、硝化、氨化及尿素水解过程, 并且接种土著AMF还显著增加辣椒、菜豆植株N吸收量。同时相关性分析显示, 辣椒、菜豆植株N吸收量与蛋白酶、脲酶和硝酸还原酶有正相关关系, 可见AMF作用下的土壤酶在植株N利用过程中发挥着重要作用。另外, Anitha等[19]证实与菜豆间作的辣椒植株N吸收量明显增加, 且施加氮肥的间作模式提高了土壤蛋白酶、脲酶活性[27]。本研究结果显示, 间作- ION-AMF条件下根围土壤蛋白酶、脲酶及硝酸还原酶显著高于其他处理, 这可能是由于适宜的施氮量缓解了间作种植模式下辣椒与菜豆的种间竞争, AMF得以与寄主植物形成良好的共生关系, 进而提高N素转换相关酶活性。相关性分析也表明, 土壤中有机质含量与根系菌根侵染率及菌丝密度之间皆呈正相关关系, 且达显著水平(<0.05), 进一步说明接种土著AMF增加了土壤有机质含量, 为微生物提供了充足的碳源。土壤蛋白酶活性、脲酶和硝酸还原酶活性分别与根系菌根侵染率和土壤菌丝密度呈一定的正相关关系, 说明可通过接种土著AMF提高土壤硝酸还原酶、蛋白酶和脲酶活性, 促进土壤N循环和矿化速率, 提高根围土壤有效氮含量, 从而提高植物对土壤N素的利用率。
4 结论
盆栽试验研究表明, 采用间作种植模式, 接种土著AMF均可明显降低土壤无机氮残留, 适量外源N的施用可提高N素转化相关酶活性。间作-有机氮- AMF复合处理可大幅促进辣椒、菜豆对土壤N的吸收利用, 促生效果明显。相关性分析表明, 可通过间作协同适量施氮提高蔬菜根系菌根侵染率, 增加土壤酶活性, 改善土壤微域环境, 进而提高蔬菜的N素利用率。总之, 接种土著AMF、施适量有机氮和间作均可在一定程度上促进蔬菜对N的吸收利用。
[1] 巨晓棠, 谷保静. 我国农田氮肥施用现状、问题及趋势[J]. 植物营养与肥料学报, 2014, 20(4): 783–795 JU X T, GU B J. Status-quo, problem and trend of nitrogen fertilization in China[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(4): 783–795
[2] 闵炬, 施卫明. 不同施氮量对太湖地区大棚蔬菜产量、氮肥利用率及品质的影响[J]. 植物营养与肥料学报, 2009, 15(1): 151–157 MIN J, SHI W M. Effects of different N rates on the yield, N use efficiency and fruit quality of vegetables cultivated in plastic greenhouse in Taihu Lake region[J]. Journal of Plant Nutrition and Fertilizer, 2009, 15(1): 151–157
[3] CAMERON K C, DI H J, MOIR J L. Nitrogen losses from the soil/plant system: a review[J]. Annals of Applied Biology, 2013, 162(2): 145–173
[4] JU X T, XING G X, CHEN X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3041–3046
[5] 冯固, 张福锁, 李晓林, 等. 丛枝菌根真菌在农业生产中的作用与调控[J]. 土壤学报, 2010, 47(5): 995–1004 FENG G, ZHANG F S, LI X L, et al. Functions of arbuscular mycorrhizal fungi in agriculture and their manipulation[J]. Acta Pedologica Sinica, 2010, 47(5): 995–1004
[6] HODGE A, FITTER A H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(31): 13754–13759
[7] AVERILL C, TURNER B L, FINZI A C. Mycorrhiza-mediated competition between plants and decomposers drives soil carbon storage[J]. Nature, 2014, 505(7484): 543–545
[8] MONTESINOS-NAVARRO A, VERDÚ M, QUEREJETA J I, et al. Soil fungi promote nitrogen transfer among plants involved in long-lasting facilitative interactions[J]. Perspectives in Plant Ecology, Evolution and Systematics, 2016, 18: 45–51
[9] BENDER S F, CONEN F, VAN DER HEIJDEN M G A. Mycorrhizal effects on nutrient cycling, nutrient leaching and N2O production in experimental grassland[J]. Soil Biology and Biochemistry, 2015, 80: 283–292
[10] HODGE A, CAMPBELL C D, FITTER A H. An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic material[J]. Nature, 2001, 413(6853): 297–299
[11] PENG S L, GUO T, LIU G C. The effects of arbuscular mycorrhizal hyphal networks on soil aggregations of purple soil in southwest China[J]. Soil Biology and Biochemistry, 2013, 57: 411–417
[12] LI B, LI Y Y, WU H M, et al. Root exudates drive interspecific facilitation by enhancing nodulation and N2fixation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(23): 6496–6501
[13] WANG Z G, BAO X G, LI X F, et al. Intercropping maintains soil fertility in terms of chemical properties and enzyme activities on a timescale of one decade[J]. Plant and Soil, 2015, 391(1/2): 265–282
[14] 李隆. 间套作强化农田生态系统服务功能的研究进展与应用展望[J]. 中国生态农业学报, 2016, 24(4): 403–415 LI L. Intercropping enhances agroecosystem services and functioning: Current knowledge and perspectives[J]. Chinese Journal of Eco-Agriculture, 2016, 24(4): 403–415
[15] 柴强, 黄鹏, 黄高宝. 间作对根际土壤微生物和酶活性的影响研究[J]. 草业学报, 2005, 14(5): 105–110 CHAI Q, HUANG P, HUANG G B. Effect of intercropping on soil microbial and enzyme activity in the rhizosphere[J]. Acta Prataculturae Sinica, 2005, 14(5): 105–110
[16] 雍太文, 杨文钰, 向达兵, 等. 不同种植模式对土壤氮素转化及酶活性的影响[J]. 应用生态学报, 2011, 22(12): 3227–3235 YONG T W, YANG W Y, XIANG D B, et al. Effects of different planting modes on soil nitrogen transformation and related enzyme activities[J]. Chinese Journal of Applied Ecology, 2011, 22(12): 3227–3235
[17] 赵乾旭, 史静, 夏运生, 等. AMF与隔根对紫色土上玉米||大豆种间氮竞争的影响[J]. 中国农业科学, 2017, 50(14): 2696–2705 ZHAO Q X, SHI J, XIA Y S, et al. Effect of AMF inoculation on N uptake of interspecific competition between maize and soybean growing on the purple soil[J]. Scientia Agricultura Sinica, 2017, 50(14): 2696–2705
[18] 郑舜怡, 郭世荣, 张钰, 等. 丛枝菌根真菌对辣椒光合特性及根际微生物多样性和酶活性的影响[J]. 西北植物学报, 2014, 34(4): 800–809 ZHENG S Y, GUO S R, ZHANG Y, et al. Effects of arbuscular mycorrhizal fungi on characteristics of photosynthesis, microbial diversity and enzymes activity in rhizosphere of pepper plants cultivated in organic substrate[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(4): 800–809
[19] ANITHA S, GEETHAKUMARI V L, PILLAI G R. Effect of intercrops on nutrient uptake and productivity of chilli-based cropping system[J]. Journal of Tropical Agriculture, 2001, 39(1): 60-61
[20] PHILLIPS J M, HAYMAN D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55(1): 158–161
[21] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 30–34, 265–268 BAO S D. Soil and Agricultural Chemistry Analysis[M]. Beijing: China Agriculture Press, 2000: 30–34, 265–268
[22] 关松荫. 土壤酶及其研究法[M]. 北京: 中国农业出版社, 1986: 274-339 GUAN S Y. Soil Enzyme and Its Research Method[M]. Beijing: China Agriculture Press, 1986: 274-339
[23] 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2011 WU J S, LIN Q M, HUANG Q Y, et al. Determination Method of Soil Microbial Biomass and Its Application[M]. Beijing: China Meteorological Press, 2011
[24] JAKOBSEN I, ABBOTT L K, ROBSON A D. External hyphae of vesicular-arbuscular mycorrhizal fungi associated withL. 1. Spread of hyphae and phosphorus inflow into roots[J]. New Phytologist, 1992, 120(3): 371–380
[25] 朱红惠, 姚青, 龙良坤, 等. 不同氮形态对AM真菌孢子萌发和菌丝生长的影响[J]. 菌物学报, 2004, 23(4): 590-595 ZHU H H, YAO Q, LONG L K, et al. Influence of different N forms on spore germination and hyphal growth of AM fungus[J]. Mycosystema, 2004, 23(4): 590–595
[26] ASGHARI H R, CAVAGNARO T R. Arbuscular mycorrhizas enhance plant interception of leached nutrients[J]. Functional Plant Biology, 2011, 38(3): 219
[27] 张向前, 黄国勤, 卞新民, 等. 施氮肥与隔根对间作大豆农艺性状和根际微生物数量及酶活性的影响[J]. 土壤学报, 2012, 49(4): 731-739 ZHANG X Q, HUANG G Q, BIAN X M, et al. Effects of nitrogen fertilization and root separation on agronomic traits of intercropping soybean, quantity of microorganisms and activity of enzymes in soybean rhizosphere[J]. Acta Pedologica Sinica, 2012, 49(4): 731-739
Effects of indigenous arbuscular mycorrhizal fungi and nitrogen forms on plant nitrogen utilization and the influencing factors in a pepper-common bean intercropping system*
LIU Yuanyuan1,2, ZHAO Qianxu1, Deng Xi3, WANG Bao1,2, ZHANG Naiming1,2, ZONG Qingfu1,XIA Yunsheng1,2**
(1. College of Resources and Environment, Yunnan Agricultural University, Kunming 650201, China; 2. Yunnan Engineering Laboratory of Soil Fertilityand Pollution Remediation, Kunming 650201, China; 3. Xiamen Security Science and Technology College, Xiamen 361000, China)
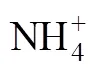
Indigenous arbuscular mycorrhizal fungi (AMF); Nitrogen from; Intercropping; Pepper; Common bean; Nitrogen utilization
S344.2; S641.3; S643.1

10.13930/j.cnki.cjea.190575
* 国家自然科学基金项目(41561057)、云南省重大科技专项·绿色食品国际合作研究中心专项课题(2019ZG00907-01)和云南省土壤资源利用与保护创新团队项目(2015HC018)资助
夏运生, 主要研究方向为菌根生理及污染控制研究。E-mail: yshengxia@163.com
刘圆圆, 主要研究方向为设施土壤改良。E-mail: Liuyuandz@163.com
2019-08-02
2019-10-17
* This study was supported by the National Natural Science Foundation of China (41561057), the Special Project of International Cooperation and Research Center for Green Food in Yunnan Province (2019ZG00907-01) and the Innovation Team Project of Utilization and Protection of Soil Resources in Yunnan Province (2015HC018).
, E-mail: yshengxia@163.com
Oct. 17, 2019
Aug. 2, 2019;
刘圆圆, 赵乾旭, 邓曦, 王豹, 张乃明, 宗庆富, 夏运生. 土著AMF与氮形态对辣椒||菜豆间作系统植株氮利用及其影响因素研究[J]. 中国生态农业学报(中英文), 2020, 28(2): 245-254
LIU Y Y, ZHAO Q X, DENG X, WANG B, ZHANG N M, ZONG Q F, XIA Y S. Effects of indigenous arbuscular mycorrhizal fungi and nitrogen forms on plant nitrogen utilization and the influencing factors in a pepper-common bean intercropping system[J]. Chinese Journal of Eco-Agriculture, 2020, 28(2): 245-254
