Z-没药甾酮对缺血性脑卒中大鼠氧化应激损伤的保护作用及分子机制
2020-02-12刘天龙柳敏娜王文军张一恺封小娜文爱东
刘天龙,柳敏娜,王文军,张一恺,封小娜,丁 一,文爱东
缺血性脑卒中又称为脑梗死,是一种高发病率、高致残率、高病死率和高复发率的脑血管疾病,对人类健康和生命安全造成严重威胁[1-4]。该病是因为大脑动脉血流短暂或持久性的闭塞导致脑供血不足或中断,进而诱发一系列级联反应,最终造成缺血区脑组织发生不可逆的损伤,引起神经功能缺损甚至死亡[5]。缺血性脑卒中病理机制十分复杂,其中氧化应激反应是其主要病理因素之一[6]。氧化应激由机体内产生的活性氧簇(ROS)介导,导致氧化与抗氧化失衡,从而引起组织、细胞的氧化损伤[7]。在缺血性脑卒中发生时,ROS的产生远远超过内源性抗氧化系统的清除能力,血管内皮细胞内大量的ROS使得细胞氧化呼吸链和氧化磷酸化的过程被破坏[8]。因此通过抑制脑缺血诱发的氧化应激反应,是治疗脑卒中的有效途径[9]。没药是临床防治缺血性脑卒中的经典中药,Z-没药甾酮(Z-Guggulsterone, Z-GS)是其主要药效物质。前期研究表明,Z-GS可透过血脑屏障,发挥脑保护作用[10]。但是Z-GS对脑缺血后氧化应激的调控作用和机制并不明确。本研究以脑中动脉阻塞(MCAO)大鼠为模型,观察Z-GS对缺血性脑卒中的保护作用,并探讨其对氧化应激反应的调控及机制,为Z-GS开发成防治缺血性脑卒中的潜在药物提供理论依据。
1 材料与方法
1.1实验材料
1.1.1实验动物:雄性SD大鼠(250~270 g)由空军军医大学实验动物中心提供,所有动物实验遵循实验动物伦理相关规定。饲养环境温度为(22±2)℃,湿度为55%~75%,12 h循环光照,自由饮水和取食。适应性饲养7 d后开始实验。
1.1.2试剂与仪器:Z-GS(Santa Cruz,美国),线栓(Doccol,美国),TTC试剂(Sigma-Aldrich,美国),TUNEL试剂盒(碧云天,上海),Nrf2和HO-1抗体(Abcam,英国),qRT-PCR试剂盒(TaKaRa,日本),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和ROS试剂盒(建成,南京)。蛋白免疫印迹系统、PCR系统(Bio Rad,美国),光学显微镜、电子显微镜(Olympus,日本),低温离心机(Eppendorf,德国)。
1.2实验方法
1.2.1造模及给药:大鼠行MCAO术模拟脑缺血。36只大鼠随机分为假手术组、模型组、Z-GS组,每组12只。模型组及Z-GS组大鼠用5%异氟烷麻醉,仰卧位固定后,沿颈部正中线切开皮肤,钝性分离右侧颈总动脉、颈外动脉和颈内动脉。结扎颈总动脉和颈外动脉,夹闭颈内动脉。在颈外动脉插入线栓,进入颈内动脉,进线18~20 mm,固定线栓。2 h后拔出线栓。假手术组除不插入线栓外,其他操作同模型组。造模结束后,Z-GS组大鼠腹腔注射30 mg/kg的Z-GS(溶媒为DMSO,调整浓度使DMSO终浓度<5%),连续给药7 d。假手术组及模型组给予相应的溶媒。
1.2.2神经功能评分:给药结束后进行神经功能评分。评分标准采用Longa法评定:0分,无神经功能缺损症状;1分,悬尾时不能完全伸展左前肢;2分,向左侧转圈;3分,向左侧倾倒;4分,不能自主行走;5分,死亡。
1.2.3脑梗死体积测定:神经功能评分结束后麻醉,迅速断头取脑,从脑前极与视交叉连线中点处,沿冠状面从前向后按2 mm厚度切片,浸泡于1 %的TTC染液中,避光室温孵育约20 min,随后用4%多聚甲醛固定24 h。拍照后用Photoshop软件测定梗死体积。梗死体积用百分率表示:梗死体积比=(对侧正常脑组织体积-同侧正常脑组织体积)/对侧正常脑组织体积×100%。
1.2.4组织病理学染色:大鼠麻醉后,用生理盐水和4%多聚甲醛灌注。随后剥离脑组织浸入4%多聚甲醛继续固定24 h以上,进行脱水、石蜡包埋和切片。按照常规方法进行HE染色。TUNEL染色用DAB法,切片脱蜡后根据说明书操作染色。
1.2.5氧化应激水平检测:脑组织中氧化应激相关酶GSH-Px、SOD、CAT和MDA水平用相应的试剂盒根据说明书操作进行检测。组织中ROS水平用荧光探针DCFH-DA进行检测,根据说明书方法,组织制作细胞悬液后加入10 μmol/L的DCFH-DA 40 min后,用流式细胞仪检测荧光强度,换算ROS百分比。
(3)执行进度:项目实施周期为四个季度,项目单位应于两个季度末完成项目任务执行的50%,并于四个季度末完成所有项目。项目在执行过程中由于特殊原因需要终止、撤销、变更的,须提前15天经区县(自治县)民政局同意后报中心审批,获得同意变更书面回复后方可变更相关事项。
1.2.6免疫组化:切片脱蜡脱水后,0.3%甲醇-H2O2灭活内源性过氧化物酶,切片在枸橼酸抗原修复液中修复后血清封闭。滴加一抗anti-Nrf2(1∶200)、anti-HO-1(1∶200)后4℃冰箱过夜。滴加二抗,室温下孵育1 h。DAB显色后滴加苏木素复染细胞核。切片脱水透明封片固定。显微镜下随机选区5个不同区域观察拍照,平均光密度用Image-Pro Plus 6.0 软件分析。
1.2.7蛋白免疫印迹检测:提取脑组织总蛋白,用BCA法测定蛋白浓度。用8%的分离胶(SDS-PAGE)分离目标蛋白,随后将蛋白转移到硝酸纤维素膜上。用5%脱脂奶粉室温封闭1 h,加入一抗在4℃孵育过夜,用相应的二抗室温孵育1 h。ECL法显色后用Quantity One系统曝光条带。条带灰度值用Image J软件以β-actin为内参计算。所用目标一抗分别为:Nrf2(1∶1000)、HO-1(1∶1000)。
1.2.8qRT-PCR检测:脑组织提取总RNA后,根据试剂盒操作说明,配制反转录体系合成cDNA。将合成的cDNA稀释后,根据说明配制反应体系,反应条件为预变性:95℃ 10 min;循环反应:95℃ 10 s,60℃ 30 s;融解曲线:95℃ 15 s,60℃ 60 s,95℃ 15 s。用2-ΔΔCt法以GAPDH为内参计算目标基因的表达水平。
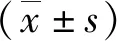
2 结果
2.1Z-GS对大鼠神经功能的影响 假手术组大鼠神经功能无明显异常,而模型组大鼠神经功能受损严重,评分为(3.38±0.52)分,与假手术组比较差异有统计学意义(P<0.05),表明模型制备成功。Z-GS组大鼠神经功能恢复明显,评分为(2.13±0.83)分,低于模型组(P<0.05)。
2.2Z-GS对大鼠脑梗死体积的影响 假手术组大鼠脑组织形态正常,模型组出现大面积脑梗死,梗死体积比为(43.50±5.63)%,与假手术组比较差异有统计学意义(P<0.05)。Z-GS组脑梗死体积比为(32.88±4.94)%,小于模型组,差异有统计学意义(P<0.05)。
图1 3组大鼠脑组织病理学表现Z-GS为Z没药甾酮
2.4Z-GS对大鼠氧化应激的影响 模型组大鼠脑组织中抗氧化酶GSH-Px、SOD和CAT含量低于假手术组,Z-GS组高于模型组(P<0.05);模型组大鼠脑组织中MDA和ROS水平高于假手术组,Z-GS组低于模型组(P<0.05)。见表1。
表1 3组大鼠脑组织氧化应激水平
注:Z-GS为Z没药甾酮;MDA为丙二醛,GSH-Px为谷胱甘肽过氧化物酶,SOD为超氧化物歧化酶,CAT过氧化氢酶,ROS为活性氧;与假手术组比较,aP<0.05;与模型组比较,cP<0.05
2.5Z-GS对大鼠脑组织Nrf2、HO-1 mRNA表达的影响 模型组大鼠脑组织Nrf2和HO-1 mRNA表达水平低于假手术组,Z-GS组高于模型组(P<0.05)。见图2。
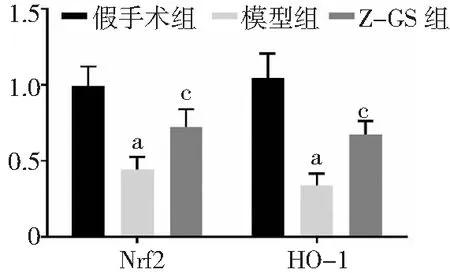
图2 3组大鼠脑组织Nrf2和HO-1 mRNA表达水平
Z-GS为Z没药甾酮;与假手术组比较,aP<0.05;与模型组比较,cP<0.05
2.6Z-GS对大鼠脑组织Nrf2、HO-1蛋白表达的影响 模型组大鼠脑组织Nrf2和HO-1蛋白表达低于假手术组,Z-GS组高于模型组(P<0.05)。见图3。对大鼠脑组织Nrf2和HO-1进行免疫组化染色验证,结果与蛋白免疫印迹检测结果一致。见图4。
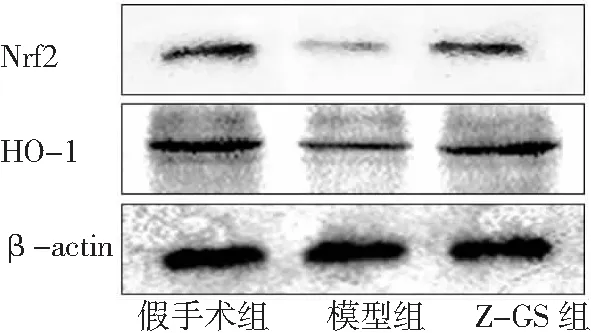
图3 3组大鼠脑组织Nrf2和HO-1蛋白表达情况
Z-GS为Z没药甾酮
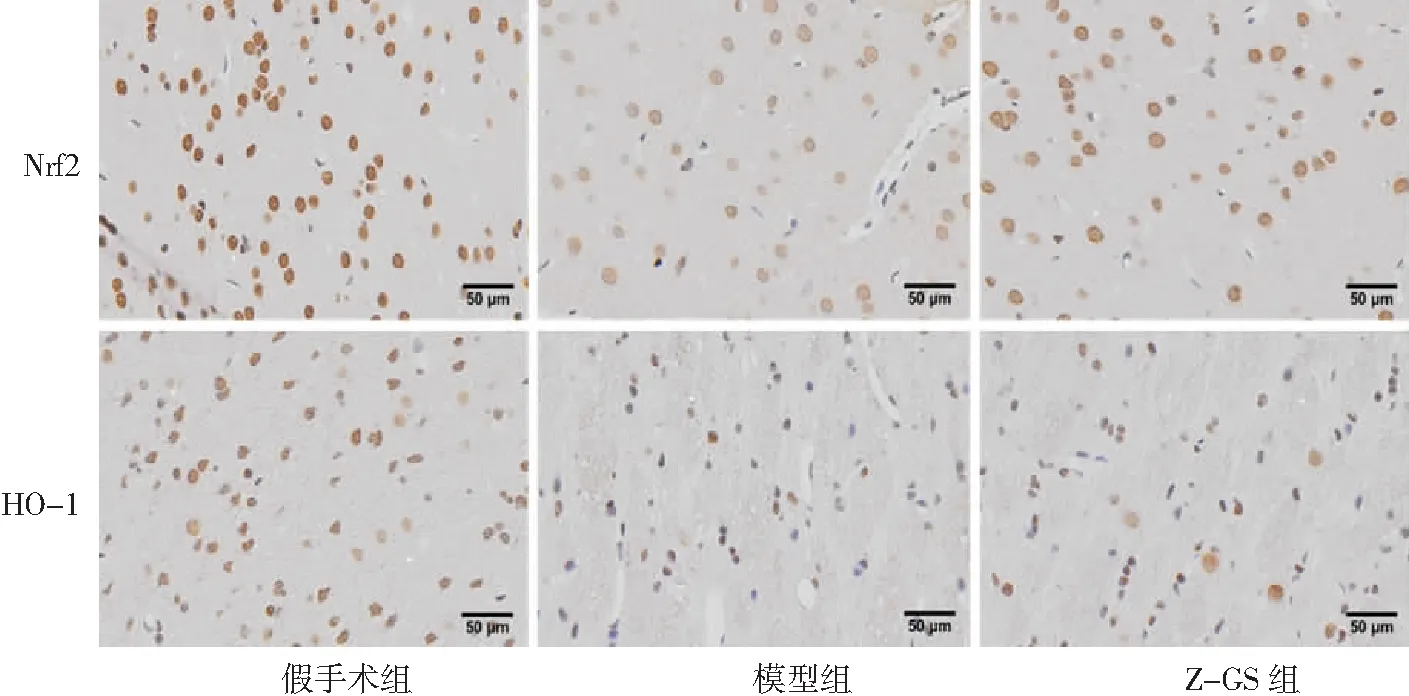
图4 免疫组化染色检测大鼠脑组织Nrf2和HO-1蛋白表达Z-GS为Z没药甾酮
3 讨论
缺血性脑卒中是指由于脑动脉狭窄或堵塞,局部脑血流量减少或中断,造成该动脉供应区域的脑组织缺血缺氧、供能减少,进而引起继发性血管内皮损伤和自主神经功能障碍的一种病理状态,严重影响患者生活质量[11-13]。溶栓是缺血性脑卒中的首选救治措施,但因其严格的治疗窗口和较高的出血风险,溶栓效果受到很大限制[14-15]。而中药因其公认的功效,在脑卒中的临床治疗中越来越受到国内外学者的重视[16]。
Z-GS是没药的活性成分之一。研究表明,Z-GS通过激活小鼠海马和皮质区CREB-BDNF信号通路在小鼠体内产生抗抑郁和记忆损伤的作用[17-18]。Z-GS可通过抑制大鼠大脑组织和脑微血管内皮细胞中P-糖蛋白的活性和表达,发挥调控血脑屏障的作用[19]。笔者前期研究也发现,Z-GS腹腔给药可通过抑制TLR4信号通路发挥抗炎脑保护作用[10]。本研究结果显示,Z-GS给药可显著缓解脑梗死大鼠神经功能损伤和组织病理变化,表明了Z-GS潜在的抗脑卒中作用。
现代研究证实,氧化应激是缺血性脑卒中的主要病理机制之一。氧化应激是机体在遭受有害刺激,如脑缺血缺氧等,组织中ROS的产生和清除动态平衡被破坏,ROS的过度蓄积导致细胞氧化应激损伤[20]。正常生理状况下,体内广泛分布有GSH-Px、SOD和CAT等多种抗氧化酶,这些酶可对抗机体产生的自由基代谢产物[21]。缺血缺氧后,脑组织产生大量自由基,并通过多种途径产生级联反应加重脑损伤[22]。本研究结果显示,大鼠制备MCAO模型后,脑组织中抗氧化酶GSH-Px、SOD和CAT水平下降,而MDA和ROS水平升高,表明模型组大鼠发生了氧化应激反应,Z-GS给药后以上指标均被显著逆转,初步表明了Z-GS的抗氧化应激作用明显。
Nrf2是调节氧化还原平衡的核心转录因子,在维持内皮细胞形态和保持血管功能完整性中发挥重要调控作用[23]。在生理状态下,大部分Nrf2在细胞质中与其抑制性蛋白Keap1结合而处于失活状态。当暴露于化学或组织特异性激酶等条件下,Nrf2与Keap1分离,从细胞浆转移至细胞核内,与胞核内抗氧化剂反应元件ARE结合,从而调节Ⅱ相解毒或抗氧化酶基因的表达[24]。HO-1是Nrf2调控的重要基因之一,HO-1及酶解产物一起发挥抗氧化、抗凋亡等作用,是机体重要的内源性保护体系[25]。本课题组长期致力于心脑血管的保护研究,Nrf2/HO-1通路作为治疗靶点已被多次证实[26-27]。本研究结果显示,模型组大鼠脑组织Nrf2和HO-1蛋白表达低于假手术组,Z-GS组高于模型组。提示Z-GS抗氧化应激可能是通过促进Nrf2和HO-1的表达发挥作用。
综上所述,Z-GS给药可显著缓解缺血性脑卒中大鼠神经功能损伤和氧化应激反应,其机制可能是通过激活Nrf2/HO-1通路,促进下游抗氧化因子表达。
