模拟微重力对HaCaT细胞创伤修复相关蛋白和基因表达的影响
2020-02-12林晶晶孙培鸣徐冰心段育忠周金莲杨鹤鸣李成林
林晶晶,孙培鸣,张 涛,徐冰心,段育忠,周金莲,杨鹤鸣,李成林,崔 彦
随着载人航天事业的迅猛发展,失重影响航天员健康的问题受到广泛关注。航天实践和研究证明,失重环境会导致机体各系统器官产生一系列病理生理变化[1-2]。NASA研究指出,创伤是失重环境中影响航天员身心健康及任务执行能力的最大威胁,应给予最高等级的关注[3]。研究失重环境对创伤及其修复过程的影响具有重要而深远的意义[4]。在皮肤创面愈合过程中,角质细胞是创伤修复的重要细胞,其分泌的相关蛋白和细胞因子参与调节创伤修复进程[5]。本实验釆用微重力细胞培养系统(the rotary cell culture system, RCCS)研究模拟失重对人永生化角质形成细胞(HaCaT)创伤修复蛋白表达及超微结构的影响,为航天医学实践中的医监医保工作提供理论参考。
1 材料与方法
1.1主要材料和仪器 HaCaT细胞株(北京协和细胞资源中心),微载体Cytodex-3(GEHealthcare, USA),RCCS(Synthecon, USA),10 ml高截面纵横比容器(high aspect ratio vessel, HARV, Synthecon, USA),透射电镜(Tecnai Spirit, USA),小鼠抗人热休克蛋白70(HSP70)单克隆抗体,兔抗人基质金属白酶-9(MMP-9)单克隆抗体,小鼠抗人凋亡蛋白Caspase-3单克隆抗体。
1.2HaCaT细胞株培养扩增和实验分组 HaCaT细胞株以含10%胎牛血清及双抗(100 μg/ml青霉素和100 μg/ml链霉素)的DMEM高糖培养基,于37℃ CO2培养箱中培养,待细胞融合度达到80%左右进行传代。将HaCaT细胞随机分为模拟微重力(simulated microgravity group, SMG)组和正常重力对照(normal gravity group, NG)组,SMG组HaCaT细胞与微载体共同置入HARV在RCCS中培养。NG组HaCaT细胞置于培养瓶中正常培养。
1.3建立RCCS微载体培养体系 将准备好的Cytodex-3微载体置入HARV,加入含10%胎牛血清的DMEM培养基。将培养好的HaCaT细胞以2×106密度接种于HARV,加满上述培养基,用5 ml注射器排气泡后放入RCCS。RCCS中初始转速设置为12 r/min,12 h后设为14 r/min,之后密切观察,依培养状态调整转速,使微载体能悬浮在培养液中,根据预实验HaCaT细胞对数生长期生长曲线和倍增时间,设定培养时间分别为32、36、42 h。
1.4实时荧光定量聚合酶链反应(RT-PCR)检测 HSP70、MMP-9和Caspase-3 mRNA表达水平检测主要步骤如下:收集2组培养32、36、42 h细胞,提取总RNA逆转录反应合成cDNA,将cDNA样品稀释8倍作为模板上机检测,分析2组基因表达情况,根据文献设计PCR引物。PCR引物由上海生工股份有限公司合成,见表1。

表1 实时荧光定量PCR引物序列表
注:PCR为聚合酶链反应,HSP70为热休克蛋白70,MMP-9为基质金属蛋白酶-9,Caspase-3为凋亡蛋白
1.5蛋白免疫印迹法分析 收集2组培养32、36、42 h细胞,用预冷的PBS洗3遍,加400 μl裂解液于冰上裂解30 min,收集细胞碎片和裂解液,12 000 r/min离心30 min,转移上清。测定蛋白浓度后进行SDS-PAGE电泳及转膜、封闭。加入一抗4℃孵育过夜(≥18 h),TBST洗涤3遍,加入二抗室温摇床孵育2 h。TBST洗膜3遍后加入二氨基联苯胺(DAB)显色。
1.6透射电镜 RCCS培育42 h后,吸出HARV中混合液体于15 ml离心管中,静置5 min弃上清,PBS洗涤2遍,每个样本加0.25%胰酶消化液2~3 ml,37℃消化10 min后,再以1000 r/min的转速离心5 min。加入含血清培养基终止消化作用,轻轻吹打,使细胞从微载体上脱落,70 μm细胞筛过滤,获得单细胞悬液后再次RCCS培育42 h,吸出HARV中混合液体于15 ml离心管中,静置5 min,弃上清,PBS洗涤2遍,每个样本加0. 25%胰酶消化液2~3 ml,37℃消化10 min,1000 r/min离心5 min。加入含血清培养基终止消化作用,轻轻吹打,使细胞从微载体上脱落,再通过70 μm细胞筛过滤,获得单细胞悬液后离心沉淀细胞团。NG组细胞按正常消化步骤,将离心后细胞团分别收集到1.5 ml EP管中。按顺序用2.5%戊二醛和1%锇酸室温下固定2 h,乙醇梯度脱水,用Epon 812纯树脂包埋并切片,透射电镜下观察细胞超微结构并照相。
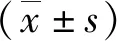
2 结果
2.1RT-PCR检测结果 SMG组HaCaT细胞培养32、36 h HSP70 mRNA表达水平,培养32、36和42 h MMP-9 mRNA及培养36 h Caspase-3 mRNA表达水平均高于NG组(P<0.05)。见表2。
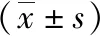
表2 2组HaCaT细胞经不同时间培养后创伤修复相关基因相对表达量
注:SMG组为模拟微重力组,NG组为正常重力对照组;HSP70为热休克蛋白70,MMP-9为基质金属蛋白酶-9,Caspase-3为凋亡蛋白;与NG组比较,aP<0.05
2.2蛋白免疫印迹检测结果 以目标检测蛋白与相应内参β-actin蛋白条带的吸光度值的比值(HSP70/β-actin、MMP-9/β-actin和Caspase-3/β-actin)代表该蛋白的相对表达量。SMG组细胞培养32、36和42 h后HSP70和MMP-9蛋白表达趋势与相应蛋白mRNA表达一致,而Caspase-3蛋白表达趋势与相应mRNA存在一定差异。见图1。
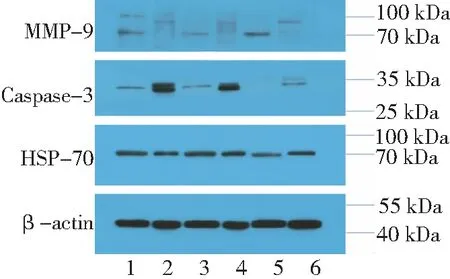
图1 蛋白免疫印迹法检测相关蛋白的表达变化
1~6分别代表SMG组32 h、NG组32 h、SMG组36 h、NG组36 h、SMG组42 h、NG组42 h对应蛋白的电泳条带;SMG组为模拟微重力组,NG组为正常重力对照组;HSP70为热休克蛋白70,MMP-9为基质金属蛋白酶-9,Caspase-3为凋亡蛋白
2.3细胞超微结构 NG组细胞形态规则,胞膜、核膜结构完整,线粒体嵴清晰可见。SMG组为模拟微重力环境下培养42 h后的HaCaT细胞,可见细胞有皱缩表现,细胞器较难辨认,胞浆内存在较多空泡,细胞核形态不规则,核内有染色质凝结现象,细胞线粒体嵴出现断裂,结构模糊,部分线粒体出现空泡。见图2。
图2 模拟微重力条件下HaCaT细胞超微结构变化
A.NG组42 h, 2 μm;B.NG组42 h, 1 μm; C.SMG组42 h, 2 μm;D.SMG组42 h, 1 μm;SMG组为模拟微重力组,NG组为正常重力对照组;HaCaT为人永生化角质形成细胞
3 讨论
航天飞行过程中最常见的创伤为皮肤软组织伤[3]。研究发现,失重会引起肢体血流灌注水平改变,进而影响伤口的愈合[6]。Radek等[7]通过尾悬吊动物模型的皮肤打孔实验,发现模拟失重条件下大鼠伤口愈合明显延迟。本课题组前期研究表明,失重会影响成纤维细胞的生长增殖、细胞结构、相关基因和蛋白的表达[8-10]。从现有文献报道看,航天飞行过程中最容易发生的皮肤软组织创伤的基础和应用研究均比较局限,亟待系统深入研究[4]。本实验采用RCCS模拟微重力环境进行细胞实验,其原理是培养物在HARV中随RCCS旋转产生运动,通过独特的流体力学与低剪应力效应,促进细胞与细胞间的相互作用,增加细胞结合的自由度,该流体环境可使其中的悬浮细胞处于失重状态,从而可在地基条件下模拟地球附近空间的失重情况,成为研究地面模拟组织细胞微重力效应的一种理想方法[11]。
皮肤创面修愈过程中发挥关键作用的细胞包括角质细胞、成纤维细胞及内皮细胞。角质形成细胞是表皮的重要组成细胞之一,也是皮肤更新、屏障形成和免疫防御的主要细胞,其增殖、分化和迁移是纤维增生、新血管形成和创面愈合的生理基础[5]。HaCaT细胞来源于人的表皮细胞,与角质形成细胞的基本特性极其相似。本研究前期实验证实,模拟微重力环境对人角质细胞产生的一系列影响,包括抑制角质细胞增殖及细胞因子的分泌,影响角质细胞微丝和骨架结构[12]。
HSPs是一种高度保守的分子伴侣蛋白,在原核细胞与真核细胞中广泛存在。在人皮肤中,HSPs最主要的来源是角质细胞。机体细胞受到理化因素刺激后,HSPs从低表达状态转入高表达状态,故又被称为应激蛋白。HSPs在细胞正常生长发育及蛋白代谢中具有重要作用;在应激条件下,HSPs则具有细胞保护作用[13-14]。本研究结果显示,SMG组HaCaT细胞的HSP70 mRNA及蛋白表达水平高于NG组。分析原因为,作为皮肤中HSPs最主要的来源,HaCaT细胞对失重环境这一特殊刺激因素通过提升HSPs表达等机制而发生应激效应,在造成应激损伤的同时,提升在特殊环境中的生存和适应能力。有学者研究发现,在失重环境下,内皮细胞、骨干细胞、肝细胞等的HSP70表达上调,显然,HSPs在机体多种组织器官的失重应激过程中发挥作用[15-17]。长期以来一直认为,HSPs作为分子伴侣维护蛋白质正常构象,调整蛋白质折叠、装配、转运和降解,并参与应激状态下的细胞保护。如何在创伤愈合中合理诱导或抑制HSPs生成,有效利用其双刃剑样作用,做到趋利避害、酌情把控、精准调节,这些技术性的问题尚有待解决[18]。HSP70在失重环境下皮肤创伤及愈合过程中的作用和机制以及潜在的治疗价值,尚有待进一步研究。
本研究结果显示,SMG组HaCaT细胞MMP-9 mRNA及蛋白表达量高于NG组。据文献报道,在失重环境下志愿者口腔牙裂液、大鼠颈总动脉及猕猴肺组织中MMP亦发生显著变化[19-21]。MMPs是一组破坏细胞外基质(extracellular matrix,ECM)的锌和钙依赖性蛋白溶解酶,在正常细胞中为低表达状态,受到刺激后表达量增加。在创面愈合过程中,皮肤角质细胞、成纤维细胞和炎性细胞亦分泌MMPs而发挥调控作用[22]。MMP-9能降解几乎所有的ECM蛋白,其表达水平增高反映了细胞损伤的因素和程度;但同时MMP-9也是重要的创伤修复蛋白,其在创面重塑过程中发挥重要作用[23-24]。分析认为,在失重环境中HaCaT细胞分泌MMP-9增多,早期参与失重应激损伤反应,后期可能介导耐受适应修复。
本研究还发现,SMG组HaCaT细胞Caspase-3表达量仅培养36 h时高于NG组,同时,透射电镜观察结果显示,模拟微重力条件下培养的HaCaT细胞超微结构发生线粒体损伤等病理变化。本课题组前期研究亦表明,微重力环境对HaCaT细胞的微丝骨架结构可造成明显影响,破坏了细胞微丝结构的有序性,与生长增殖及自分泌功能受损等共同构成了HaCaT细胞失重应激损伤的生理病理表现[12]。Caspase-3是经典的凋亡蛋白,是重要的细胞凋亡激活蛋白之一,众多因素可通过该通路引发细胞凋亡[25]。显然,失重作为一种特殊因素可通过Caspase途径诱发HaCaT细胞凋亡。考虑到HSP的抗凋亡及细胞保护作用对细胞凋亡进程会产生一定影响,分析与Caspase-3 mRNA及蛋白表达有一定关系,具体有待深入探讨。
综上所述,失重影响航天员健康的问题已引起广泛关注,创伤是失重环境中影响航天员身心健康及任务执行能力的最大威胁。微重力环境下HaCaT细胞HSP70、MMP-9及Caspase-3 mRNA及蛋白表达水平变化以及细胞超微结构病理性改变均提示失重可导致皮肤角质细胞发生应激损伤和细胞凋亡以及一定程度的适应特征。
