樟子松木材组织染色研究
2020-02-12彭俊懿石江涛
彭俊懿,林 巧,石江涛
(南京林业大学 材料科学与工程学院,江苏 南京 210037)
在木材解剖的研究中,不同细胞或组织水平上,高质量的显微切片是必要的基础工作。现阶段的显微切片制作中,无论是用于观察的石蜡切片[1]、滑走切片[2],还是半薄切片,染色都是关键步骤。几十年来,对于木材显微切片染色方法的研究已有较多报道。随着染色剂的多样化,多个染色剂对显微切片进行复染的染色方法也越来越受关注。番红-固绿双染法是植物制片中最普通的二重染色法,染色手续简单并能清晰的显示出细胞的结构[3]。国内早在1960年江西师范学院的生物制片手册就已记录了番红-固绿双重染色法;1979年容寿柏尝试在其基础上尝试两色一步整染改进[4];而后很多学者对番红-固绿双染进行了减少耗时和提高染色效果的改进[5-6]。至今番红-固绿经典双染法已广泛运用于各类研究中。番红-固绿双染法多用于细胞化学成分区别较大的细胞切片,如制作树皮、树叶等植物组织的显微切片使用番红-固绿双染法镜检出石质化和栓质化的细胞呈红色[7-8],制作应拉木鹅掌楸显微切片时使用番红-固绿双染法镜检出呈绿色的区域中胶质木纤维含量高[9]。而细胞化学成分差异较小的细胞切片,番红-固绿经典双染法会出现不适用的情况。
阿利新蓝[10]为羧基基团染色剂。在木材木质部中,羧基大多位于纤维素和半纤维素中,一般认为木质素中不存在羧基[11]。推测新蓝的染色目标应该与固绿是一致的。新蓝的染色研究在医学领域开展较多[12],在木材研究和植物研究领域仅有很少的报道[13]。新蓝与其他染料复染的相关研究国内几乎没有开展。为拓展木材显微切片的双染染色方法,以及进一步提高显微切片的清晰度和分辨率,从细胞染色角度入手建立一种更有效的显微制片方法。其中番红O 几乎可以与任何染料配合在一起,用作双重、三重或四重染色[3]。选取樟子松木质部为实验材料,采用了番红、固绿和阿利新蓝三种染料,对樟子松木材切片进行了单染和复染。就番红-新蓝双染法进行了改良,通过镜检和拍照比较染色效果,找到了效果满意的染色工艺流程,希望能得到广泛的实验和应用。
1 材料与方法
1.1 实验材料
樟子松木材采自黑龙江省鸡东县大顶山。树龄约22 a,在胸高处取10 cm 厚圆盘,带回实验室气干备用。番红O(Safranine O)(上海金穗公司)分子式为C20H19ClN4,相对分子质量:350.85;固绿(Fast green FCF)(MACKLIN 公司)分子式为C37H34N2O10S3Na2,相对分子质量:808.85;阿拉丁的阿利新蓝(Alcian blue 8GX)(上海阿拉丁生化科技股份有限公司)分子式为C56H68N16S4Cl14Cu,相对分子质量:1 295.86,以下简称新蓝。
1.2 显微切片制作
取樟子松中心条,以髓心开始的3 ~9年轮之间的木质部作为染色试样。使用纯净水进行90 ℃水浴软化2 h,使用日本电动式组织切片机REM-710 进行厚度15 ~20 um 组织切片,分别切取横切面、径切面和弦切面;应力释放6 h 后备用。染色剂为1%番红水溶液;0.5%固绿的95%乙醇溶液,1%新蓝的70%乙醇溶液。染色脱水后封片;染色流程对不同的树种和不同的部位存在一定差异[14],本研究所用染色流程见表1。常用封片方式有临时封片和永久性封片,临时封片是在脱水处理以后不进行透明处理而直接用甘油进行封片,临时封片操作少、出片速度快,本文选用临时封片。新蓝和固绿单染时脱水至染色剂对应的酒精浓度后染色即可,其他流程与番红单染流程基本一致。使用日本OLYMPUS BX51 光学显微镜观察切片并拍照,而后使用Oplenic 软件进行测量和记录。
改进后的番红-新蓝双染具体流程如下:1%番红染色60 min;30%~70%乙醇梯度脱水,各 2 min; 酸 洗1 min;1% 新 蓝 染 色2 min;70%乙醇洗净浮色后使用甘油封片。其中酸洗液为13%~17%冰乙酸的70%乙醇溶液。
1.3 管胞解离
选取第3 ~9年轮,将样品以早晚材分开,切成细条后使用富兰克林离析法解离樟子松管胞。将样品置于试管内,加入去离子水后放入70℃水浴锅至样品全沉水;而后换入由30%过氧化氢溶液与冰乙酸1∶1 混合制得的解离液中,放入沸水浴中蒸煮至试样膨化和完全变白;将样品取出,用去离子水进行冲洗5 ~6 次,分别滴入番红、固绿和新蓝进行染色;观察时只需将其滴在载玻片上并盖上盖玻片即可,使用日本OLYMPUS BX51 光学显微镜观察。

表1 脱水和染色流程Table 1 Dehydration and dyeing treatment
2 结果与分析
2.1 单染
对樟子松横切面显微切片进行番红、固绿和新蓝单染效果如图1 所示。图1-a 是使用番红染色,其中早晚材管胞均被染成红色,射线位置也被染上红色;图1-b 图是使用固绿染色,早晚材管胞被染成蓝绿色,射线上染颜色较淡,能观察到有沉积的色块;图1-c 图是使用新蓝染色,对轴向管胞上染程度极低,射线位置能观察到染上了明显蓝色。有学者研究认为新蓝对针叶材的管胞几乎不染色,对泌脂细胞和薄壁细胞染色效果较好[13],据此推测:图1-c 图中射线位置被新蓝染成明显蓝色的细胞是射线薄壁细胞。仅以细胞壁的染色情况排序:番红染色效果优于固绿,新蓝染色效果最差。

图1 三种染料单染效果Fig.1 Staining effect of three dyes
2.2 复染
为比较对木材显微切片的番红-固绿复染和番红-新蓝复染效果。对樟子松三切面进行番红-固绿双染后效果见图2 中a、b 和c,三图中仅呈现红色,未见细胞被染为明显绿色。图2-a 中在轮界线上能够观察到极其轻微的绿色;在图2-b 图中能看到很多固绿沉积的绿色色块;图2-c 中观察不到有绿色。番红-新蓝双染效果见图2 中d、e 和f。与番红-固绿双染不同,番红-新蓝双染后能观察到部分细胞被染成蓝绿色。图2-d 中横切面上射线薄壁细胞被染为蓝绿色,树脂道内也能观察到被染成蓝绿色的薄壁细胞和内含物;图2-e 中单列木射线内的射线薄壁细胞被染为蓝绿色,纺锤形木射线中多见绿色的薄壁细胞包裹絮状团的结构;图2-f 中也能观察到射线薄壁细胞染成了绿色,但是绿色分布不均,染色程度较低。
樟子松管胞和薄壁细胞的化学成分存在差异。管胞木质化程度高于薄壁细胞,管胞细胞壁含大量木质素和结晶度较高的纤维素,薄壁细胞细胞壁内纤维素和半纤维素含量高于木质素。固绿在水溶液中溶解度为4%,在酒精内溶解度能达到9%[14]。在其他学者的研究中番红-固绿双染时,固绿上色较快,15 s 就能对细胞进行染色[15-17]。本次实验中使用的是1%固绿溶液(95%乙醇溶剂)染色时间2 min,依然没有染上绿色。因此番红-固绿双染不适用于樟子松木质部显微切片,固绿都沉积成了色块,没有对细胞进行染色。新蓝多用于医学领域对动物细胞染色,属于阳离子染料,能与组织内含有的阴离子基团,如羧基和硫酸根等形成不溶性复合物[18-19]。本次番红-新蓝双染实验中,樟子松管胞被染成红色,薄壁细胞(射线薄壁细胞和泌脂细胞均为薄壁细胞)被染成蓝绿色。说明了番红-新蓝双染适用于樟子松木质部显微切片的染色。

图2 复染与改进后效果Fig.2 The staining and improved results
医学领域内有文献报道称,新蓝在酸性环境下对羧基着色效果更为活跃[18-19]。对番红-新蓝双染工艺进行改进,在新蓝着色过程中为其提供一个酸性反应环境。染色改进后,木材细胞染色清晰、染色程度较高、易于辨识,见图2 g ~ l。能够看到经过改进后的番红-新蓝双染法区分细胞组织的能力非常优秀,把樟子松轴向管胞染成红色,把樟子松射线薄壁细胞和树脂道泌脂细胞染成蓝色,红色和蓝色两个颜色之间没有出现相互混合的现象。特别是在图2-l 中,番红-新蓝双染对薄壁细胞的染色效果明显比图2-f 未改进前的染色效果要好,能看到不仅厚壁管胞被均匀的染成红色,射线薄壁细胞也被均匀的染成亮蓝色,从染色效果上能看出酸性反应环境提高了新蓝对薄壁细胞的染色活力。能够清楚的观察到射线薄壁细胞和射线管胞的形态。清楚地观察到射线管胞内壁有锯齿状加厚,锯齿状加厚存在于硬松类,如马尾松、油松和黑松等。而在红松、华山松和白皮松等软松类中射线管胞内壁平滑。锯齿状加厚对木材识别与鉴定具有重要意义[11]。
酸洗过程会破坏番红的着色,冰乙酸含量过高会导致切片上番红严重褪色;酸洗不足则难以提高新蓝活性,导致切片染色不均匀或不上色。研究以后酸洗液配比为13%~17%冰乙酸的70%乙醇溶液是效果较好的。研究动物骨骼和粘液细胞染色的学者们发现:亮蓝色是新蓝染色效果较好和染色活力较高的宏观表现[19-20]。
2.3 解离后管胞和树脂道的染色
在针叶材管胞形态的研究中,管胞解离是比较常用的方法。在管胞解离以后需要对管胞进行染色处理,高质量的染色能有效地帮助观察者判别管胞是否完整。前文已得知三种染料对管胞单染的效果是:番红染色效果优于固绿,新蓝染色效果最差。但是分别将番红、固绿和新蓝用于已解离的管胞染色后,出现了一个有趣的现象:新蓝对管胞的染色效果最好、程度最高,如图3 所示。图3-a 显示管胞被番红染成红色,图3-b 反映固绿染色效果较差,图3-c 中管胞被新蓝染成了蓝色。新蓝对管胞上色效果较好的原因可能是解离体系中含有冰醋酸渗入管胞腔,在冲洗时没有完全去除,而冰醋酸的存在恰恰改变了染色体系的pH 值,提高了新蓝对管胞的上染。静置1 天后使用pH 试纸测得,管胞内残留的乙酸使得溶液变成了酸性。新蓝管胞溶液依旧无色透明,能用肉眼观察到新蓝全染到了悬浮的管胞上。证明冰乙酸中的-COOH 没有参与反应,新蓝是对管胞上的-COOH 染色。番红染色效果比新蓝略差,固绿染色程度远低于前二者。

图3 解离后管胞的染色,Fig.3 The processed tracheid
分别将番红、固绿和新蓝用于樟子松含树脂道的显微切片染色,得到的效果如图4 所示。能观察到图4-a 和图4-b 中番红和固绿分别把切片内所有细胞和内含物都染上了颜色。番红、固绿和新蓝都能对树脂道的内含物染色,再加上新蓝对轴向管胞上染程度极低的反差,在以树脂道为研究对象的显微切片制作中新蓝单染是最好的选择。
3 结论与讨论
对樟子松横切面显微切片进行番红、固绿和新蓝单染后镜检得,番红对木质化程度高的厚壁管胞染色效果最好;新蓝对木质化程度低的薄壁细胞染色效果最好;固绿染色效果居于两者之间。对比樟子松横切面显微切片复染效果得,该流程操作下番红-固绿双染不适用于樟子松木质部显微切片的制作,固绿都沉积成了色块,没有对细胞进行染色。番红-新蓝双染能区分樟子松细胞组织,樟子松管胞被染成红色,薄壁细胞(射线薄壁细胞和泌脂细胞均为薄壁细胞)被染成蓝绿色。薄壁细胞的染色不够理想,改进后的番红-新蓝双染效果较好,能清楚地区分木材细胞组织,薄壁细胞染色更加充分、均匀。
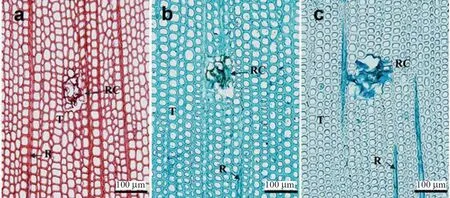
图4 树脂道的染色Fig.4 Staining of resin canal
已有较多对木材组织染色的同类研究,如能染细胞内脂类物质的苏丹黑[21];能染高度木质化、栓质化细胞的番红[22]和甲苯胺蓝[23];能染糖类的高碘酸-Schif[24]等。该方法优点在于能够简单快速的区别木材中薄壁细胞和厚壁细胞。传统的番红-固绿双染能够通过调控时间来达到对不同石质化细胞的区分,调控时间来达到区分不同木材的薄壁细胞将是该方法进一步的研究方向。往后计划将对多种木材进行试验,验证该方法的可靠性和普试性,解决本次试验样本单一的问题。在对一些特殊木材的试验中,如应力木,应该结合现代仪器分析技术,完善该方法,达到定性、半定量甚至定量的目的。对解离后的管胞染色观察发现,新蓝单染效果略高于番红,二者都能够得到很好的观察效果,但从经济方面考虑,番红依旧是解离后对细胞进行染色的首选。在以树脂道为研究对象的显微切片制作中新蓝单染是最佳选择。综上所述,木材细胞对不同染料响应各异,同时也受到染色介质的影响。
