经皮冠状动脉介入术术后病人CYP2C19*2、CYP2C19*3和PON1 基因多态性与氯吡格雷血药浓度及疗效的相关性分析
2020-02-10范洁詹三华袁孔现
范洁,詹三华,袁孔现
作者单位:铜陵市人民医院药学部,安徽 铜陵 244000
阿司匹林和氯吡格雷双联抗血小板治疗已成为目前急性冠状动脉综合征(acute coronary syndrome,ACS)和经皮冠状动脉介入术(percutaneous coronary intervention,PCI)的标准化治疗方案。然而,各种遗传以及临床的因素会导致氯吡格雷疗效出现个体差异[1]。其中以氯吡格雷抵抗研究较多,而对出现出血、胃肠道损害等不良反应的研究较少。不良反应的产生亦是病人依从性降低,进而导致心血管事件发生的重要影响因素。
氯吡格雷为前体药物,口服后吸收快速但不完全,吸收率>50%。氯吡格雷吸收后广泛经肝脏代谢,其中约85%经酯酶水解为非抗血小板活性的羧酸氯吡格雷(SR26334),约15%进行硫醇化的代谢活化[2]。代谢活化过程主要由CYP2C19 基因编码的肝细胞色素(CYP)450 和对氧磷酶1(PON1)等介导,活化后的代谢产物与血小板膜上的P2Y12受体结合,会有效阻断二磷酸腺苷(ADP)与其结合,最终抑制血小板活化和聚集[3-4]。若参与编码此过程有关蛋白的基因发生遗传变异,可能会引起活性药物浓度差异,进而会影响到药物疗效。
CYP2C19 基因作为影响氯吡格雷代谢最重要的基因,其遗传变异已引起人们的极大重视。CYP2C19*2突变型是CYP2C19第5外显子在第681位的突变导致的5’端40 bp 碱基缺失,从而改变了mRNA 的阅读框架并产出无功能的CYP2C19*2酶[5];CYP2C19*3突变型是第4外显子在第636位的突变造成终止密码子提前,产生出了代谢功能极低的CYP2C19*3 酶[5]。我国人群中CYP2C19*2、CYP2C19*3 分布的频率分别约为24%~25%、2%~3%[6],也是亚洲人群中最常见的突变位点[7]。除此之外,对氧磷酶1(PON1)作为参与氯吡格雷第二步生物转化中的代谢的一种限速酶,其基因启动子区域功能性位点突变(126C>G)亦会影响PON1 基因表达水平,从而改变PON1 酶活性[8],可能也是影响氯吡格雷血药浓度及治疗效果的关键因素。为此,本文以PCI术后行阿司匹林和氯吡格雷双联抗血小板治疗病人为研究对象,对不同基因型与氯吡格雷及非抗血小板活性代谢产物羧酸氯吡格雷(SR26334)血药浓度之间的关系进行探讨,试图进一步理解以上相关基因多态性与氯吡格雷药物抗血小板聚集效果之间的联系,以便为该类病人合理用药方案提供依据。
1 资料与方法
1.1 纳入对象选取2017年12月至2018年5月在铜陵市人民医院接受冠脉造影检查和PCI术治疗的住院病人51例,诊断为冠心病(CHD)或急性心肌梗死,年龄范围为44~91岁。接受氯吡格雷+阿司匹林的双联抗血小板治疗(围手术期间均给予阿司匹林100 mg/d+氯吡格雷负荷剂量75 mg/d)。病人或其近亲属对本研究知情同意,签署了知情同意书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 观察指标及随访纳入符合条件的病人,详细记录病人临床基本特征(如性别、年龄、吸烟史、饮酒史),疾病史(如高血压病史、糖尿病病史等),合并用药以及PCI相关信息(如病变血管数等)。通过再入院记录、门诊以及电话随访病人术后出血事件。随访半年内所发生的出血事件。根据其严重程度分为轻度出血(包括皮肤、鼻腔、牙龈等出血)、中度出血(消化道出血)、重度出血(颅内出血等)。心血管事件(MACE)包括支架植入后心绞痛、支架内再狭窄、再发心梗等。
1.3 试剂氯吡格雷化学对照品(Clopidogrel,European Pharmacopoeia Reference Standard,ID:001C8D)、羧酸氯吡格雷化学对照品(Clopidogrel Carboxylic Acid,Vaughan Ontario L4K 4C7 Canada,Lot:1427-057A5)、艾司唑仑化学对照品(Estazolam,国家麻醉品实验室,1218-9802)。甲醇、乙腈、甲基叔丁基醚均为色谱纯(美国TEDIA 公司),KH2PO4和H3PO4为分析纯试剂,水为经0.45 μm 微孔滤膜过滤注射用水。空白血浆由本院血库提供的健康献血者血浆。
1.4 仪器高效液相色谱仪,日本岛津生产,型号SPD-20AV。电动离心机,常州医科诺仪器有限公司,型号800D。超低温冰箱,日本三洋电机生物医学有限公司生产,型号MDF-382E。电热恒温水浴锅,上海跃进医疗仪器厂,型号XMTD-204。焦磷酸测序仪,凯杰公司生产,型号PyroMark*Q24 MDx。
1.5 实验方法
1.5.1 氯吡格雷及SR26334血药浓度测定 病人服药3 d后,在第4天服药30 min后,静脉采血2 mL入EDTA抗凝真空采血管,4 000 r/min离心10 min得血浆样本,经甲基叔丁基醚萃取、N2吹干后,采用反相高效液相色谱(RP-HPLC)法(色谱柱:KromasilTM 100A C18(150 mm LD×4.6 mm ID,5μm),流动相:10 mmol/L KH2PO4溶液(含0.25% H3PO4)-乙腈(50∶50),流速:1.0 mL/min,检测波长:220 nm,柱温:40 ℃),并以艾司唑仑为内标测定氯吡格雷及SR26334的血浆药物浓度。
1.5.2 基因检测 按照核酸提取纯化试剂盒(长沙三济生物科技有限公司)说明书步骤提取基因组DNA,采用焦磷酸测序技术检测CYP2C19*2(681G>A)、CYP2C19*3(636G>A)、PON1(126C>G)三个位点。根据CYP2C19基因突变而引起酶代谢活性的不同,把携有野生型基因(*1/*1)归为快代谢型(EM),突变杂合型(*1/*2、*1/*3)为中间代谢型(IM),突变纯合型(*2/*2、*2/*3、*3/*3)为弱代谢型(PM)。
1.6 统计学方法计量资料以表示,两组间数据比较采用独立样本t检验,多组间数据比较采用单因素方差(ANOVA-Bonferroni)分析。遗传平衡采用Hardy-Weinberg平衡定律分析。计数资料采用χ2检验。采用SPSS 21.0 软件进行统计学分析,P<0.05表示差异有统计学意义。
2 结果
2.1 HPLC 色谱图分别取标准溶液、空白血浆、空白血浆+标准品、样品血浆经预处理后进样检测,发现SR26334 保留时间为1.8 min(峰1)、内标化合物艾司唑仑保留时间为4.2 min(峰3)、氯吡格雷保留时间为7.4 min(峰2),基本无杂质峰干扰。色谱图中SR26334、艾司唑仑、氯吡格雷能得到基线分离且与各化学对照品保留时间一致,在此实验条件下所测得结果可以反映血药浓度,见图1。
2.2 CYP2C19、PON1 基因型及频率分布CYP2C19*2(681G>A)、CYP2C19*3(636G>A)、PON1(126C>G)等位基因、基因型频率分布(表1)。达到Hardy-Weinberg遗传平衡(P>0.05),具有群体代表性。

表1 CYP2C19和PON1基因型及等位基因的频率分布

图1 氯吡格雷和SR26334 HPLC色谱图:A为标准品色谱,B为空白血浆色谱,C为空白血浆+标准品色谱,D为样本血浆色谱
2.3 氯吡格雷CYP2C19基因分型与体内血药浓度之间的关系氯吡格雷活性硫醇代谢物存在4种异构体,其中有活性的为H4。H4极不稳定,在空气中易氧化,衍生化后的MP-H4稳定性大大提高[9]。但体内MP-H4血药浓度极低,且半衰期只有0.5 h[10],必须要使用HPLC-MS/MS 法,对检测技术要求很高。而相同条件下,体内SR26334 血药浓度是活性代谢产物的千倍,常规RP-HPLC 法即可检测SR26334。病人第4 天服药30 min 后静脉采血,测定氯吡格雷、SR26334血药浓度。CYP2C19基因分型对血药浓度的影响(表2)及各基因型之间血药浓度的比较(图2):CYP2C19基因分型与SR26334相关性较好,快代谢型、中代谢型与弱代谢型SR26334 血药浓度相比较,有明显增加趋势。快代谢型与弱代谢型SR26334血药浓度之间差异有统计学意义(P<0.05)。

表2 CYP2C19基因分型对血药浓度的影响

图2 CYP2C19不同基因型之间血药浓度的比较
2.4 氯吡格雷PON1(126C>G)基因型与体内血药浓度之间的关系PON1(126C>G)CC 比CG,CC 比GG,CG 比GG 基因型组Bonferroni 矫正后均P>0.05。但PON1(126C>G)野生型(CC 型)与突变型(CG+GG 型)病人SR26334 血药浓度:(1.45±0.63)μg/mL 比(1.09±0.32)μg/mL,差异有统计学意义(P=0.047),见图3。
2.5 SR26334 峰浓度与终点事件相关性分析本实验共收集到符合条件的病人51 例。随访期间27例病人术后良好,为正常组,15 例病人出现了心血管事件(MACE),分为MACE 组,其中心源性死亡1例,支架内再狭窄7 例,心绞痛再发7 例。9 例在随访期间出现了出血事件,成为出血组。分别测定51例病人稳态下的血药峰浓度。
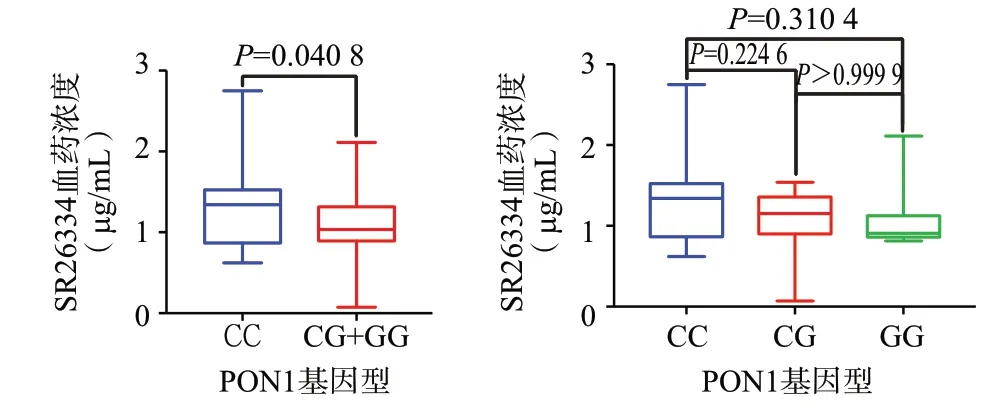
图3 PON1(126C>G)不同基因型之间血药浓度的比较
测定结果:正常组(n=25)血药浓度为(1.51±0.48)μg/mL,MACE 组(n=15)血药浓度为(1.06±0.65)μg/mL,出血组(n=9)血药浓度为(1.85±0.32)μg/mL。正常组比MACE组差异有统计学意义(P<0.05),正常组比出血组P>0.05(均经Bonferroni 校正)。见图4。

图4 三组之间SR26334血药浓度比较的箱式图
2.6 根据基因型进行分组时MACE及出血事件的发生率 各基因型组MACE及出血事件的发生率见表3,4。经统计比较,各基因型组MACE 及出血事件的发生率差异无统计学意义(P>0.05)。
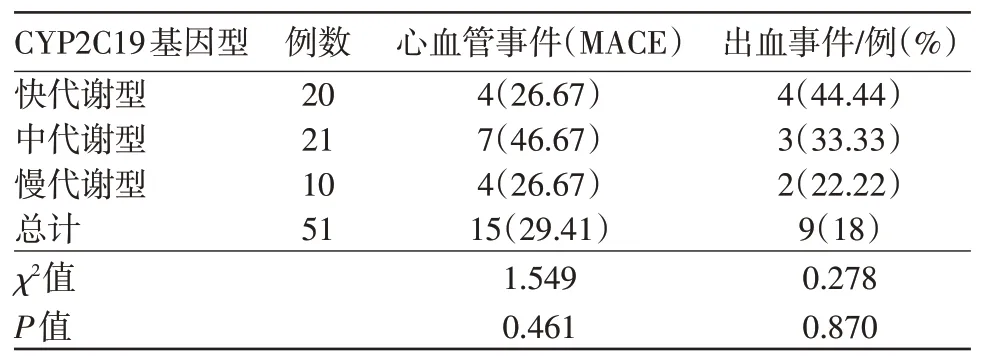
表3 CYP2C19基因型与终点事件相关性分析

表4 PON1基因型与终点事件相关性分析/例(%)
3 讨论
氯吡格雷作为血小板P2Y12 受体的拮抗剂,需要人体中经过肝脏代谢转化为活性代谢产物以发挥其药理作用[11]。由于其代谢途径复杂,包括病人体重、年龄,代谢途径中关键酶的基因多态性,以及联合用药等因素可能影响该药的抗血小板作用[12]。目前对可能影响氯吡格雷体内代谢的CYP2C19*2、CYP2C19*3和PON1等基因研究较多。2010年美国食品药品监督管理局(FDA)在氯吡格雷的药物说明书中增加了“黑框警告”,提醒医生对病人进行CYP2C19*2 和*3 等位基因的检测[13]。但是对于这两项结果的实际临床意义以及就此作出治疗方案的调整尚未明确。服用氯吡格雷后,SR26334 在血液循环中具有较高浓度,SR26334 半衰期约为7~8 h[14],使得采用常规液相色谱-紫外检测器联用检测SR26334成为可能,增加了该检测方法的可推广性。此外,有研究表明,血浆SR26334最大浓度及AUC与服用剂量成线性关系[15],可为血浆SR26334 浓度检测的必要性提供支持。本研究通过考察CYP2C19*2、CYP2C19*3 和PON1 基因多态性对SR26334 血药浓度影响,以及对终点事件的影响,以便为临床个体化用药方案设计提供更多的方法与有效数据支持。
研究报道,CYP2C19*2和*3突变为功能缺失等位基因,使CYP2C19 酶活性降低,氯吡格雷代谢减弱,甚至导致氯吡格雷抵抗[16]。人对氧磷脂酶1(PON1)是一种钙依赖性的芳香酯水解酶,可以代谢氯吡格雷、阿司匹林等物质[17]。纳入本研究的51例病人,接受了氯吡格雷+阿司匹林的双联抗血小板治疗(口服氯吡格雷负荷剂量300 mg+维持剂量75 mg/d)。进行了CYP2C19*3 和PON1 基因检测以及测定了氯吡格雷及非抗血小板活性代谢产物SR26334 血药浓度。结果显示,CYP2C19 快代谢型与弱代谢型SR26334血药浓度之间差异有统计学意义(P<0.05),PON1(126C>G)野生型(CC型)与突变型(CG+GG 型)病人SR26334 峰浓度间差异有统计学意义(P<0.05)。从而提示,在病人未接受氯吡格雷基因分型前,SR26334 血药浓度对于氯吡格雷抗血小板治疗方案的调整以及药物疗效的评价具有一定的指导意义。SR26334血药峰浓度与心血管事件的发生差异有统计学意义(P<0.05)。但与出血事件的发生差异无统计学意义(P>0.05),可能出血事件的发生与联用其他药物(如华法林、他汀类)、非抗血小板活性代谢产物SR26334 的药理作用、以及伴随疾病(如高血压、糖尿病)等,都有可能导致术后氯吡格雷所致出血,还需进一步研究考察。本研究结果显示CYP2C19 基因型与终点事件的发生无明显相关(P>0.05),可能与参与氯吡格雷代谢途径的基因较多有关,包括药物吸收、代谢在内等多种复杂因素的影响。
