西番莲种籽中总黄酮的体内抗氧化活性及其 成分分析
2020-02-08卢明剑胡志敏吕秋洁
李 焱,黄 苇,,卢明剑,胡志敏,吕秋洁
(1.华南农业大学食品学院,广东 广州 510642;2.华南农业大学工程学院,广东 广州 510642)
生物代谢过程中会不断地产生自由基,自由基产生和消除之间的动态平衡被打破时,生物体将处于氧化应激状态[1]。过量积累的自由基会通过氧化作用破坏细胞脂质、蛋白质和DNA,造成细胞的氧化损伤[2],导致生物体的细胞凋亡、组织受损。生物体利用内源性和外源性抗氧化物质来防止细胞的氧化损伤[3]。黄酮类化合物具有抗菌[4]、抗氧化自由基[5]、抗癌[6]等药理活性,作为外源性抗氧化剂在食药方面的应用逐渐成为研究热点。
紫果西番莲(Passiflora edulisSims)属西番莲科,广泛种植于热带、亚热带地区,其果汁香味浓郁,主要用于生产饮料。西番莲果的种籽占整果质量的4%~12%,含油量约占27%[7-8],但在果汁加工中一般被作为废物丢弃。黄酮存在于西番莲全草的不同部位,已有研究表明,其叶片中含有荭草素、异牡荆素[9]、木樨草素-7-O-葡萄糖苷[10]等,茎中含有白杨素、木樨草素[11]等,果皮中含有芹菜素-8-C-β-二氧吡啉[12]等;其种籽中也含有相当丰富的黄酮[13],但对其种籽黄酮的体内抗氧化活性及具体成分研究鲜见报道。
本实验用紫果西番莲种籽黄酮灌胃D-半乳糖氧化损伤模型小鼠,测定总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力及丙二醛(malondialdehyde,MDA)、蛋白质羰基含量等多种生化指标,评价西番莲种籽黄酮作为外源性抗氧化剂的体内抗氧化活性,并采用液相色谱-电喷雾四极杆飞行时间质谱(liquid chromatography coupled with electrospray ionization-quadrupole-time of flight mass spectrometry,LC-ESI-Q-TOF-MS)技术对其成分构成进行分析,推测出可能的裂解途径,以期为紫果西番莲种籽的深入开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级昆明种雄性小鼠60 只,体质量(20f 2)g,购自南方医科大学,生产许可证号:SCXK(粤)2016-0041。
紫果西番莲品种为‘紫香一号’,购自广州市天平架市场。
AB-8大孔树脂 东鸿化工有限公司;T-SOD、MDA、CAT、GSH-Px、蛋白质羰基试剂盒 南京建成生物工程有限公司;甲醇、甲酸(均为色谱纯) 天津市富宇精细化工有限公司;D-半乳糖、VC等其他试剂均为国产分析纯。
1.2 仪器与设备
1290-6540B LC-ESI-Q-TOF-MS仪 美国安捷伦公司; 12ND冷冻干燥机 宁波新芝生物科技股份有限公司;TGL-16M高速台式冷冻离心机 湘仪离心机仪器有限 公司;HL-2B恒流泵 上海沪粤科学仪器有限公司。
1.3 方法
1.3.1 种籽黄酮的制备
1.3.1.1 种籽黄酮的提取
参考文献[13]的方法,西番莲果取汁后,种籽漂洗干净,于55 ℃烘箱中烘干,粉碎,过孔径0.425 mm筛。称取适量干燥的种籽粉末,加入石油醚进行提油(85 ℃冷凝回流70 min),挥发干净石油醚,得种籽油粕。称取种籽油粕样品,每克种籽油粕样品加入56.02 mL体积分数73.78%的乙醇溶液,于超声温度80 ℃(冰水循环)、超声功率300 W条件下提取50 min,再置于微波处理器中,设置微波功率160 W,提取90 s。提取完毕后抽滤,浓缩至无乙醇味,真空冷冻干燥得总黄酮粗提物,备用。种籽黄酮粗提物的提取量为(117.53f 0.42)mg/g。
1.3.1.2 种籽黄酮的纯化
预处理AB-8大孔树脂,配制1.3.1.1节中的黄酮粗提液(质量浓度为1.0 mg/mL),调节上样液的pH值为3, 以9 r/min流速上样120 mL,再用150 mL的蒸馏水以 6 r/min流速淋洗,之后用90 mL体积分数为70%的乙醇溶液以12 r/min流速进行洗脱。取洗脱液浓缩至无乙醇味,真空冷冻干燥得到纯化总黄酮,备用。种籽黄酮经纯化后纯度为(70.14f 0.12)%。
1.3.2 种籽黄酮体内抗氧化活性的评价
1.3.2.1 小鼠分组与处理
参照[2012]107号《关于印发抗氧化功能评价方法等9 个保健功能评价方法的通知》中抗氧化功能评价方法[14]及罗磊等[15]的方法设计动物实验,以氧化损伤模型小鼠评价种籽黄酮体内抗氧化活性。小鼠适应性饲喂一周后,随机分为6 组(每组10 只),设定为空白组、模型组、VC组及种籽黄酮低、中、高剂量组。除空白组皮下注射生理盐水外,其余各组均按200 mg/(kgg d)注射D-半乳糖进行造模,各组连续注射30 d,以构建D-半乳糖氧化损伤模型。造模的同时,种籽黄酮各剂量组分别按60、120、240 mg/(kgg d)剂量灌胃纯化总黄酮,阳性对照组灌胃100 mg/(kgg d)VC,空白组和模型组灌胃生理盐水。注射及灌胃体积均为0.1 mL/10 gmb,每日1 次,实验期间所有小鼠不限制摄食及饮水。
1.3.2.2 组织样品的制备
末次灌胃后,全部小鼠禁食12 h,摘眼球取血后脊椎脱臼法处死小鼠,取肝、肾以预冷的生理盐水漂洗,滤纸吸干。用冰生理盐水在4 ℃条件下匀浆组织,得到质量分数10%的初始样品。于4 ℃、4 500 r/min下离心10 min后取上清液,-20 ℃保存待测。
1.3.2.3 生化指标的测定
小鼠肝、肾组织中的T-SOD、CAT、GSH-Px活力和MDA、蛋白质羰基含量测定均按照试剂盒说明书进行。
1.3.3 种籽黄酮成分的分析
1.3.3.1 色谱条件
色谱柱:Zorbax SB-C18(250 mmh 4.6 mm ,5 μm)。流速1.0 mL/min,柱温30 ℃,检测波长280 nm,进样量10 μL。采用二元高压梯度洗脱,流动相A为甲醇,流动相B为体积分数0.25%甲酸溶液。洗脱程序:0~10 min,15%~45% A;10~20 min,4 5%~6 0% A;2 0 ~3 5 m i n,6 0%~1 0 0% A;35~40 min,100%~15% A。
1.3.3.2 质谱条件
电喷雾电离正离子模式下采集数据;质量扫描范围m/z50~1 000;毛细管电压100 V;雾化气压力45 psi;干燥器流量9 L/min;干燥气温度300 ℃。
1.4 数据统计与分析
2 结果与分析
2.1 种籽黄酮体内抗氧化活性的评价结果
SOD是一类金属酶,其活力能反映出细胞免受氧化损伤的能力[16]。CAT可催化H2O2分解为H2O和O2,增强机体抗自由基的能力[17]。GSH-Px催化GSH与H2O2生成氧化型谷胱甘肽,其经GSH还原酶作用,接受H+还原成GSH,GSH-Px通过上述作用保护细胞膜结构和功能不受氧化损伤[18]。MDA是生物膜中多不饱和脂肪酸发生脂质过氧化作用形成的最终产物之一,其含量可反映机 体内脂质过氧化作用的程度,从而间接反映细胞损伤的程度[19]。蛋白质羰基的产生是其发生氧化损伤的重要标志,自由基攻击氨基酸分子中游离氨基或亚氨基最终产生羰基衍生物,其含量反映了细胞氧化程度[20-21]。
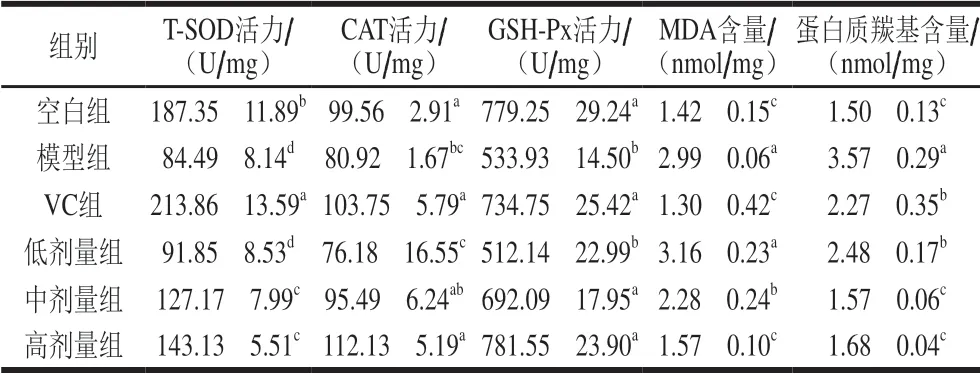
表 1 小鼠肝组织中T-SOD、CAT、GSH-Px活力和MDA、 蛋白质羰基含量Table 1 Effect of total falvonoids from the seeds of Passifolra edulis Sims on T-SOD, CAT and GSH-Px activities and MDA and protein carbonyl contents in liver tissue of mice
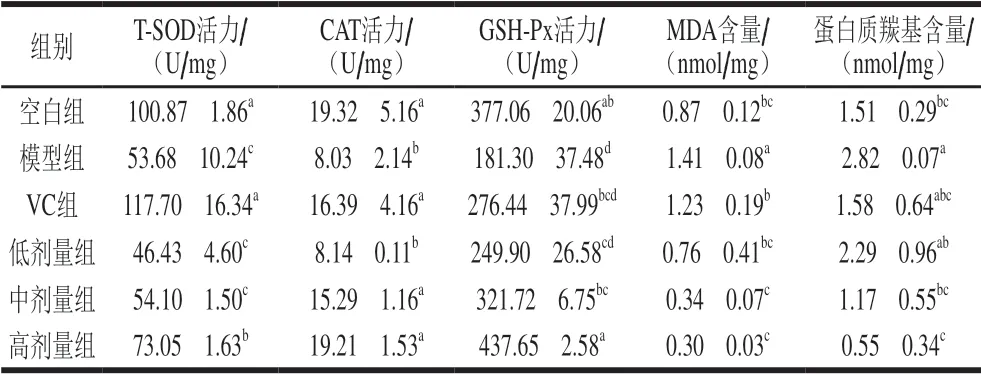
表 2 小鼠肾组织中T-SOD、CAT、GSH-Px活力和MDA、 蛋白质羰基含量Table 2 Effect of total falvonoids from the seeds of Passifolra edulis Sims on T-SOD, CAT and GSH-Px activities and MDA and protein carbonyl contents in kidney tissue of mice
由表1、2可知,模型组小鼠肝、肾组织的T-SOD、CAT、GSH-Px活力均显著低于空白组(P<0.05),而MDA、蛋白质羰基含量均显著高于空白组(P<0.05),表明模型组小鼠发生了氧化损伤,D-半乳糖氧化损伤模型建造成功。
以中、高剂量种籽黄酮灌胃小鼠后,除了中剂量组小鼠的肝组织CAT活力和肾组织T-SOD活力以外,其余中、高剂量组小鼠肝、肾组织的T-SOD、CAT、GSH-Px活力均显著高于模型组(P<0.05)。与模型组相比,中剂量种籽黄酮使小鼠肝组织的T-SOD活力提高了50.51%、CAT活力提高18.01%、GSH-Px活力提高29.62%,高剂量种籽黄酮使小鼠肝组织的这3 种抗氧化酶活力分别提高了69.40%、38.57%、46.38%;中剂量种籽黄酮使小鼠肾组织的T-SOD活力提高了0.01 倍、CAT活力提高了0.90 倍、GSH-Px活力提高了0.77 倍,高剂量种籽黄酮使小鼠肾组织的这3 种抗氧化酶活力分别提高了0.36、1.39、1.41 倍。以上结果表明,肝、肾组织的T-SOD、CAT、GSH-Px活力与种籽黄酮的灌胃剂量存在明显的剂量-效应关系,种籽黄酮剂量越大,3 种抗氧化酶活力越高。
中、高剂量种籽黄酮灌胃小鼠后,小鼠肝、肾组织的M D A、蛋白质羰基含量均显著低于模型组 (P<0.05)。与模型组相比,中剂量种籽黄酮使小鼠肝组织的MDA含量降低了23.75%、蛋白质羰基含量降低了56.02%,高剂量种籽黄酮使小鼠肝组织的MDA含量降低了47.49%;中剂量种籽黄酮使小鼠肾组织的MDA含量降低了75.89%、蛋白质羰基含量降低了58.51%,高剂量种籽黄酮使小鼠肾组织的MDA、蛋白质羰基含量分别降低了78.72%、80.50%。以上结果表明,肝、肾组织的MDA、蛋白质羰基含量与种籽黄酮的灌胃剂量存在剂量-效应关系,黄酮剂量越大,MDA、蛋白质羰基含量越低。
与VC组相比,种籽黄酮中剂量组小鼠肝组织的CAT、GSH-Px活力均无显著差异(P>0.05),蛋白质羰基含量显著降低(P<0.05),种籽黄酮高剂量组小鼠肝组织的MDA含量无显著差异(P>0.05);种籽黄酮中剂量组小鼠肾组织的CAT活力、GSH-Px活力、蛋白质羰基含量均无显著差异(P>0.05),MDA含量显著降低(P<0.05)。这表明种籽黄酮具有较好的体内抗氧化能力。
2.2 种籽黄酮成分分析结果
运用分子特征提取技术获取检测到的化合物信息,得到分子质量、分子式、一级质谱信息及二级质谱信息,结合相关文献报道推测裂解途径,推测得到的化合物及结构式如表3所示。
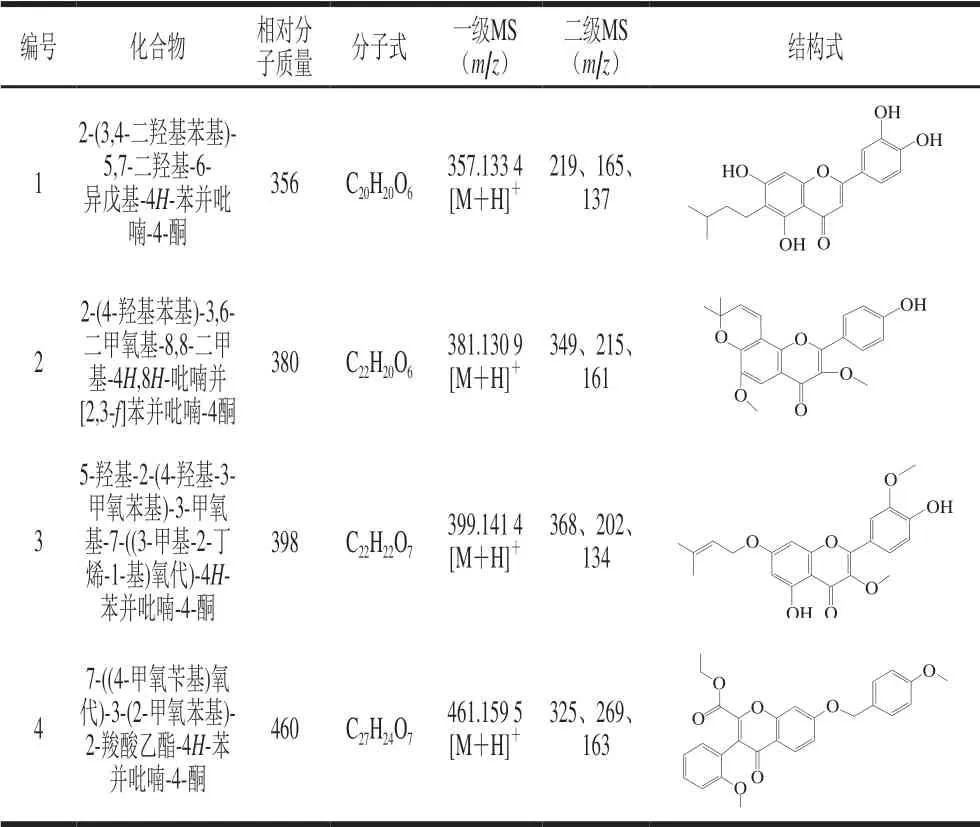
表 3 可供参考的黄酮类化合物信息Table 3 Available information on four flavonoids
化合物1:对质荷比为m/z357的准分子离子进行单离子提取,在保留时间为17.351 min检出目标离子。一级质谱中给出m/z357为[M+H]+,二级质谱给出m/z219、165、137,结合文献[22-24]推测其裂解途径,m/z219为黄酮母核γ-吡喃酮环裂解发生RDA(Retro-Didls-Alder)重排产生的奇电子碎片离子[25-26];m/z165是m/z219奇电子碎片离子上异戊基的苄基键断裂产生的䓬鎓离子,同时丢失了一分子异丁烷基;m/z137是m/z165丢失一分子CO产生的奇电子碎片离子。推测此化合物可能为 2-(3,4-二羟基苯基)-5,7-二羟基-6-异戊基-4H-苯并吡喃-4-酮,裂解途径如图1所示。
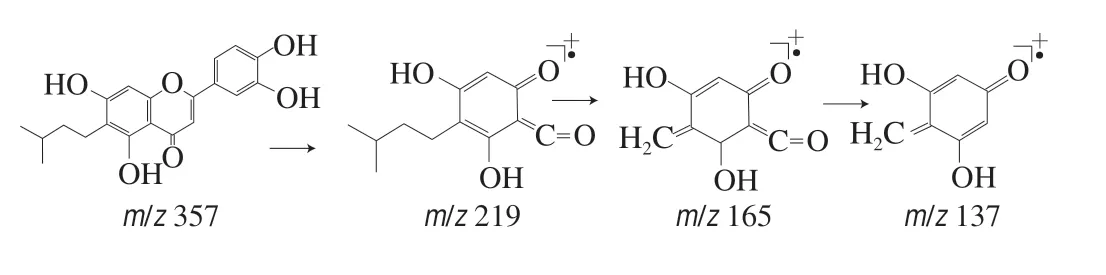
图 1 化合物1的裂解途径Fig. 1 Cleavage pathway of compound 1
化合物2:对质荷比为m/z381的准分子离子进行单离子提取,在保留时间为15.280 min检出目标离子。一级质谱中给出m/z381为[M+H]+,二级质谱给出m/z349、215、161,结合文献[23]推测其裂解途径,m/z349为 [M-CH3OH+H]+,由γ-吡喃酮环与甲氧基之间发生i键断裂产生;质荷比m/z349的γ-吡喃酮环裂解发生RDA重排反应且芳香醚发生Cü O键断裂,丢失—CH3产生m/z215;m/z161由m/z215丢失两分子—CO产生。由此推测此化合物可能为2-(4-羟基苯基)-3,6-二甲氧基-8,8-二甲基-4H,8H-吡喃并[2,3-f]苯并吡喃-4酮,裂解途径如图2所示。
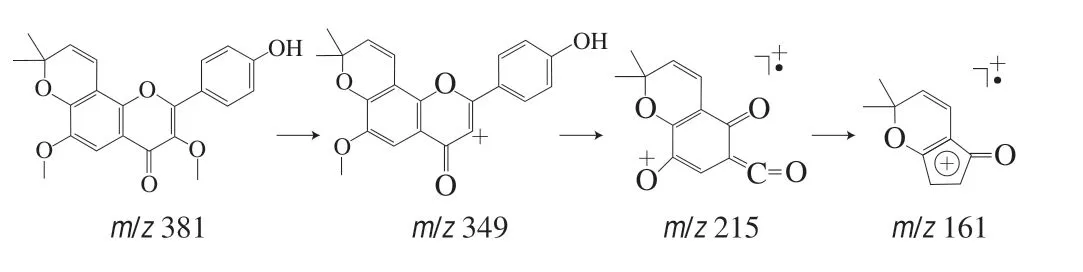
图 2 化合物2的裂解途径Fig. 2 Cleavage pathway of compound 2
化合物3:对质荷比为m/z399的准分子离子进行单离子提取,在保留时间为12.234 min检出目标离子。一级质谱给出m/z399为[M+H]+,二级质谱给出m/z368、202、134,推测其裂解途径,m/z368为[M-CH3OH+H]+,由γ-吡喃酮环与甲氧基之间发生i断裂产生;m/z368的γ-吡喃酮环发生RDA重排反应且失去一分子水产生m/z202;m/z134由m/z202发生芳香醚氢重排反应,同时丢失一分子3-甲基-1,2-丁二烯产生。因此推测此化合物可能为5-羟基-2-(4-羟基-3-甲氧苯基)-3-甲氧基-7-((3-甲基-2-丁烯-1-基) 氧代)-4H-苯并吡喃-4-酮,裂解途径如图3所示。
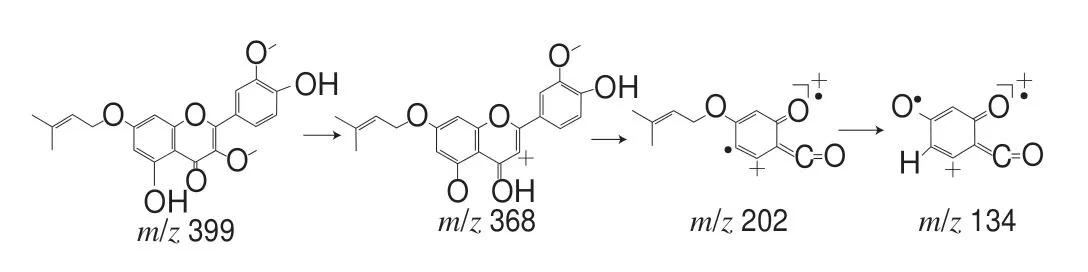
图 3 化合物3的裂解途径Fig. 3 Cleavage pathway of compound 3
化合物4:对质荷比为m/z461的准分子离子进行单离子提取,在保留时间为14.892 min检出目标离子。一级质谱给出m/z461为[M+H]+,二级质谱给出m/z325、269、163。推测其裂解途径,m/z325为[M-136+H]+,由黄酮母核B环芳香醚Cü O键断裂和A环芳香醚Cü O键断裂产生[12];m/z269由m/z325丢失两分子的—CO产生;m/z163为黄酮母核γ-吡喃酮环发生RDA重排反应产生的奇电子碎片离子。推测此化合物可能为7-((4-甲氧苄基)氧代)-3-(2-甲氧苯基)-2-羧酸乙酯-4H-苯并吡喃-4-酮,其裂解途径如图4所示。
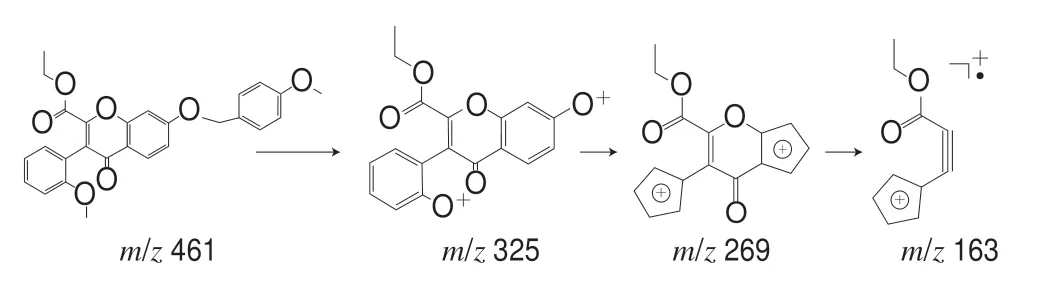
图 4 化合物4的裂解途径Fig. 4 Cleavage pathway of compound 4
3 讨 论
本实验通过皮下注射D-半乳糖构建氧化损伤小鼠模型,评价西番莲种籽黄酮的体内抗氧化活性。与空白组相比,模型组小鼠肝、肾组织的T-SOD、CAT、GSH-Px活力均显著降低(P<0.05),肝、肾组织的MDA、蛋白质羰基含量均显著升高(P<0.05),表明氧化损伤模型建造成功。与模型组相比,各剂量组随着黄酮灌胃剂量的增大,T-SOD和CAT、GSH-Px活力逐渐增大,MDA、蛋白质羰基含量逐渐降低,灌胃剂量与抗氧化作用存在剂量-效应关系。与VC组相比,在提高CAT、GSH-Px活力,降低MDA、蛋白质羰基含量方面,中、高剂量种籽黄酮的作用效果较好。
本实验采用LC-ESI-Q-TOF-MS技术对西番莲种籽黄酮成分进行分析,通过质谱数据及已报道的文献,对裂解方式进行推测,目前可推测出4 种西番莲种籽黄酮成分,分别为2-(3,4-二羟基苯基)-5,7-二羟基-6-异戊基-4H-苯 并吡喃-4-酮、2-(4-羟基苯基)-3,6-二甲氧基-8,8-二甲基-4H,8H-吡喃并[2,3-f]苯并吡喃-4酮、5-羟基-2-(4-羟基-3-甲 氧苯基)-3-甲氧基-7-((3-甲基-2-丁烯-1-基)氧代)-4H-苯 并吡喃-4-酮、7-((4-甲氧苄基)氧代)-3-(2-甲氧苯基) -2-羧酸乙酯-4H-苯并吡喃-4-酮。
黄酮类化合物结构上具有酚羟基,可以作为供氢体发生自由基消除反应,另外其邻二酚羟基结构可以螯合金属离子,抑制脂质氧化作用[27]。种籽黄酮通 过提高抗氧化酶活力、降低脂质过氧化程度增强抗氧化能力[28-29],其抗氧化活性可能是这4 种黄酮成分共同作用的结果。已有的研究表明西番莲果皮中的槲皮素[30]、叶片中的荭草素以及茎中的木樨草素与本研究中的化合物1具有相同的黄酮母核结构,但它们之间的体外抗氧化活性关系需要进一步研究。
在软电离条件下,黄酮类化合物母核质谱裂解通常发生在C环上[24],本研究中的4 种黄酮物质均发生了RDA裂解,并列出了其各自的特征碎片离子,本研究结果丰富了紫果西番莲全草的黄酮类别。LC-ESI-Q-TOF-MS技术提供多级高分辨质谱数据,在化合物结构鉴定中应用广泛,但该技术难以区分化合物的同分异构体[24],因此化合物结构的确定还需要深入研究。
