脱脂米糠可溶性膳食纤维对小肠葡萄糖吸收和转运的影响及其作用机制
2020-02-08丁晓萌侯坤友胡晓祎贾梦云谢建华
丁晓萌,侯坤友,胡晓祎,贾梦云,谢建华,陈 奕,余 强
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
糖尿病尤其是2型糖尿病(type-2 diabetes mellitus,T2DM)作为一种常见病,其发病率正随着人们生活质量的提高和生活方式的改变逐年增加,且患者趋于年 轻化[1]。饮食摄入的碳水化合物经过人体肠道中的淀粉酶和葡萄糖苷酶的催化水解后,释放出的单糖最终被小肠上皮细胞吸收并进入血液循环。研究证明,餐后高血糖水平与心肌血容量和血流量下降、视网膜病变等大血管疾病有关[2],对于T2DM患者,其危害远大于空腹血糖水平。所以控制餐后血糖水平,可以有效预防糖尿病及其他并发症的发生。
高纤维饮食或使用膳食纤维补充剂对健康有很多益处[3-4]。膳食纤维的众多活性功能之一是能够降低高糖食物摄入后人体对葡萄糖的吸收率,从而导致血糖反应曲线变钝,对胰岛素的需求减少[5]。根据膳食纤维在水中的溶解度,可将其分为不溶性膳食纤维(insoluble dietary fiber,IDF)和水溶性膳食纤维(soluble dietary fiber,SDF)。SDF由天然形成凝胶或黏性的纤维组成,如半纤维素、海藻多糖、瓜尔胶、果胶等[6]。目前,许多研究探讨了SDF降低餐后血糖的机制,如减缓胃排空[7];促进胰岛素分泌、拮抗胰高血糖素[8];抑制淀粉水解[9-10];抑制小肠葡萄糖的吸收[11]等。曹龙奎等[12]研究发现,经超 声-微波协同法改性的小米糠膳食纤维可以在体外抑制α-葡萄糖苷酶活性。但可溶性膳食纤维在小肠内抑制葡萄糖吸收和跨膜转运的具体分子机制报道较少。
米糠是稻米加工的主要副产品之一,每年我国有 1 000多万t米糠未被开发利用。脱脂米糠是米糠榨油后的残留物,含有膳食纤维、矿物质等多种营养物质[13]。本课题组使用绿色木霉发酵法提取脱脂米糠中可溶性膳食纤维,发酵后米糠可溶性膳食纤维相较于发酵前,其微观结构、持水力、持油力和对胆固醇的吸附能力均有明显改善[14]。本实验利用Caco-2细胞分别建立肠道葡萄糖吸收和转运模型[15-16],研究绿色木霉发酵法制备脱脂米糠可溶性膳食纤维(soluble dietary fiber from defatted rice bran,DRB-SDF)对小肠葡萄糖吸收和转运的影响,及其对吸收和转运过程中主要载体和相关酶类mRNA表达的影响,从分子水平初步探究DRB-SDF降低餐后血糖的作用机制,为降糖功能食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
脱脂米糠购自江西省天玉油脂有限公司;Caco-2细胞购自中国科学院细胞库。
DMEM高糖培养基(葡萄糖浓度25 mmol/L)、DMEM低糖培养基(葡萄糖浓度4 mmol/L)、L-谷氨酰胺、胰蛋白酶-EDTA消化液、阿卡波糖、D-(+)-麦芽糖、α-葡萄糖苷酶活性检测试剂盒、葡萄糖检测试剂盒、非必需氨基酸 北京索莱宝公司;Transwell培养板(24 孔,孔径3.0 μm) 美国康宁公司;胎牛血清(fetal bovine serum,FBS) 以色列BI公司;FastQuant cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂 天根生化科技有限公司;引物均由华大基因公司设计合成;其他试剂均为分析纯。
1.2 仪器与设备
实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪 美国Life Technologies公司;超净工作台 吴江市净化设备总厂;二氧化碳培养箱 美国Thermo公司;冷冻离心机 德国Sigma公司;倒置显微镜 日本Olympus公司。
1.3 方法
1.3.1 绿色木霉发酵法提取DRB-SDF
参照Jia Mengyun等[14]的方法,对粉碎过筛后的脱脂米糠进行绿色木霉发酵处理(发酵条件为绿色木霉接种量100 mL/L、发酵时间41 h、发酵pH 5.8、发酵温度28 ℃)后提取SDF,即获得DRB-SDF。
1.3.2 Caco-2细胞培养
用含16%(体积分数,下同)胎牛血清、1%非必需氨基酸、1%L-谷氨酰胺的DMEM高糖培养基培养Caco-2细胞,将细胞接种于培养瓶中后,放置于恒温培养箱(37 ℃、5% CO2、相对湿度95%)。本研究所用细胞传代数在30~40之间。每隔2 d更换细胞培养液。
1.3.3 细胞毒性检测
取处于对数生长期Caco-2细胞,调节细胞密度为5h 105个/mL,以每孔100 μL接种于96 孔板,置于恒温培养箱(37 ℃、5% CO2、相对湿度95%)培养。细胞贴壁后,吸去旧培养基,每孔添加100 μL含有不同质量浓度(1、2、4、8、16 mg/mL)DRB-SDF的DMEM高糖培养基,阳性组加入含25 μg/mL阿卡波糖的DMEM高糖培养基,正常组仅使用100 μL DMEM高糖培养基。培养2 h后,用10 μL CCK-8溶液处理细胞,然后使用酶标仪在450 nm波长处测定吸光度。正常组细胞活力记为100%。
1.3.4 葡萄糖吸收模型的建立
调节Caco-2细胞密度为1.5h 105个/mL,接种于6 孔板,置于恒温培养箱(37 ℃、5% CO2、相对湿度95%)中培养7 d。每隔2 d更换培养液。第7天吸去旧培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗两遍。实验以28 mmol/L麦芽糖作为底物,正常组每孔加入800 μL底物和200 μL DMEM低糖培养基;阳性对照组25 μg/mL阿卡波糖溶液,使其终质量浓度为25 μg/mL;实验组每孔加入800 μL底物和200 μL DRB-SDF溶液,使DRB-SDF溶液终质量浓度分别为2、4、8 mg/mL(低、中、高剂量组)。放置于恒温培养箱中培养,于加药后30、60、120 min裂解细胞,离心后取上清液,采用氧化酶-偶联比色法检测葡萄糖的含量。
1.3.5 葡萄糖转运模型的建立
调整Caco-2细胞悬液浓度至1.5h 105个/mL。按照每孔200 μL接种于Transwell 24 孔培养板上室,下室加900 μL培养基。前8 d,每2 d更换一次培养基,之后每天更换培养基,并不定时进行观察。待细胞生长至18~21 d使用细胞电阻仪测量跨膜电阻值,大于300 Ωg cm2即为合格。
评估合格的Caco-2细胞单层模型,吸尽培养基后,用PBS清洗2 遍。上室分别加入含0、2、4、8 mg/mL DRB-SDF和25 μg/mL阿卡波糖的DMEM高糖培养基溶液,下室加入900 μL PBS作为接收液。放入培养箱中培养,并分别于给药30、60、120 min后吸取下室液体适量,采用氧化酶-偶联比色法检测葡萄糖的含量。
1.3.6α-葡萄糖苷酶活力测定
依据1.3.4节所述建立葡萄糖吸收模型,放置于恒温培养箱(37 ℃、5% CO2、相对湿度95%)中培养,孵育120 min后根据α-葡萄糖苷酶活性检测试剂盒说明书提供的方法检测Caco-2细胞α-葡萄糖苷酶活力。
1.3.7 逆转录qPCR分析
调节Caco-2细胞密度为1.5h 105个/mL,接种于6 孔板,置于恒温培养箱(37 ℃、5% CO2、相对湿度95%)中培养。待细胞汇合度达80%左右,吸去旧培养基,PBS清洗2 遍后,分别加入含0、2、4、8 mg/mL DRB-SDF和25 μg/mL阿卡波糖的DMEM高糖培养基。参照TRIzol提取法的详细说明提取总RNA并定量,琼脂糖凝胶电泳对总RNA质量进行检测后,用cDNA逆转录试剂盒逆转录反合成cDNA,随后进行PCR分析,反应体系为20 μL。反应条件为:95 ℃ 30 s;95 ℃ 5 s,59.5 ℃ 30 s,72 ℃ 30 s,循环40 次。表1为引物序列,根据熔解曲线判断引物特异性。以GADPH基因作为内参,用2-ΔΔCt法计算各组基因的相对表达,△△Ct按下式计算。


表 1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.4 数据处理与分析
2 结果与分析
2.1 细胞活力测定结果
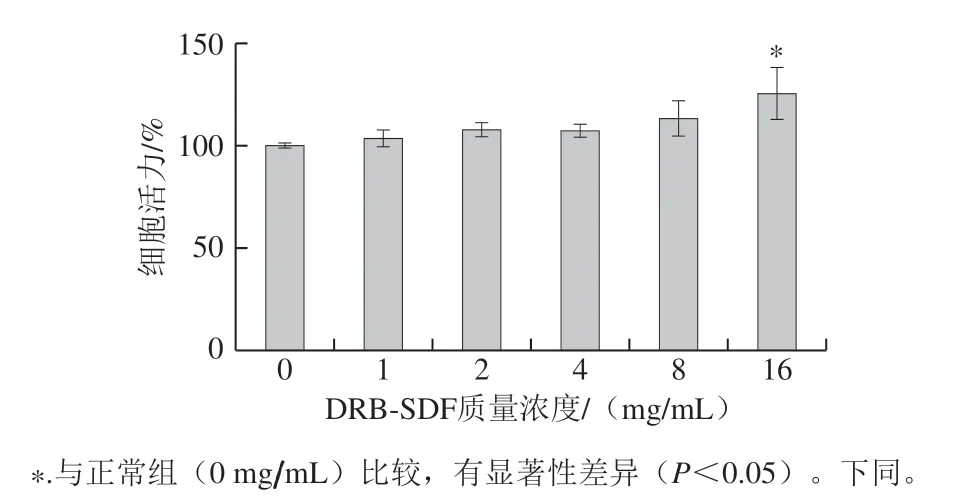
图 1 DRB-SDF对Caco-2细胞活力的影响(n=3)Fig. 1 Effect of DRB-SDF on Caco-2 cell viability (n = 3)
如图1所示,DRB-SDF在质量浓度为1~16 mg/mL 时,对Caco-2细胞并未产生毒性作用。相反,随着DRB-SDF质量浓度的增加,细胞活力略微上升,当质量浓度为16 mg/mL时,相比于正常组细胞活力有显著 上升(P<0.05)。故选用质量浓度为2、4、8 mg/mL的DRB-SDF进行进一步研究。
2.2 DRB-SDF对Caco-2细胞葡萄糖吸收的影响
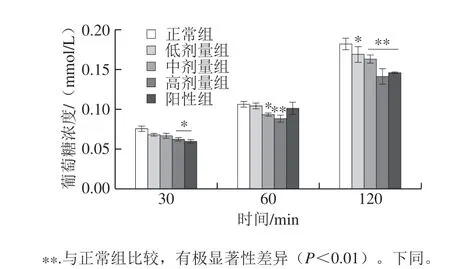
图 2 DRB-SDF对Caco-2细胞葡萄糖吸收的影响(n=3)Fig. 2 Effect of DRB-SDF on glucose uptake in Caco-2 cells (n = 3)
从图2可以看出,Caco-2细胞内葡萄糖浓度随着时间延长而增加,而DRB-SDF能在一定程度上抑制Caco-2细胞对葡萄糖的吸收。在加入DRB-SDF 30、60、120 min后,相比于正常组,Caco-2细胞内葡萄糖浓度均降低且具有浓度依赖性。DRB-SDF作用30 min后,高剂量组(8 mg/mL)与正常组相比葡萄糖吸收有显著下降 (P<0.05);DRB-SDF作用60 min后,低剂量组 (2 mg/mL)葡萄糖吸收量略有降低,中、高(4、 8 mg/mL)剂量组分别显著(P<0.05)和极显著 (P<0.01)下降,并且作用效果比阳性组更明显;DRB-SDF 作用120 min后,与正常组相比,低剂量组Caco-2细胞内部葡萄糖浓度显著降低(P<0.05),当DRB-SDF质量浓度为4 mg/mL和8 mg/mL时有极显著下降(P<0.01)。
2.3 DRB-SDF对Caco-2细胞葡萄糖转运的影响
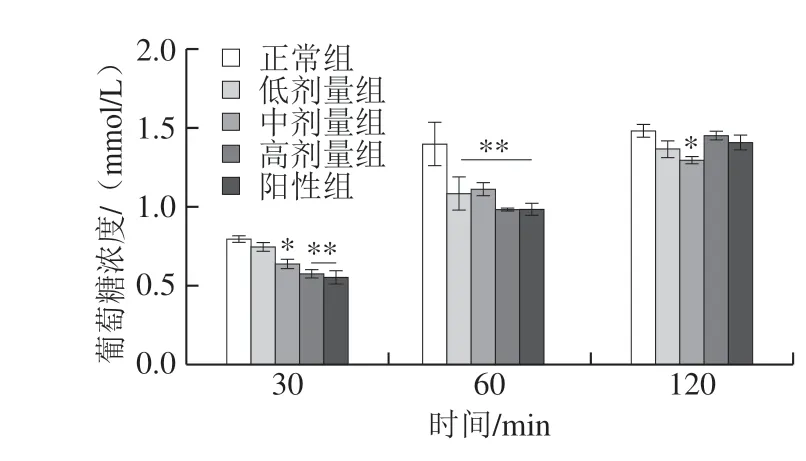
图 3 DRB-SDF对Caco-2细胞葡萄糖跨膜转运的影响(n=3)Fig. 3 Effect of DRB-SDF on glucose transport in Caco-2 cells (n = 3)
从图3可以看出,DRB-SDF对葡萄糖在Caco-2细胞的跨膜转运有一定的抑制作用。DRB-SDF作用30 min后,相比于正常组,实验组的葡萄糖跨膜转运均被抑制,且呈浓度依赖性,中、高剂量组分别有显著性(P<0.05)和极显著(P<0.01)差异;DRB-SDF作用60 min后,与正常组相比,实验组葡萄糖跨膜转运均有极显著下降(P<0.01);DRB-SDF作用120 min后,DRB-SDF对葡萄糖跨膜转运略有抑制,当DRB-SDF质量浓度为 8 m g/m L 时,葡萄糖跨膜转运相比于正常组显著 降低(P<0.05)。
2.4 DRB-SDF对Caco-2细胞α-葡萄糖苷酶活性的影响
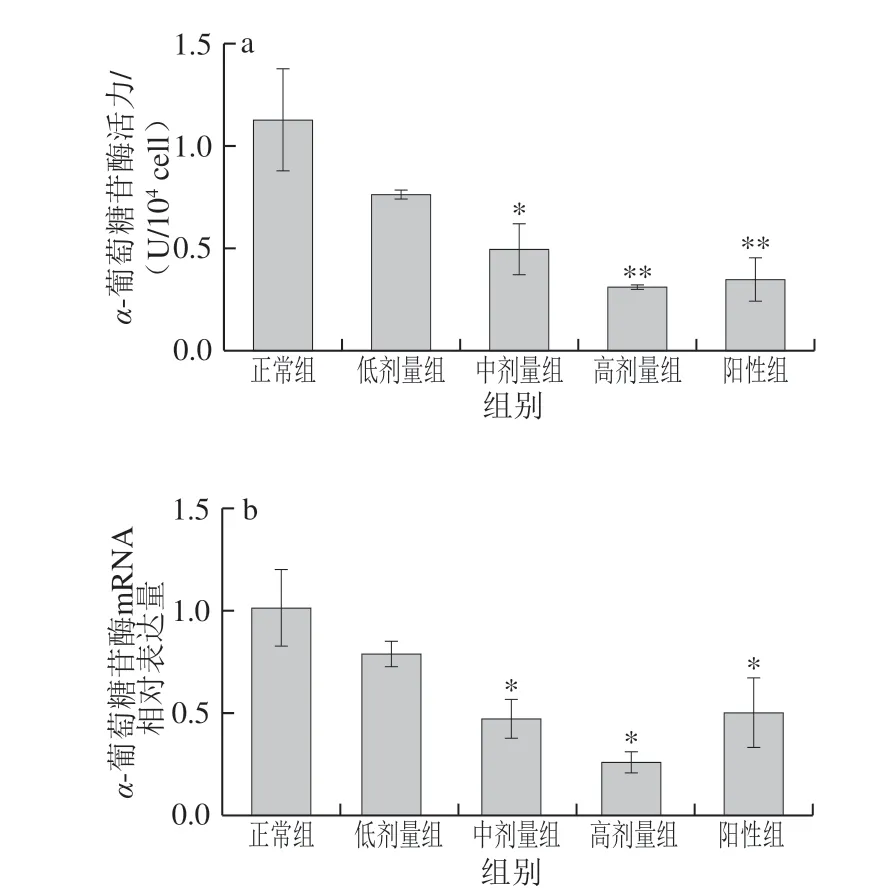
图 4 DRB-SDF对Caco-2细胞α-葡萄糖苷酶活力(a)及其 mRNA表达(b)的影响(n= 3)Fig. 4 Effect of DRB-SDF on α-glucosidase activity (a) and the mRNA expression of α-glucosidase (b) in Caco-2 cells (n = 3)
机体摄入的碳水化合物必须经过人体肠道中的淀粉酶和α-葡萄糖苷酶催化水解成单糖,才能被小肠上皮细胞吸收从而进入血液[17]。因此α-葡萄糖苷酶是通过控制小肠吸收葡萄糖调节餐后血糖的关键。如图4a所示,DRB-SDF可以浓度依赖性地抑制Caco-2细胞内α-葡萄糖苷酶活力,中、高剂量组酶活力相较于正常组分别被显著(P<0.05)和极显著(P<0.01)抑制。Caco-2细胞内α-葡萄糖苷酶mRNA情况如图4b所示,相比于正常组,DRB-SDF可下调Caco-2细胞α-葡萄糖苷酶mRNA的相对表达量,且这种抑制作用呈浓度依赖性,中、高剂量组均有显著性下降(P<0.05)。当DRB-SDF质量浓度为8 mg/mL时,其对于Caco-2细胞内α-葡萄糖苷酶活力及其mRNA相对表达量的抑制作用甚至优于阿卡波糖组。
2.5 DRB-SDF对Caco-2细胞转运酶系SGLT-1、GLUT-2 mRNA表达的影响
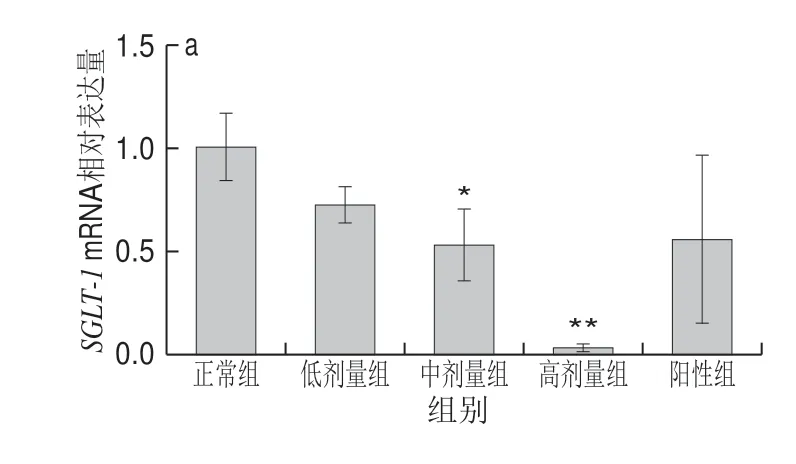
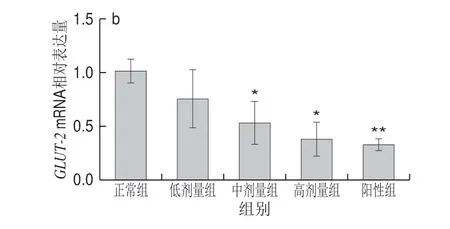
图 5 DRB-SDF对Caco-2细胞对SGLT-1(a)、GLUT-2(b) mRNA的表达影响(n=3)Fig. 5 Effect of DRB-SDF on the mRNA expression of SGLT-1 (a) and GLUT-2 (b) in Caco-2 cells (n = 3)
葡萄糖转运载体是小肠上皮细胞转运葡萄糖的关键蛋白,其中位于刷状缘的SGLT-1和位于基底膜的GLUT-2在葡萄糖跨膜转运中发挥中重要作用。如图5所示,不同质量浓度DRB-SDF作用后,Caco-2细胞内SGLT-1、GLUT-2mRNA相对表达水平被明显下调。随着DRB-SDF 质量浓度的增加,SGLT-1、GLUT-2mRNA相对表达量也逐渐降低。相较于正常组,低剂量组SGLT-1、GLUT-2mRNA相对表达量略有降低,但不显著,中、高剂量组均表现出统计学显著性(P<0.05)或极显著性(P<0.01)差异。
2.6 DRB-SDF对Caco-2细胞Na+-K+-ATP酶mRNA表达的影响
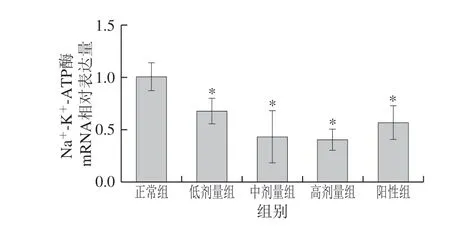
图 6 DRB-SDF对Caco-2细胞对Na-K-ATP酶mRNA表达的影响(n=3)Fig. 6 Effect of DRB-SDF on the mRNA expression of Na+-K+-ATPase in Caco-2 cells (n = 3)
葡萄糖在葡萄糖转运载体蛋白SGLT-1的协助下进入小肠上皮细胞的过程属于主动运输,需要Na+-K+-ATP酶提供能量。由图6可知,DRB-SDF可以显著抑制Caco-2细胞内Na+-K+-ATP酶mRNA相对表达水平(P<0.05),并具有浓度依赖性。当DRB-SDF质量浓度为4、8 mg/mL时,Caco-2细胞内Na+-K+-ATP酶mRNA相对表达量比阿卡波糖组更低。
3 讨 论
流行病学研究显示,膳食纤维的摄入可以有效降低T2DM的发生风险,帮助糖尿病人调控餐后血糖水平[5]。欧洲食品安全局表明,谷物来源的膳食纤维相比其他来源能更有效地控制血糖[18]。本实验通过体外培养Caco-2细胞,分别建立葡萄糖吸收和转运模型,并预设麦芽糖浓度28 mmol/L或葡萄糖浓度为25 mmol/L模拟餐后高血糖浓度。实验结果表明,在一定质量浓度DRB-SDF的干预下,葡萄糖在Caco-2细胞中的吸收及转运均被抑制。在葡萄糖吸收模型中,DRB-SDF质量浓度越高,葡萄糖吸收抑制效果越好,当DRB-SDF质量浓度增至 8 mg/mL时,抑制作用非常显著,且接近甚至优于阿卡波糖。分析抑制作用呈浓度依赖性可能的原因是,DRB-SDF 作为一种多糖,本质上具有与单糖相似的结构,能竞争Caco-2细胞上葡萄糖吸收位点[19],从而延缓葡萄糖吸收。在葡萄糖转运模型中,DRB-SDF作用的前中期,其对葡萄糖跨膜转运的抑制作用非常显著,但当作用时间达到120 min后,高浓度组抑制效果并不显著,其可能原因是作用时间越长,高浓度DRB-SDF导致Caco-2细胞的增殖,参与转运的细胞数量也随之增多。根据以上结果可知,DRB-SDF可以抑制小肠对于葡萄糖的吸收和跨膜转运,并可能进一步控制餐后高血糖水平。
α-葡萄糖苷酶广泛分布于小肠绒毛黏膜细胞的刷状缘中,其中包括麦芽糖酶、乳糖酶、蔗糖酶等多种与肠道糖代谢相关酶类,可以将机体摄入的碳水化合物消化水解形成单糖[20]。其参与机体糖代谢的具体过程为:食物中的碳水化合物经口腔或胃肠道中一系列淀粉酶等消化水解,形成低聚糖,随后α-葡萄糖苷酶作用于非还原末端α-1,4-糖苷键使其断裂,将低聚糖水解成葡萄糖等能被小肠上皮细胞直接吸收的单糖。近年来,很多研究表明,降低肠道中α-葡萄糖苷酶的活性可有效控制小肠上皮细胞对葡萄糖的吸收,从而降低餐后血糖缓解糖尿病。目前,临床上使用最广泛的3 种α-葡萄糖苷酶抑制剂(阿卡波糖、伏格列波糖和米格列醇)均是从微生物代谢产物中提取的,但由于微生物的不稳定性,从天然产物中提取或通过化学合成的方式获得稳定、高效的α-葡萄糖苷酶抑制剂成为一种趋势。聂昌平等[21]发现猕猴桃根石油醚提取物可有效抑制α-葡萄糖苷酶活性,并且在最大考察浓度下效果优于同浓度阿卡波糖。吴慧平等[22]研究表明,夏枯草提取物可以通过抑制α-葡萄糖苷酶活性降低四氧嘧啶糖尿病模型大鼠的餐后血糖水平,并且在长期给药情况下,可能抑制α-葡萄糖苷酶等葡萄糖吸收相关基因的表达。本实验结果证明,DRB-SDF可在一定程度上下调Caco-2细胞α-葡萄糖苷酶mRNA相对表达水平,抑制肠道内α-葡萄糖苷酶活性,延缓碳水化合物在肠道内的降解。
葡萄糖作为极性分子无法自由进出细胞,因此葡萄糖透过肠壁进入血液必须依靠小肠上皮细胞上的葡萄糖转运载体发挥作用。该转运过程由两个家族的跨膜转运载体蛋白:Na+-葡萄糖共转运载体系统(sodium/glucose cotransporters,SGLTs)和葡萄糖协助扩散转运载体系统(facilitative glucose transporters,GLUTs)来完成[23-24]。 其中位于刷状缘SGLT-1在细胞膜Na+-K+-ATP酶的作用下逆浓度梯度偶联Na+主动转运葡萄糖,同时消耗 能量[25];位于基底膜的GLUT-2顺葡萄糖浓度梯度,把肠黏膜细胞内聚集葡萄糖协助转运到组织间隙液,进而葡萄糖进入血液,其转运过程不消耗能量[26]。所以,碳水化合物经肠道消化水解后,单糖吸收和转运过程与SGLT-1、 GLUT-2和Na+-K+-ATP酶3 种蛋白密切相关。本研究利用不同质量浓度DRB-SDF干预Caco-2细胞,运用逆转录qPCR分别检测SGLT-1、GLUT-2和Na+-K+-ATP酶mRNA的表达。实验结果表明,DRB-SDF可明显降低SGLT-1、GLUT-2和Na+-K+-ATP酶mRNA表达水平,并具有浓度依赖性,这一结果与DRB-SDF对小肠中葡萄糖吸收和转运抑制作用一致。由此可知,DRB-SDF可能通过下调小肠上皮细胞转运载体蛋白的表达,延缓葡萄糖从小肠进入血液的过程,从而降低餐后高血糖水平。同时Syafril[27]、Álvarez-Cilleros[28]及Ong[29]等研究发现,葡萄糖协助扩散转运酶与PI3K信号通路有关,而该通路与胰岛素分泌相关,所以DRB-SDF是否能通过PI3K信号通路调控胰岛素分泌降低餐后血糖水平有待进一步研究。
阿卡波糖属α-葡萄糖苷酶抑制剂,但近年来也有少数文献报道过其对SGLT-1、GLUT-2和Na+-K+-ATP酶基因的影响。吴慧平等[22]研究指出,阿卡波糖对于SGLT-1、 GLUT-2和Na+-K+-ATP酶mRNA表达有明显的抑制效果。同时马丽娜等[30]发现阿卡波糖对2型糖尿病大鼠肠道SGLT1受体的表达有一定的影响。本实验中阿卡波糖对于SGLT-1、GLUT-2和Na+-K+-ATP酶mRNA表达的抑制作用也为阿卡波糖降糖作用的研究提供了新的思路,但有待于进一步的实验验证。
综上所述,绿色木霉发酵法制备的脱脂米糠可溶性膳食纤维可能通过抑制α-葡萄糖苷酶的活性,延缓碳水化合物降解成葡萄糖;同时DRB-SDF可抑制小肠上皮细胞葡萄糖转运蛋白SGLT-1、GLUT-2和Na+-K+-ATP酶的活性、占据葡萄糖的吸收位点,延缓肠道葡萄糖的吸收和跨膜转运,最终达到降低餐后血糖水平的目的。本实验结果可为进一步研究膳食纤维降血糖机制及降糖功能食品的开发提供理论依据。
