紫花芸豆肽修复H2O2对HepG2细胞的氧化应激损伤
2020-02-08程天赋郭增旺曹冬梅
马 萍,程天赋,郭增旺,周 义,王 欣,曹冬梅
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
芸豆学名菜豆,是豆科菜豆属的小宗杂粮作物[1],是栽培面积仅次于大豆的食用豆类作物之一[2]。紫花芸豆是黑龙江省种植量最大的一个品种,其富含蛋白质、多糖、花色苷、维生素等多种营养成分,还含有皂苷、尿毒酶等独特成分,具有提高人体自身免疫能力、激活淋巴T细胞、抑制肿瘤细胞发展、促进脱氧核苷酸合成等功能,是开发高档食品及功能性食品的优质原料[3-5]。
当机体受到外源性或内源性氧化物质损伤时,体内自由基产生和清除的动态平衡就会遭到破坏,从而引起ROS在体内堆积并产生细胞毒性作用[6]。自由基水平过高时会氧化细胞膜、代谢酶系、蛋白质和DNA等物质,还会诱导细胞凋亡,对机体的细胞及器官造成损伤[7-9]。 研究表明,自由基与衰老、炎症、癌症、心血管疾病等都有密切的关系[10-12],因此,开发具有清除自由基的功能性食品和药物日益受到重视。抗氧化肽是指具有抗氧化功能的生物活性肽,由于具有分子质量小、生物活性高、抗原性低、易吸收等特点而被广泛研究[13-14]。大量研究表明,食源性蛋白酶解物如大米蛋白肽、小麦蛋白肽、大豆蛋白肽等具有抗氧化活性,能够清除自由基[15-21],但是对生物活性肽是如何通过调控凋亡蛋白通路进行协作发挥抗氧化活性的研究还较少。本课题组前期制备了紫花芸豆抗氧化肽,并通过体外实验评价了其抗氧化活性,发现双酶水解得到的紫花芸豆肽(Phaseolus vulgarispeptides,PVPs)具有体外抗氧化活性[21]。为了系统准确地评价PVPs的抗氧化活性及其作用机制,本实验采用H2O2诱导HepG2细胞构建细胞氧化应激损伤模型,采用水溶性四唑盐法(WST-1法)检测细胞增殖率,流式细胞仪检测胞内活性氧(reactive oxygen species,ROS)水平,酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测胞内抗氧化物酶系活性,Western blot法检测PVPs对细胞凋亡通路的影响,以此评价PVPs的抗氧化活性并探索其作用机理,从而为PVPs的功能性食品开发和抗氧化活性肽的作用机制研究提供理论依据。
1 材料与方法
1.1 材料与试剂
紫花芸豆产地黑龙江省齐齐哈尔市依安县,蛋白质量分数19.17%,由国家杂粮工程技术研究中心提供;紫花芸豆蛋白由本实验室通过碱提酸沉法[22]制得, 纯度92.2%。
人肝癌细胞HepG2 哈尔滨医科大学;DMEM高糖液体培养基、青霉素/链霉素 美国Hyclone公司;胎牛血清 浙江天杭生物科技有限公司;胰蛋白酶消化液 美国Gibco公司;1×磷酸盐缓冲液(phosphate buffered saline,PBS)、BCA蛋白质浓度测定试剂盒(增强型)、RIPA细胞裂解液、丙二醛(malonicdialdehyde,MDA)测定试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)活力检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、凝胶试剂盒 碧云天生物技术研究所;兔抗p53单克隆抗体、兔抗Caspase-3单克隆抗体、鼠抗Caspase-3单克隆抗体、辣根过氧化物酶标记的抗兔二抗、辣根过氧化物酶标记的抗鼠二抗 美国CST公司。
1.2 仪器与设备
CO2细胞培养箱、高速冷冻离心机 美国Thermo Fisher公司;多功能酶标仪 上海三科仪器有限公司;FACS Calibur流式细胞仪 美国BD公司;EVOS荧光显微镜 美国Life Technologies公司;半干转膜仪、电泳槽、ChemiDoc XRS+化学发光成像系统 美国Bio-Rad公司;TS-2000A多用脱色摇床 海门其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 PVPs的制备
PVPs参照课题组前期的研究方法[21]制备。工艺路线为:紫花芸豆蛋白→加水(底物质量分数为7%)→热处理(95 ℃、10 min)→冷却→调至pH 10、50 ℃→加质量分数7%胰蛋白酶→恒温恒pH值水解4.5 h→灭酶(95 ℃、10 min)→冷却→调至pH 9、60 ℃→加质量分数7%碱性蛋白酶→恒温恒pH值水解3 h→灭酶(95 ℃、10 min)→透析脱盐12 h→冷冻干燥→PVPs
所得PVPs的纯度为93.2%,分子质量分布集中在6 kDa以下。
1.3.2 细胞培养与分组
将HepG2细胞置于含有质量分数10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM(高糖)培养基中,于37 ℃、5% CO2的饱和湿度培养箱中培养,待细胞数量达到80%~90%后吸去培养液,用PBS冲洗 一次,加入1 mL胰蛋白酶消化3 min,进行传代培养。将处于对数生长期的细胞接种于培养板中培育4 h后更换培养基,除去未贴壁细胞并对其进行分组[23]。正常对照组:不加PVPs和H2O2干预处理,只加入与实验组PVPs和H2O2相同体积的PBS;氧化应激模型组:不加PVPs干预,加入与实验组PVPs相同体积的PBS溶液培养24 h后,加入终浓度为2 mmol/L H2O2溶液刺激1 h;实验组:PVPs低剂量组(PVPs-L)、PVPs中剂量组(PVPs-M)、PVPs高剂量组(PVPs-H),采用终质量浓度分别为50、100、200 µg/mL PVPs干预24 h后,加入终浓度为 2 mmol/L H2O2溶液刺激1 h。
1.3.3 PVPs对H2O2诱导HepG2细胞增殖率的影响
参照臧琳等[24]的方法并略加改动。采用WST-1法检测细胞增殖率。选取对数生长期的HepG2细胞接种于96 孔板内,每孔体积100 μL,接种密度为2.0h 103个/mL, 置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞,弃培养液,每孔加入10 μL的WST-1溶液,混匀,于细胞培养箱内孵育2 h,振荡充分混匀后,用酶标仪以450 nm为检测波长、630 nm为参考波长测定吸光度,按下式计算各组细胞存活率。

1.3.4 PVPs对H2O2诱导HepG2细胞胞内ROS水平的影响
参考Wang Wei等[25]的方法并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0h 105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,每孔加入终浓度10 μmol/L的DCFH-DA荧光探针,37 ℃避光反应20 min后吸去探针,用预冷的PBS洗涤细胞2 次,随后采用胰蛋白酶消化液消化细胞,离心除去上清液,PBS重悬细胞,并采用流式细胞仪测定活细胞的ROS含量。
1.3.5 PVPs对H2O2诱导HepG2细胞MDA水平的影响
参考刘艳等[26]的方法,并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0h 105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,每孔加入100 μL细胞裂解液使细胞裂解,于4 ℃、1 600hg下离心10 min,取上清液作为样本,参照MDA测定试剂盒和BCA蛋白浓度测定试剂盒说明书对细胞内的MDA和蛋白质进行定量测定。
1.3.6 PVPs对H2O2诱导HepG2细胞胞内抗氧化物酶系活力的影响
参照臧琳等[24]的方法并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0h 105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,用预冷PBS洗涤1 次,弃去PBS,刮下细胞转移到1.5 mL离心管中,离心弃上清液,加入细胞裂解液,4 ℃,12 000hg离心10 min。取上清液按照试剂盒说明书检测SOD、GSH-Px及过氧化氢酶(catalase,CAT)活力,余下部分采用BCA法进行蛋白浓度测定。
1.3.7 PVPs对H2O2诱导HepG2细胞的胞内凋亡蛋白表达量的影响
参照Han等的方法[27]并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0h 105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,加入100 μL RIPA细胞裂解液提取细胞总蛋白,BCA法进行蛋白浓度测定,配制质量分数10%分离胶和5%浓缩胶,上样,恒压50、80、120 V电泳各30 min,半干法转膜,5%脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育1 h,暗室中加发光染料底物混合物1 mL于膜上显色1 min,曝光显影,结果采用Image Lab软件进行定量分析。
1.4 数据统计与分析
实验数据采用平均值±标准差表示。实验数据使用SPSS 19.0软件进行统计分析,用方差分析法进行显著性检验,组间比较采用Tukey法进行。
2 结果与分析
2.1 PVPs对H2O2诱导HepG2细胞存活率的影响
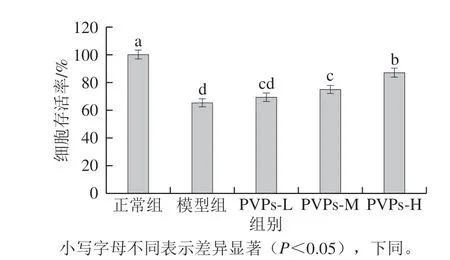
图 1 PVPs对H2O2诱导HepG2细胞氧化损伤的抑制作用Fig. 1 Effect of PVPs on viability of HepG2 cells induced by H2O2
由图1 可知,H2O2诱导的模型组细胞存活率仅为(6 5.2 4 f 3.0 1)%,与正常组相比显著下降 (P<0.05),这表明H2O2诱导HepG2细胞构建的氧化应激模型成功;与模型组相比,PVPs中、高剂量组可以显著提高H2O2构建氧化应激模型的细胞存活率(P<0.05),显著缓解H2O2引起HepG2细胞的增殖抑制,且呈现剂量-效应关系。H2O2是构建氧化应激细胞模型的重要刺激原之一,能直接氧化细胞膜上的蛋白质和脂类物质,还能自由穿透细胞膜,与胞内铁离子结合反应生成羟自由基等自由基,进而诱导细胞凋亡并造成组织损伤[28]。模型组中的H2O2对HepG2细胞的增殖产生了显著的抑制作用,但中、高剂量的PVPs培养HepG2细胞后显著降低了H2O2对细胞存活率的抑制作用。这表明PVPs能在一定程度上对HepG2细胞起到保护作用,能缓解H2O2对HepG2细胞的氧化应激损伤。
2.2 PVPs对H2O2诱导HepG2细胞胞内ROS含量的影响
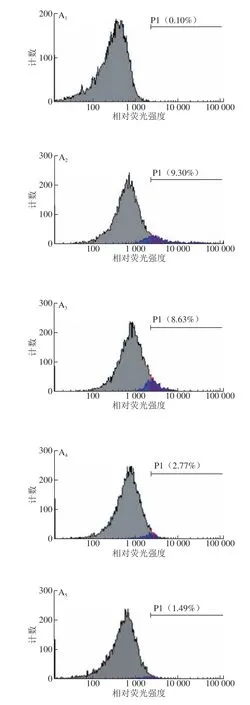
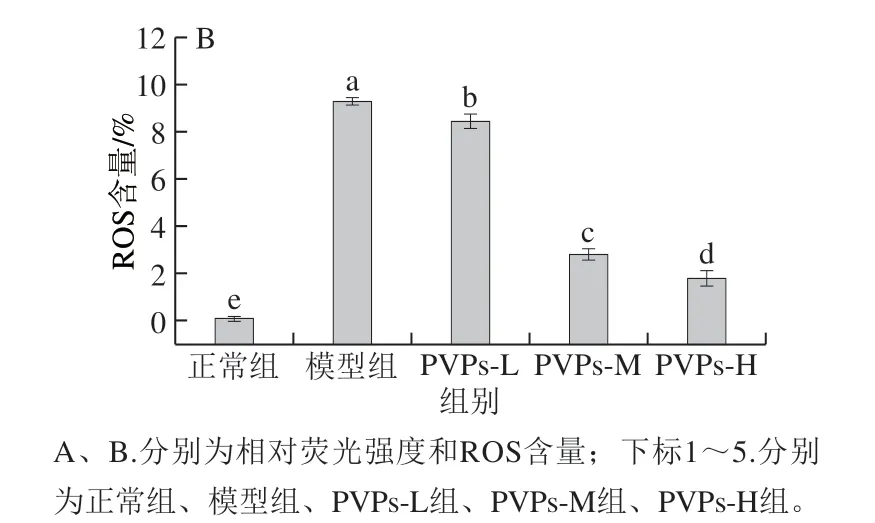
图 2 PVPs对H2O2诱导HepG2细胞胞内ROS含量的影响Fig. 2 Effect of PVPs on ROS level in H2O2-induced HepG2 cells
当机体受到外界刺激时,巨噬细胞中的线粒体能通过呼吸爆发机制产生少量的ROS,促进其发挥吞噬和酶解的生理功能[29-30]。但在病理条件下,机体内的ROS升高到一定水平且氧化应激机制不足以调控其回归到正常水平时,将对细胞的核酸、蛋白质、生物膜造成氧化损伤,从而诱导细胞发生损伤和凋亡[31]。在HepG2细胞处理后装载ROS探针DCFH-DA,并使用流式细胞仪对胞内ROS水平进行检测,ROS可以氧化胞内无荧光的DCFH转变成荧光DCF。因此,通常以正常细胞作为内参,以发生荧光信号强度改变的细胞数占总细胞数的比值表征细胞内的ROS水平,偏移量越大代表荧光强度越高,比例越高代表ROS水平越高。由图2可知,与正常组相比,模型组的ROS含量显著升高(P<0.05);低、中、高剂量的PVPs显著降低了胞内ROS含量(P<0.05),且呈现剂量-效应关系。这表明PVPs可以减轻H2O2诱导HepG2细胞胞内ROS含量的升高,从而发挥其抗氧化应激的功能,减轻ROS对细胞和机体引发的氧化损伤。
2.3 PVPs对H2O2诱导HepG2细胞MDA水平的影响
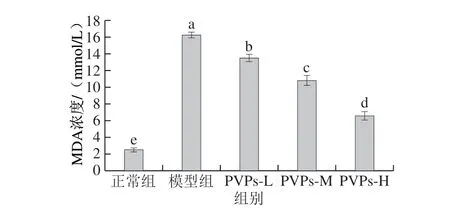
图 3 PVPs对H2O2诱导HepG2细胞MDA浓度的影响Fig. 3 Effect of PVPs on MDA concentration in HepG2 cells induced by H2O2
MDA是生物体内的脂质物质受到自由基氧化而生成的最终氧化产物。ROS极易氧化细胞膜中的不饱和脂肪酸,形成脂质自由基,从而引发脂质过氧化作用导致细胞膜发生损伤,引起MDA水平升高,因此MDA水平直接反映了细胞膜受到自由基氧化损伤的严重程度[32]。由图3可知,H2O2诱导的模型组MDA水平与正常组相比显著上升(P<0.05);与模型组相比,低、中、高剂量的PVPs均显著抑制H2O2引起的氧化应激模型细胞MDA浓度的上升(P<0.05),且呈现剂量-效应关系。模型组MDA水平显著升高表明其细胞受到ROS刺激后,细胞膜发生严重损伤;而PVPs能显著降低细胞的MDA水平,表明PVPs能对抗ROS引发的脂质氧化作用,具有减轻自由基对机体氧化应激损伤的活性。
2.4 PVPs对H2O2诱导HepG2细胞抗氧化物酶系活力的影响
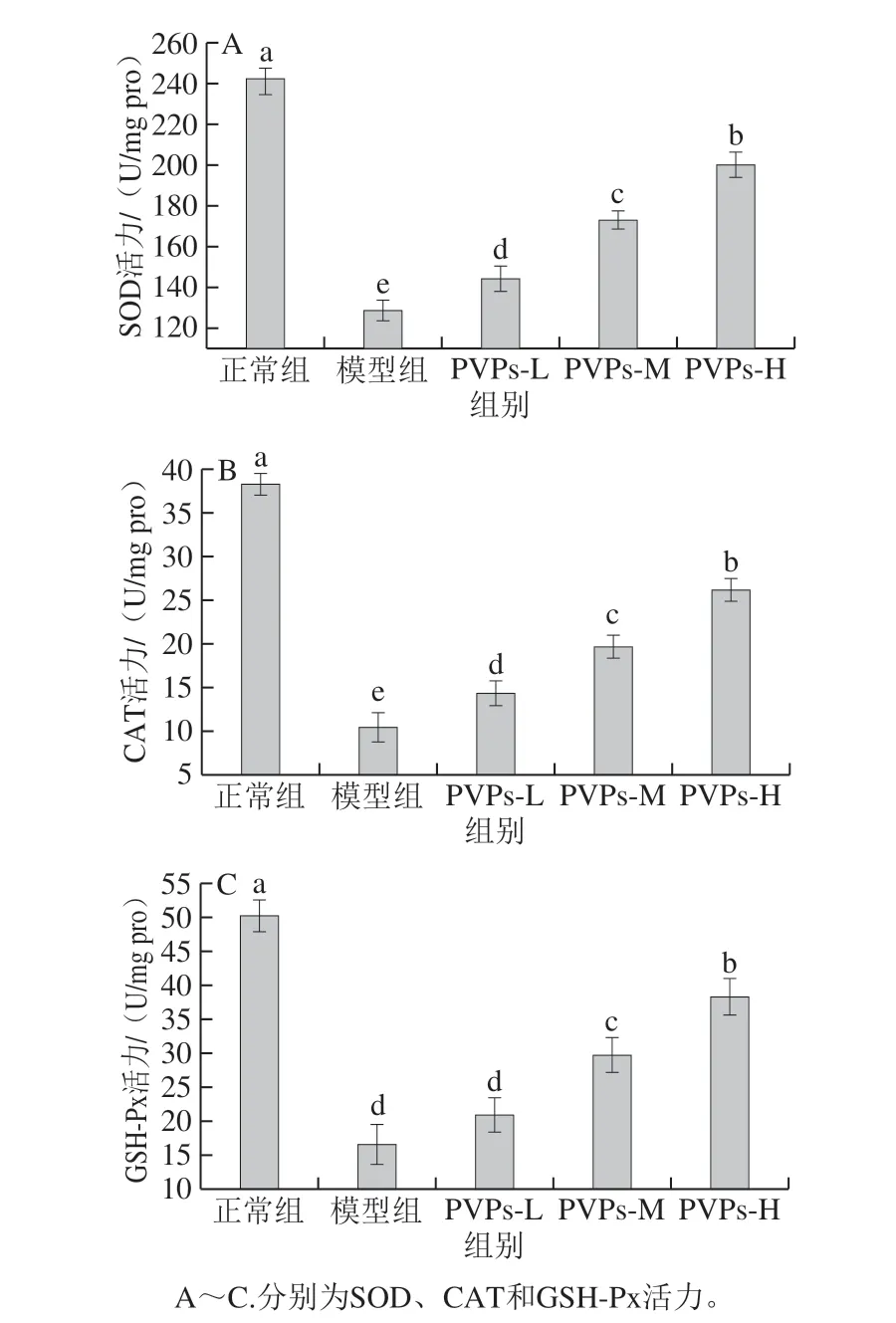
图 4 PVPs对H2O2诱导HepG2细胞抗氧化物酶系活力的影响Fig. 4 Effect of PVPs on antioxidant enzyme activity in HepG2 cells induced by H2O2
SOD、CAT和GSH-Px均为细胞抗氧化物酶系中的重要组成部分,在机体发挥抗氧化和维护氧化应激动态平衡中发挥着重要的作用[33-34]。SOD能催化过氧阴离子发生歧化反应从而发挥清除自由基的作用;CAT约占CAT体系总量的40%,能催化H2O2生成水和氧气,是CAT体系的标志性酶;GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,其组成部分中的硒能催化GSH与过氧化物反应,生成无毒的羟基化合物和氧化型谷胱甘肽,促使对机体和细胞有毒有害的过氧化物还原成无毒的羟基化合物,从而保护细胞和机体免受过氧化物的损伤;机体内的抗氧化物酶系活力直接反映了细胞在氧化应激环境下的动态平衡调节能力[35-37]。由图4可知,H2O2诱导HepG2细胞建立的氧化应激细胞模型的抗氧化物酶系活力与正常组相比均显著降低(P<0.05);与模型组相比,PVPs低、中、高剂量组的SOD、CAT、GSH-Px活力均显著升高(P<0.05),且呈现剂量-效应关系。这表明此浓度的H2O2破坏了细胞的氧化调节动态平衡,细胞自身的抗氧化代谢调控能力不足以应付外界刺激,细胞受到严重的氧化应激损伤[33];而在PVPs培养24 h后细胞的抗氧化物酶系活力均显著提高,表明PVPs能减轻H2O2对细胞抗氧化物酶系的破坏作用,减轻氧化应激损伤并提高对外界氧化应激的调控能力,这也和之前PVPs能减轻H2O2对细胞膜损伤的结果相一致。
2.5 PVPs对H2O2诱导HepG2细胞凋亡信号通路的影响
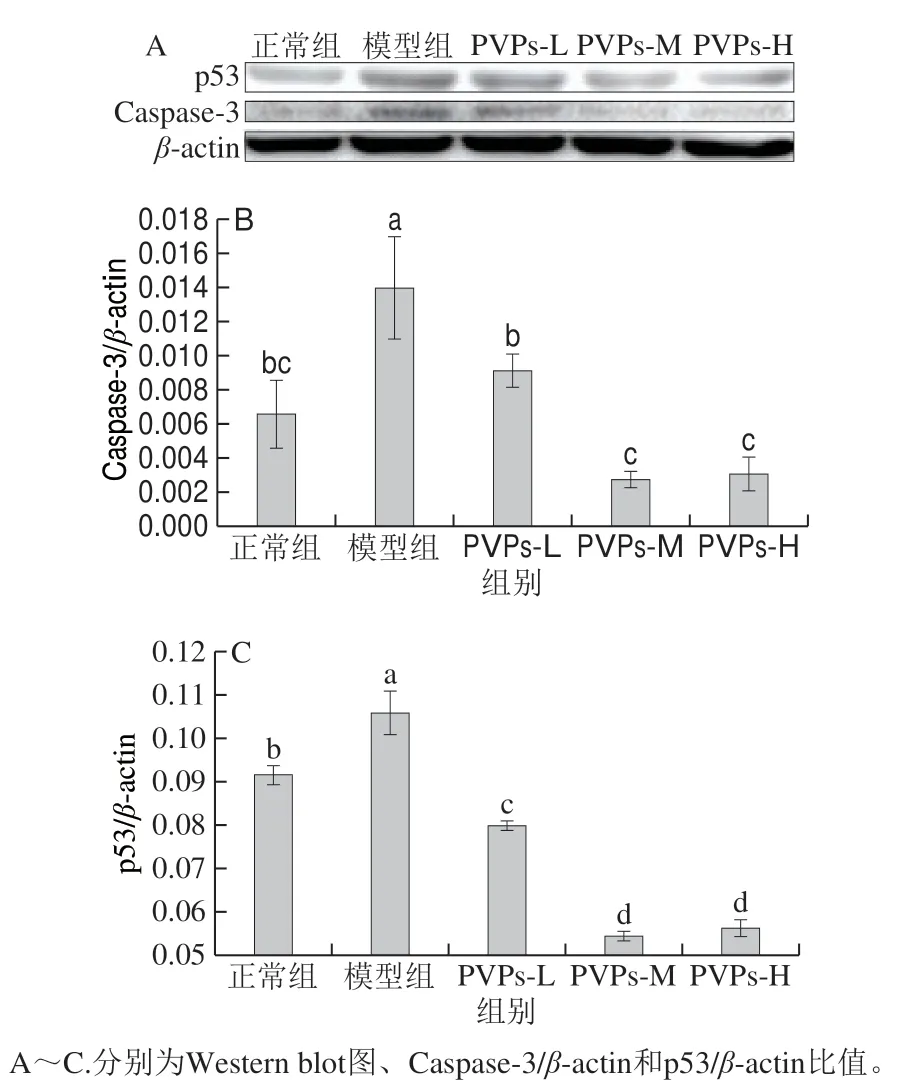
图 5 PVPs对H2O2诱导HepG2细胞Caspase-3、p53蛋白表达量的影响Fig. 5 Effect of PVPs on the protein expression of caspase-3 and p53 in H2O2-induced HepG2 cells
p53蛋白又称凋亡蛋白,负责维持细胞基因组的完成性、DNA损伤的修复和细胞周期的运行,主要介导DNA损伤后的细胞应激反应[38]。正常细胞内的p53蛋白含量较低,当由于外界环境造成核内DNA损伤时胞内p53表达量上升,调控细胞分裂周期停止于G1期,自我修复发生损伤的基因,若修复失败则与其他凋亡基因协同诱导细胞发生凋亡[39-40]。Caspases通路在所有细胞发生凋亡时都会被激活,而Caspase-3是细胞发生凋亡的最终执行者。正常细胞内的Caspase-3蛋白处于非激活状态,当细胞发生凋亡时,Caspase-3蛋白被激活转化裂解产生能诱导细胞凋亡的活性片段,后者能进入核内激活核酸内切酶,从而使DNA发生裂解,进而诱导细胞凋亡[41-42]。由图5可知,与正常组相比,模型组胞内Caspase-3和p53表达量显著升高(P<0.05);与模型组相比,PVPs低、中、高剂量组的Caspase-3和p53蛋白表达量均显著下降(P<0.05)。本实验结果表明此浓度的H2O2诱导了HepG2细胞凋亡蛋白的表达,而PVPs能抑制胞内凋亡蛋白的表达,并且与浓度呈现正相关,这和PVPs能显著缓解H2O2引起HepG2细胞增殖抑制的作用结果相一致。
3 讨 论
机体生长代谢过程中产生的自由基具有多种生理功能,如预防感染、激活细胞、信号传导等。但是过多的自由基能导致机体正常的细胞组织发生病变并引起氧化应激反应,造成蛋白质损伤、DNA突变、细胞膜磷脂层氧化及低密度脂蛋白变性等损伤[43-44],并促进癌症、动脉粥样硬化和糖尿病等疾病的病理学发展[45-47]。自由基衰老学说提出,机体的衰老是自由基在细胞内逐渐积累并引起过度氧化损伤而导致的。大量研究表明,通过膳食补充抗氧化成分能够增强机体的防御能力,帮助维持机体的氧化动态平衡。蛋白质是食物的重要组成部分,其水解产物具有特殊的生理功能,如大豆蛋白、鸡蛋蛋白、花生蛋白、绿豆蛋白等均具有极强的抗氧化能力。PVPs是采用双酶水解技术从紫花芸豆蛋白中提取得到的水溶性活性多肽,前期研究结果表明,PVPs具有体外抗氧化活性,但是体内抗氧化活性及其作用机制还尚未可知[21,48]。本实验为了深入研究开发紫花芸豆抗氧化生物活性肽,进一步探讨了PVPs对HepG2细胞氧化应激损伤中的细胞存活率和抗氧化调节系统的影响。H2O2是一种重要的ROS,性质相对稳定,常作为体外氧化应激损伤的造模药物。因此,本实验以HepG2细胞作为研究对象、H2O2为造模药物诱导建立氧化应激损伤模型,通过细胞存活率、ROS水平、抗氧化物酶系活力及凋亡蛋白表达进行探讨,分析PVPs的抗氧化活性及其作用机制。
细胞存活率是表征细胞状态的基础指标,直接反映外界刺激对细胞的损伤程度。高浓度ROS能直接损伤HepG2细胞,诱导细胞发生凋亡[39]。由细胞存活率和免疫印迹实验可知,H2O2诱导能对细胞造成损伤并使其存活率显著下降,并且能促进细胞内凋亡蛋白p53和Caspase-3表达量的显著升高。p53蛋白的生理学作用是当DNA发生损伤时,其表达量升高,调控细胞进行自我基因修复,当损伤不可逆时则协同其他凋亡蛋白诱导细胞发生凋亡,而Caspase-3蛋白是细胞凋亡的最终执行者[48-49]。 这表明H2O2能显著降低细胞存活率,引起胞内DNA的损伤,从而造成p53表达量的升高,并与Caspase-3蛋白发生协同作用,进而诱导细胞凋亡。而PVPs处理HepG2细胞显著降低了H2O2对其存活率的抑制作用,并且显著降低了胞内p53和Caspase-3蛋白的表达量。这表明PVPs能在一定程度上对HepG2细胞起到保护作用,能通过抑制其凋亡基因的表达和减轻ROS对胞内DNA的损伤,从而缓解H2O2对HepG2细胞的氧化应激损伤。
机体存在天然的抗氧化系统,一定程度内的氧化应激刺激能被自身机体的抗氧化调节系统所补偿,因而不会引起机体的损伤,但当外界氧化应激源的刺激较为强烈并超出自身调节范围时,细胞和组织就会受到氧化应激损伤[33]。MDA是细胞膜上不饱和脂肪酸被氧化时所生成的重要代谢产物,可作为脂质过氧化程度的测定标准,其水平的高低可间接反映出细胞受自由基损伤的程度。由图3可知,该浓度下的H2O2显著提高了细胞的MDA水平,表明HepG2细胞受到了氧化应激损伤。而PVPs处理HepG2细胞显著降低了H2O2所引起的MDA浓度升高,表明PVPs能够帮助细胞抵御自由基对其的脂质氧化作用。机体内存在两类抗氧化系统能够调控氧化应激反应,即酶抗氧化系统和非酶抗氧化系统[25]。内源性抗氧化物酶SOD、CAT是防止氧化应激产生的第一道防线。由图4可知,H2O2对HepG2细胞内的抗氧化物酶系具有灭活的作用,当HepG2细胞受到ROS刺激时会造成整个抗氧化防御系统遭到重创,细胞内的抗氧化物酶系SOD、CAT和GSH-Px活力显著降低,并且MDA水平显著升高,导致细胞发生不可逆的损伤。而PVPs预培养能显著上调抗氧化酶活力并降低MDA水平,恢复H2O2引起的氧化应激损伤,保护细胞内源性抗氧化防御系统,这也可能是PVPs发挥抗氧化活性的作用机制。
H2O2能对HepG2细胞造成严重的氧化应激损伤。当HepG2细胞遭受ROS刺激后,细胞膜脂质发生氧化反应并生成代谢产物MDA,膜通透性增强,并且对胞内遗传物质造成破坏,引起p53和Caspase-3凋亡蛋白的表达量升高,进而导致细胞损伤并诱导其凋亡;为了抵抗外界ROS的刺激和恢复胞内氧化还原平衡,内源性的抗氧化物酶系(SOD、CAT和GSH-Px)被大量消耗,最终导致氧化防御系统紊乱。因此,当HepG2细胞受到H2O2刺激后,细胞存活率显著下降、凋亡通路被激活、MDA和抗氧化物酶系水平显著改变。而本研究结果显示,PVPs能显著提高HepG2细胞的存活率,降低MDA和胞内ROS水平,提高抗氧化物酶活力,降低凋亡蛋白的表达。这表明PVPs能通过降低胞内ROS水平、提高过氧化酶系和抑制凋亡通路的激活缓解氧化应激损伤。
4 结 论
本实验研究了PVPs对H2O2所诱导的氧化应激损伤模型的细胞存活率、ROS水平、MDA水平、抗氧化物酶系活力和p53、Caspase-3蛋白表达量的影响。结果表明:PVPs能缓解H2O2所引起的HepG2细胞存活率降低,并降低胞内ROS、MDA水平,提高抗氧化物酶系中SOD、CAT、GSH-Px活力,并且下调p53、Caspase-3的蛋白表达量。PVPs对H2O2引起的HepG2细胞氧化损伤具有一定的保护作用,能通过提高细胞存活率、降低胞内的ROS水平、减轻细胞膜脂质的氧化程度、抑制凋亡蛋白的表达和提高胞内抗氧化物酶系的活力,提高机体的抗氧化能力,从而增强对外界氧化应激的调控。
