肝脏原发高级别神经内分泌癌1例报告
2020-02-08刘宇维崔国振刘相良牛俊奇赵恒军
刘宇维,崔国振,刘相良,牛俊奇,赵恒军
吉林大学第一医院 a. 肝胆胰内科; b. 肿瘤中心肿瘤科,长春 130021
1 病例资料
患者男性,61岁,因“腹痛、乏力7 d”于2019年4月30日入本院,无恶心、呕吐,既往体健。入院查体:皮肤巩膜轻度黄染,右上腹部压痛明显,无其他阳性体征。入院血生化检查:TBil 31.8 μmol/L,DBil 9.3 μmol/L,IBil 22.5 μmol/L,ALT 135.9 U/L,AST 163.3 U/L,GGT 115.1 U/L,余未见异常。肿瘤标志物:AFP 3.12 ng/ml,细胞角蛋白19片段 20.47 ng/ml, 神经元特异性烯醇化酶(neuron-specific enolase,NSE) 176.25 ng/ml。实验室指标:各项肝炎指标正常。腹部平扫+增强CT:肝内多发占位性病变,考虑恶性,肝门区/腹主动脉周围多发淋巴结肿大,考虑转移可能。为明确诊断行经皮肝穿刺活组织检查术,病理结果提示:高级别神经内分泌癌(neuroendocrine carcinoma,NEC),免疫组化结果提示:CD56(+),CK7(灶状+),Ki-67(+70%), CK-pan(灶状+),Syn(灶状+)(图1)。结合影像学检查未发现其他组织来源NEC的证据,故诊断为原发性肝脏NEC伴肝内多发转移及肝外淋巴结转移。本病例因存在多发病灶无法手术切除,选择依托泊苷和顺铂方案(EP方案)行全身化疗,现已完成4疗程。复查肿瘤标志物:AFP 4.49 ng/ml,细胞角蛋白19片段 2.89 ng/ml,NSE 7.66 ng/ml,恢复至正常。腹部平扫+增强CT:肝内多发占位性病变与前相比明显变少变小,肝门区、门腔间隙见多发淋巴结显示,部分肿大,较前片体积略减小(图2、3)。
2 讨论
肝脏神经内分泌肿瘤(neuroendocrine neoplasm,NEN)绝大部分为胃肠道、胰腺、肺等原发部位转移所致,原发性肝脏神经内分泌肿瘤(primary hepatic neuroendocrine neoplasm, PHNEN)较为少见(占所有病例的0.3%)[1-3]。自1958 年 Edmondson 报道第1例肝脏NEN以来[4],国外报道[5]仅150例,国内报告更少,1994年-2010年仅47例[6],以个案报道及回顾性研究为主。绝大多数患者为PHNEN 2级。多数患者选择手术治疗,较少进行长期随访[7]。目前关于PTNEN的发病机制尚不清楚,有研究[8-9]认为与胆管内含神经内分泌细胞有关,并且认为胆道系统中的慢性炎症可以诱导肠上皮化生导致NEN的发展[10-11]。另有学者[12-13]认为位于肝脏的异位胰腺或肾上腺组织的分化导致NEN的发生。PHNEN缺乏典型临床表现,腹痛为最常见的临床症状。2011年Benjamin[3]对124例 PHNEN患者分析,结果表明73.3%的患者是有症状的,65%的患者主诉为腹痛。类癌综合征是NEN的特异性临床表现,包括皮肤发红、呼吸急促、腹泻。然而PHNEN很少引起类癌综合征,可能由于神经内分泌激素量不足或质量缺陷,不能激活靶器官发挥生物学作用[7,13]。

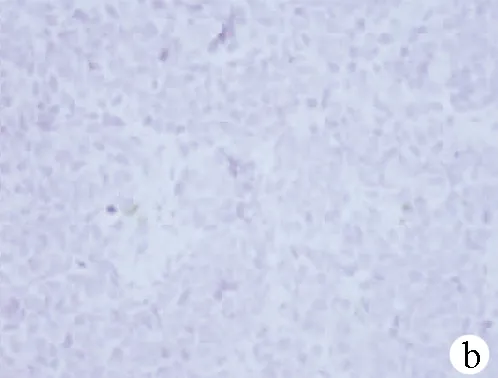
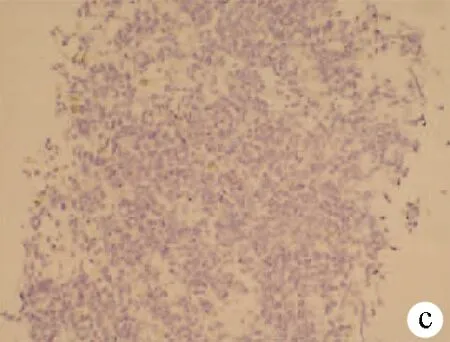
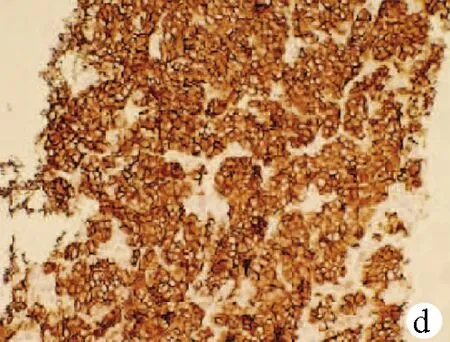
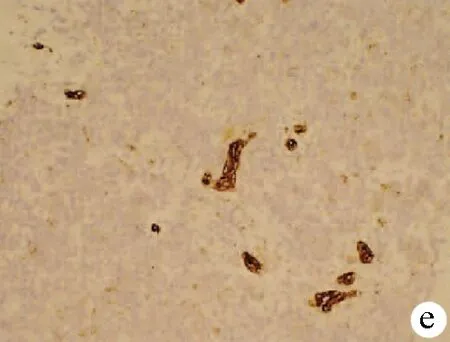
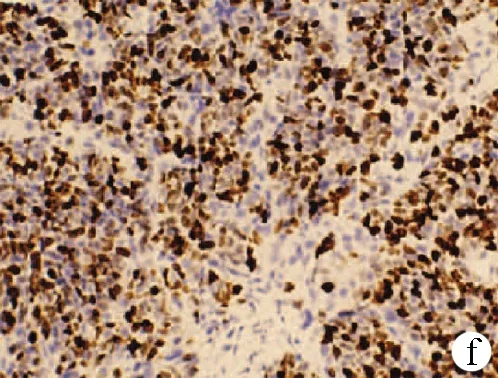
注:a,HE染色,×40;b,嗜铬素(CgA)阴性(免疫组化,×40);c,NSE阴性(免疫组化,×40);d,CD56为阳性(免疫组化,×40);e,CK7(灶状+)(免疫组化,×40);f,Ki-67(+70%)(免疫组化,×40)。
图1患者病理结果及免疫组化染色结果
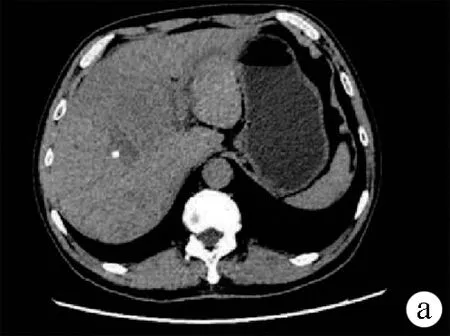
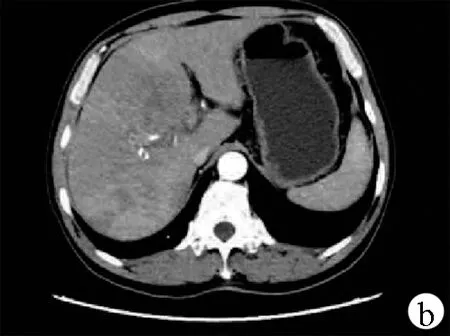
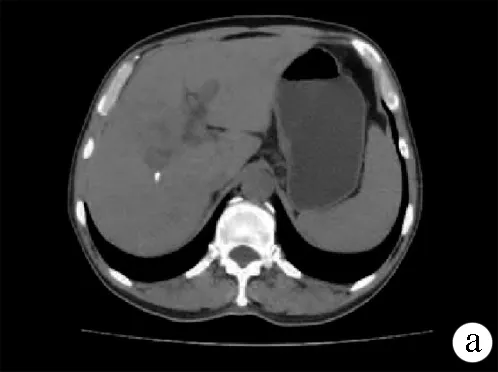
注:a:平扫见肝右叶肿块; b,动脉期见强化; c,静脉期见持续强化。
图2患者治疗前腹部CT

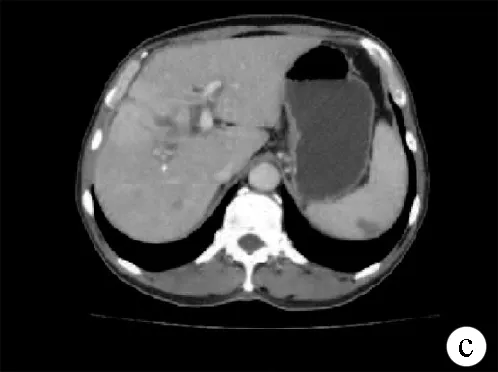
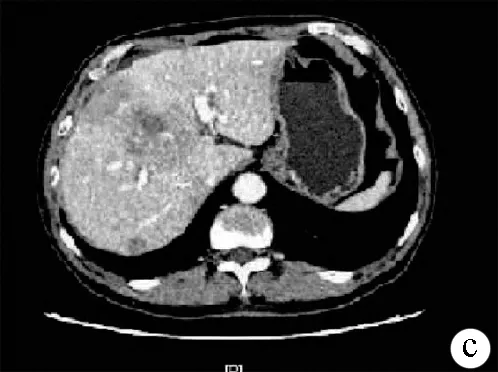
注:a,平扫见肝右叶肿块减少、缩小;b,动脉期见强化;c,静脉期见持续强化。
图3患者复查腹部CT
PHNEN起源于肝脏,但标准血清学标志物如AFP、CEA和CA19-9不具有诊断意义[4],NSE特异性较低,用于NEN诊断的价值并不大,但其敏感性较高,可以作为已确诊NEN患者的随访指标。有关文献[14-16]报道,CgA、Syn、CD56目前被公认为是诊断NEN 的特异性免疫组化标志物,其中特异性最高的是CgA,另有研究[15]表明血清CgA水平与消化道NEN的诊断及预后密切相关,可作为评估生物治疗及手术治疗的一种疗效观察指标。高级别NEC为分化不良的高级别恶性肿瘤[16],具有明显的核非典型性改变,多灶性坏死,高核分裂数(Ki-67>20%)。有研究[1]表明发生PHNEN的患者Ki-67≤20%组生存率高于Ki-67>20%组,表明Ki-67不仅在消化系统NEN具有指导意义,在PHNEN同样可以作为评估恶性程度的有效参考指标,对预后的判断具有重要的指导价值。本例患者NSE明显升高,随访过程中NSE显著下降恢复至正常。患者腹部CT提示肝内多发占位性病变,且伴有多发淋巴结转移,未见明确原发灶,病理结果提示为NEC, 免疫组化结果提示Syn、CD56为阳性,尽管CgA为阴性,综合考虑诊断成立。Ki-67显著升高,考虑预后较差[17]。
PHNEN的诊断必须达到两个标准:肝脏肿瘤必须具有神经内分泌特征,严格排除肝外主要部位。由于PHNEN非常罕见,且其临床及影像学表现缺乏特异性,该类病确诊主要依靠病理学诊断。在临床遇到无慢性肝炎及肝硬化病史,AFP及常规肿瘤标志物阴性,影像学不符合典型肝细胞癌表现的病例时,建议行肝穿刺活组织检查。在病理确诊为NEN后,应根据肿块大小、发生部位、肿块单发或多发以及全身系统检查和长期随访,综合考虑判定该病灶为原发性或转移性。本例中患者以“腹痛”为主要症状,腹部CT提示存在肝内多发占位性病变,无明确的原发病灶,与上述报道相符,该病最终诊断依靠病理学检查和免疫组化检测。
手术治疗是PHNET的首选治疗方式,特别是当确诊单个病灶或单叶时。Knox等[18]报道48例原发性肝脏类癌患者的5年生存率为78%,这与Iwao等[19]报告的53例PHNET患者的5年74%生存率相当。疗效与肿瘤的病变范围、转移、组织学特征有关,一般状况良好的患者完全切除原发肿物,并进行淋巴清扫可能治愈这种疾病。当病变无法切除或患者的一般状况和肝功能储备不允许手术时,可以考虑行肝动脉化疗栓塞术(TACE),已有的研究[20]结果表明:患者行TACE后中位生存时间达39.6个月,5年生存率可达35.5%,TACE可显著延长患者的生存时间。对于不能行根治手术者,化疗也是一种有效的治疗方式,目前NEN主要的化疗方案为EP方案,研究[21]表明铂类对于G3期NEN,特别是Ki-67>55%者有更好的疗效。此外对于肝脏肿瘤常用的化疗药物还有5-氟尿嘧啶、丝裂霉素、伊立替康、亚叶酸钙等[22]。然而缺乏大型随机对照试验的确凿证据,并且没有就应该对哪些患者群体进行化疗以及应该选择何种治疗方案达成共识,并且仍然需要确定治疗的最佳时机[23]。
综上所述,PTNEN是一类相对少见的肝脏肿瘤,临床缺乏典型表现及特异检查,确诊主要依靠病理学及免疫组化检查,CgA对诊断具有特异性,Ki-67能够提示预后。治疗上首选外科手术治疗,但应综合评估患者临床症状、肝脏肿瘤负荷、病理分化等情况,制订个体化治疗方案以提高疗效。
