髓源抑制性细胞在苯并芘诱导的肺慢性炎症至肺癌发生发展中的变化
2020-02-07刘婉玉宁春红高基民
刘婉玉,宁春红,高基民
(温州医科大学检验医学院 生命科学学院,浙江 温州 325035)
肺癌是全世界范围内发病率和死亡率最高的癌症之一[1],85%的肺癌是由吸烟导致的[2]。苯并芘(benzoapyrene,B[a]P)是烟草烟雾的主要成分之一,是重要的完全致肺癌多环芳烃类化合物[3-4],存在于煤焦油、石油、木材等燃烧产生的烟气,香烟烟雾、汽车尾气和焦化、炼油、塑料等工业污水中,在肺癌的发生中扮演着重要的角色[4]。已有研究证实,通过皮下注射或气管灌注苯并芘可诱导小鼠肺部发生肿瘤,吸入多环芳烃污染物可导致肺癌发生率升高。炎症是重要的肿瘤特性之一[5-6],慢性炎症与肿瘤的发生发展密切相关,主要包括促进肿瘤恶变、肿瘤细胞的增殖与侵袭、肿瘤组织血管的生成[7]。慢性炎症可以破坏免疫系统识别恶变前细胞的能力,通过多种机制促进多种类型肿瘤的起始和进展[8]。其中,炎症细胞通过释放多种细胞因子、趋化因子来调节肺慢性炎症微环境,促进支气管上皮细胞转化并逐步发展到癌前病变及癌转移,在肺癌的发生、发展中起着重要作用。因此,探究肺癌发生发展过程中免疫微环境相关免疫细胞及细胞因子的动态变化及作用,有望通过改善炎症组织微环境,为肺癌的早期预防和免疫治疗提供新策略。在该过程中,免疫微环境可诱导髓源抑制性细胞(特异性免疫抑制细胞)的产生,抑制宿主的抗肿瘤免疫反应,在肿瘤相关的免疫抑制方面起着重要的作用[9]。髓源抑制性细胞(myeloid-derived suppressor cells,MDSCs)是一种异质性的细胞群体,由未成熟的巨噬细胞、粒细胞、树突状细胞和其他早期分化的髓系细胞组成,在小鼠中的特异性表面标志为CD11b+Gr-1+[10],是一种重要的机体免疫调节细胞,其免疫抑制功能主要是通过各种效应分子来调节。MDSCs在癌症、慢性感染及由细菌引起的感染性疾病和自身免疫性疾病的发生发展过程中都起着重要的作用[11]。尽管在大多数癌症小鼠模型中都发现有MDSCs的积累,但在慢性炎症至肺癌发生发展动态过程中对MDSCs的研究较少。因此,本研究利用苯并芘诱导KM小鼠,构建肺慢性炎症和肺癌模型[12],通过免疫组织化学、流式细胞术对小鼠肺组织和脾脏中MDSCs数量变化进行检测,同时结合临床肺组织标本进一步验证MDSCs在肺癌病人肺组织中的表达情况,旨在探讨MDSCs在苯并芘诱导的小鼠肺慢性炎症至肺癌发生发展过程中的变化及作用,不仅有助于肺慢性炎症和肺癌的有效防治,而且为临床采用其相关拮抗剂对肺慢性炎症的治疗和肺癌的预防提供了适宜的动物模型和理论基础。
1 材料与方法
1.1 材料
1.1.1 试验动物
SPF级雄性昆明小鼠,购自上海斯莱克动物实验中心,引进饲养在温州医科大学动物实验中心,6~8周龄,体重(60±5)g。临床肺组织标本:癌、癌旁、正常组织石蜡块取自温州医科大学第一附属医院病理科。
1.1.2 试剂
苯并芘购自中国阿达玛斯试剂有限公司;玉米油购自美国Sigma公司;CD11b、Gr-1流式抗体购自美国BioLegend公司;免疫组化Gr-1抗体购自美国eBioscience公司;免疫组化CD33抗体购自英国Abcam公司。
1.2 方法
将60只SPF级昆明种小鼠,置于室温25 ℃,相对湿度55%,12 h明暗交替的环境中饲养,自由饮水。适应7 d后,将小鼠随机分成2组,经右侧胸壁穿刺肺内注射,对照组给予50 μL玉米油,处理组给予50 μL苯并芘-玉米油溶液(苯并芘浓度为20 mg·mL-1),每周处理1次,共4次。每日观察小鼠饮食、排便、毛色、精神和活动状况。分别在处理后30、90、180 d处死小鼠,采取小鼠肺、脾脏组织以供检测。
1.3 样品测定
1.3.1 小鼠肺组织形态观察
将小鼠肺组织取出,10%中性福尔马林固定,石蜡包埋,连续切片,HE染色,光镜下观察组织细胞形态改变,比较炎症细胞浸润程度及肿瘤细胞浸润情况。
1.3.2 小鼠肺组织Gr-1、临床肺组织标本CD33的表达情况
将小鼠肺组织取出,10%中性福尔马林固定,石蜡包埋,连续切片,经免疫组织化学两步法(脱蜡复水、抗原修复、封闭、一抗孵育、二抗孵育、DAB显色、脱水、透明、封片)染色,光镜下观察不同视野细胞染色数目及程度。临床肺组织标本:癌、癌旁、正常组织石蜡块连续切片,染色、观察方法同上。
1.3.3 MDSCs浸润情况
将小鼠肺组织和脾脏取出,研磨消化制成单细胞悬液,200目尼龙膜过滤,Anti-CD11b-APC、Anti-CD11b-FITC、Anti-Gr-1-PerCP-Cy5.5、Anti-Gr-1-PE-Cy7流式抗体染色,4 ℃避光孵育30 min,IMDM培养基清洗3遍,上机分析。
1.4 数据分析
Gr-1表达的半定量分析用IPP6.0软件,数据用GraphPad Prism5.0软件进行t检验分析,ns表示差异不显著(P>0.05),*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果与分析
2.1 小鼠肺组织细胞形态
小鼠右侧肺组织切片如图1。如图所示,相较于对照组小鼠,处理组小鼠肺组织出现了明显的炎症反应和病理改变,且随着暴露时间延长炎症反应和病理改变逐渐明显。苯并芘暴露180 d后,小鼠肺组织出现大量异型细胞,且伴有大量炎症细胞浸润,肺组织的正常生理结构消失改变,出现肺癌组织病理特征。对照组小鼠肺泡腔、毛细血管及终末细支气管均无明显的结构异常。
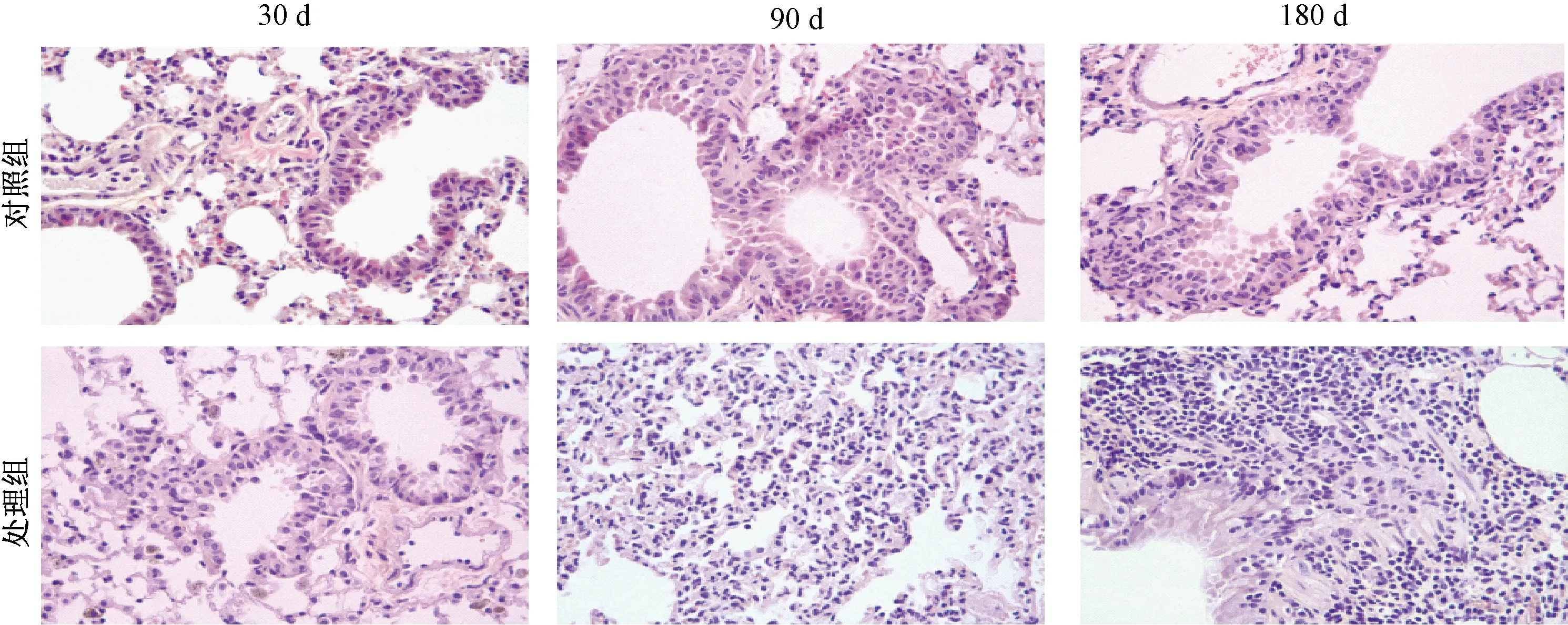
图1 小鼠肺组织的切片(400×)
2.2 小鼠肺组织Gr-1的表达情况
Gr-1是髓系分化状态细胞表达的蛋白,MDSCs是髓源抑制性细胞,在小鼠中其表面标志为CD11b+Gr-1+。本研究以Gr-1为MDSC的标志蛋白进行免疫组织化学染色,不同处理组小鼠肺组织Gr-1的表达及定位情况代表图见图2,不同处理对小鼠肺组织Gr-1表达水平的影响差异见图3。如图所示,苯并芘暴露后,Gr-1主要位于支气管黏膜上皮、肺泡上皮细胞核中,阳性染色为棕黄色;苯并芘暴露30、90、180 d后,小鼠肺组织中Gr-1的染色强度均明显高于对照组,并随暴露时间的延长逐渐增强,且具有统计学意义。研究结果表明,MDSCs很有可能参与了苯并芘诱导小鼠肺慢性炎症至肺癌的发生发展。
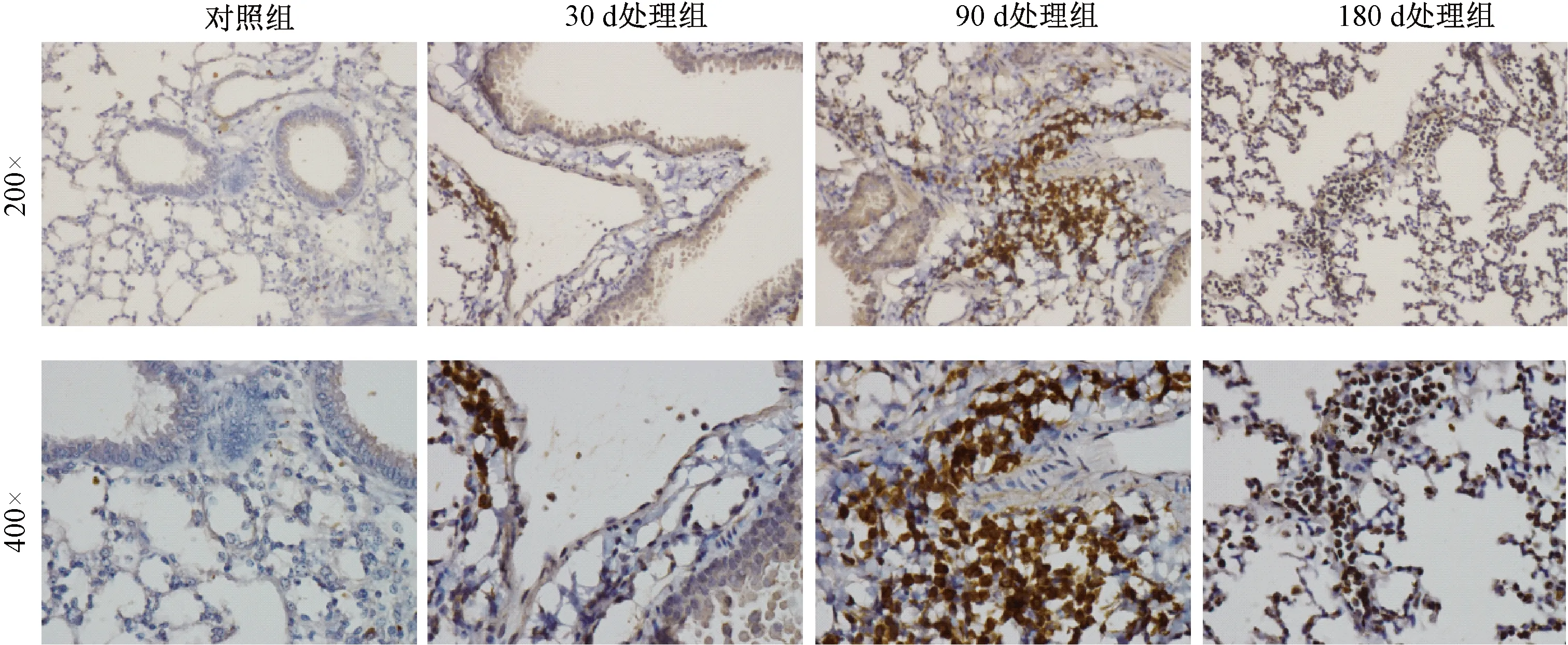
图2 不同处理小鼠肺组织Gr-1的表达及定位
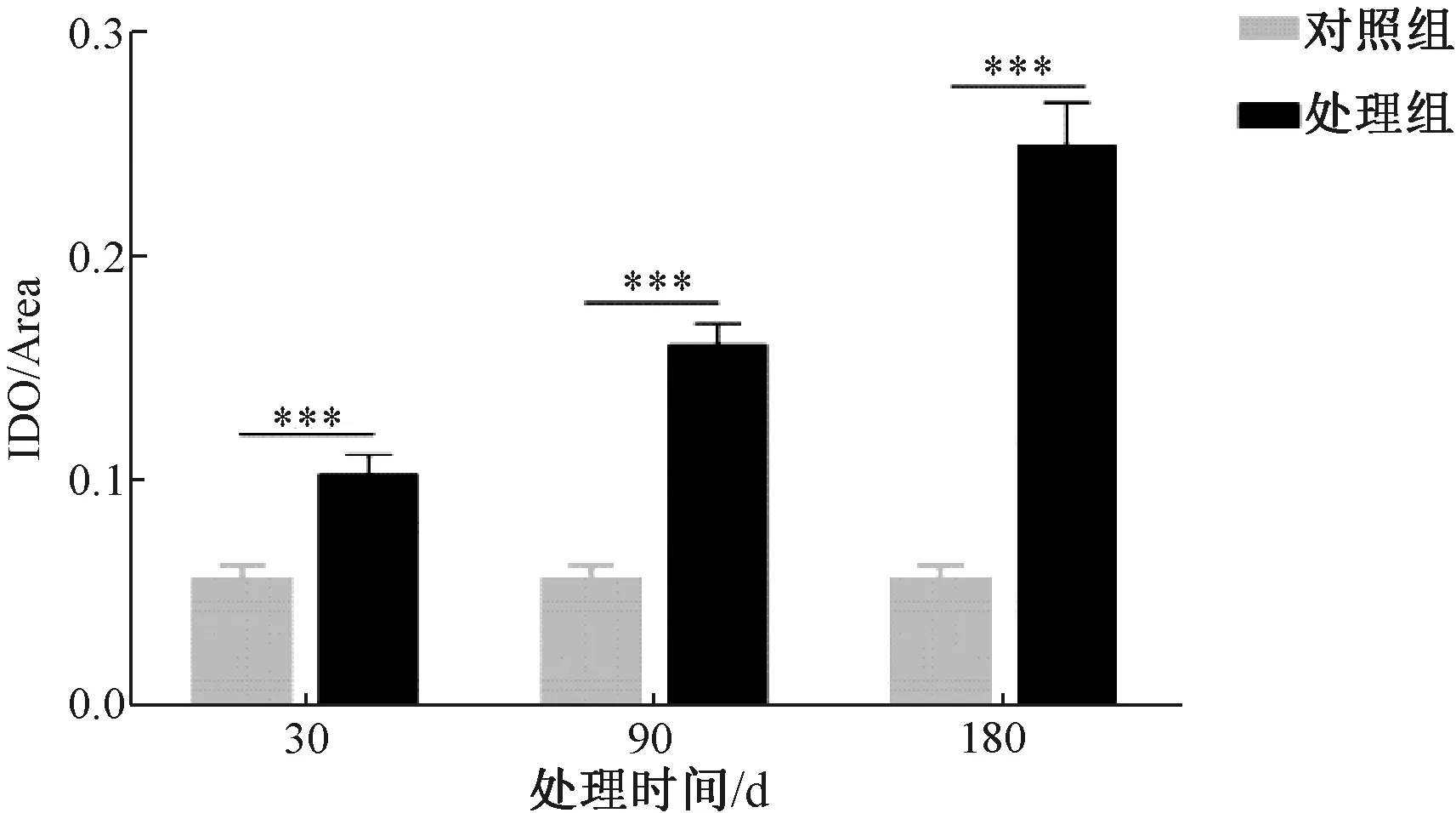
图3 不同处理小鼠肺组织Gr-1表达水平
2.3 小鼠肺组织中MDSCs浸润情况
不同处理组小鼠肺组织中MDSCs表达流式细胞图见图4,不同处理对小鼠肺组织MDSCs表达水平的影响差异见图5。如图所示,苯并芘暴露后30、90、180 d小鼠肺组织中MDSCs百分比相比玉米油对照组显著增加,且与玉米油对照组相比差异均具有统计学意义。研究结果表明,MDSCs在苯并芘诱导的肺慢性炎症至肺癌的发生发展中可能发挥重要作用。
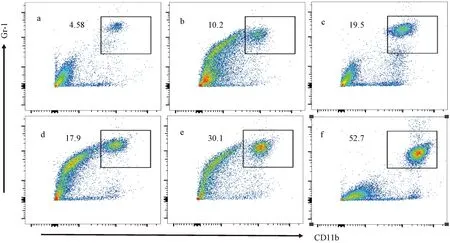
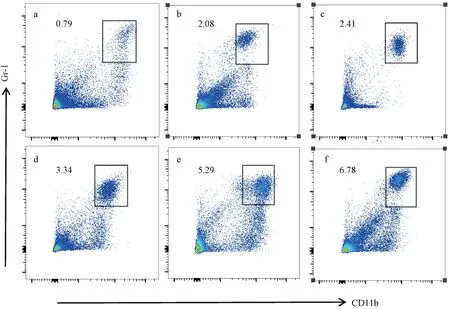
a—玉米油暴露30 d;b—玉米油暴露90 d;c—玉米油暴露180 d;d—苯并芘暴露30 d;e—苯并芘暴露90 d;f—苯并芘暴露180 d。图4 不同处理小鼠肺组织MDSCs流式细胞
2.4 小鼠脾脏中MDSCs浸润情况
脾脏是机体最大的免疫器官,含有大量的淋巴细胞和巨噬细胞。不同处理组小鼠脾脏中MDSCs表达流式细胞图见图6,不同处理对小鼠脾脏中MDSCs表达水平的影响差异见图7。如图所示,苯并芘暴露180 d时,MDSCs百分比显著增加;苯并芘暴露30、90、180 d时,小鼠脾脏中MDSCs百分比相比玉米油对照组显著增多。
a—玉米油暴露30 d;b—玉米油暴露90 d;c—玉米油暴露180 d;d—苯并芘暴露30 d;e—苯并芘暴露90 d;f—苯并芘暴露180 d。图6 不同处理小鼠脾脏MDSCs流式细胞
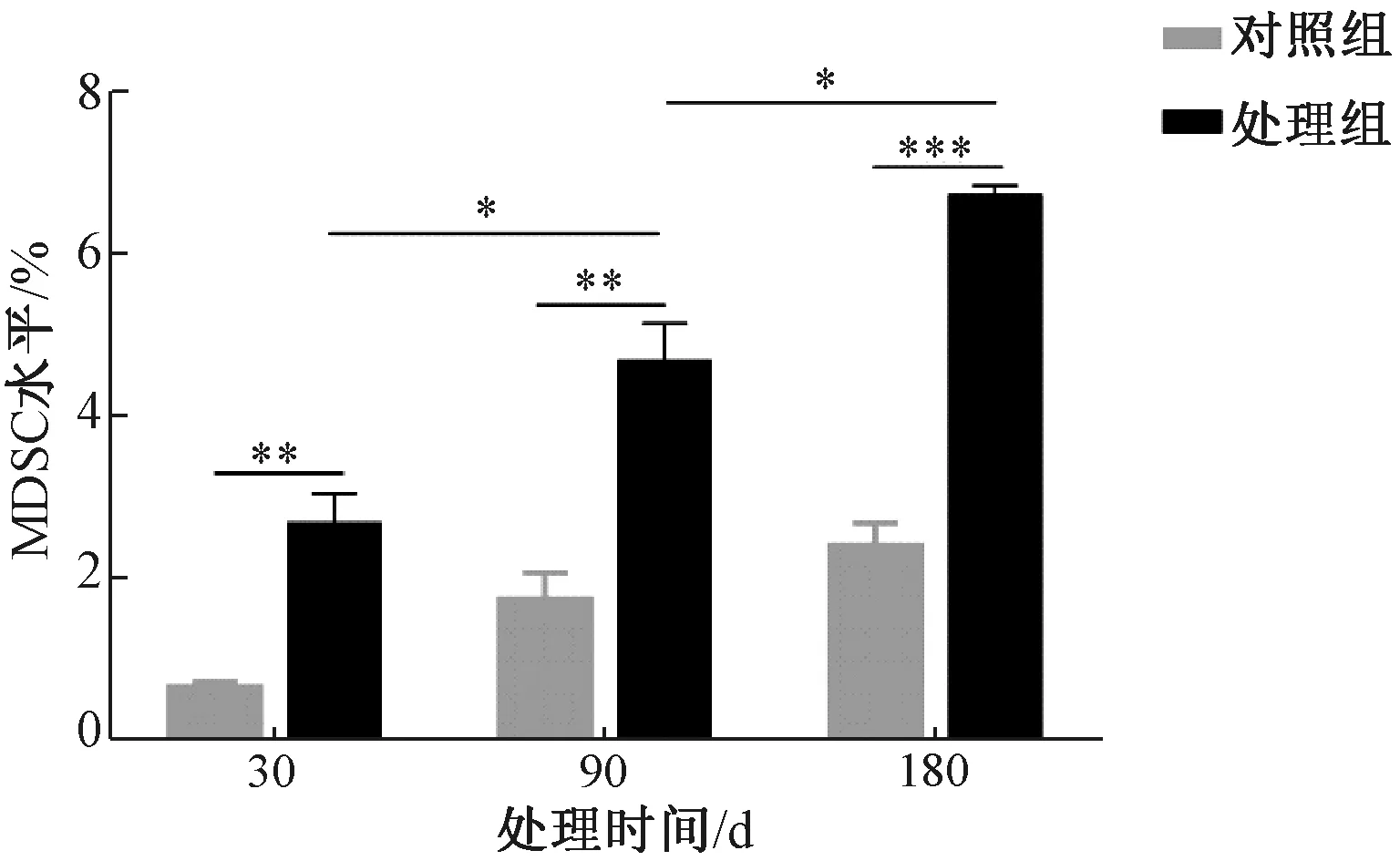
图7 不同处理小鼠脾脏MDSC细胞水平
2.5 肺癌组织中CD33的表达情况
目前人体内的MDSCs表型尚未明确统一,不同肿瘤类型中的MDSCs具有异质性。最常见的癌症患者体内分离出来的MDSCs表型为CD11b+CD14-,此外还有CD33+、CD34+、CD15+和MHC-Ⅱ类分子HLA-DR-等标志。有报道称,肺癌患者体内MDSCs(CD33+HLA-DR-CD11b+Lin-)的含量与其分期有关,Ⅳ期肿瘤患者伴有远处转移时体内MDSC的含量明显增高。因此,本研究以CD33作为MDSCs的标志物,来进一步验证MDSCs在肺癌病人肺组织中的表达情况。本研究选取了25例肺腺癌临床标本,与其对应的癌旁标本13例、正常标本11例,免疫组织化学染色检测CD33表达的情况。如图8所示,CD33定位于细胞膜,细胞质中也有少量表达,大部分表达于癌巢间正常细胞。MDSCs细胞核较大,为肾形和马蹄形,胞浆丰富,细胞形态不规则,呈现出髓系前体细胞形态,于包膜部位呈现不同程度的棕黄色。正常组织(阳性比率0/11)和癌旁组织(阳性比率1/13)基本无阳性染色,而肺癌组织(阳性比率14/25)中CD33阳性染色程度升高。临床标本研究表明,相比正常和癌旁组织(基本阴性表达),肺癌组织中MDSCs出现了不同程度的表达,可能在肺癌的发生发展中起着作用。
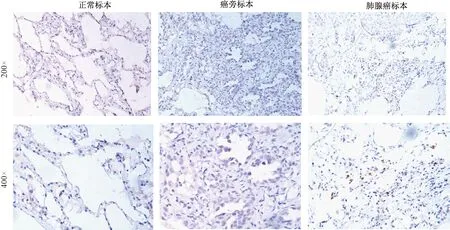
图8 人正常肺组织、癌旁组织和肺腺癌CD33的表达
3 讨论
多环芳香碳氢化合物(polycyclic aromatic hydrocarbons,PAH)及其衍生物与肺癌的发生密切相关。已有研究证实,香烟中有60多种致癌化合物,其中B[a]P及其代谢产物B[a]PDE(B[a]P在细胞内通过细胞色素P450代谢生成)是香烟中最为明确的重要致肺癌化合物,主要存在于煤焦油、香烟烟雾、汽车尾气和工业废气污水中,可应用于多种动物模型中,用于多种肿瘤的研究。近年来,许多相关文献报道B[a]P与许多癌症密切相关,已经证明B[a]P能诱发皮肤癌、肺癌和胃癌等多种癌症。B[a]P能通过多种途径诱导肺癌,并且常用小鼠来建立肺癌动物模型,便于直接观察肺慢性炎症至肺癌的动态演变过程和肺癌发生发展过程的形态变化。已有文献报道B[a]P与肺癌之间存在着密切联系,并通过雾化吸入、腹腔注射、灌胃等多种方法成功构建动物的肺癌模型[13]。本研究将B[a]P溶入玉米油中,采用经胸壁穿刺肺内直接注射的方法构建小鼠肺癌模型,该方法创伤小,不易造成气胸,小鼠恢复快,且定位准确。
肺癌组织学表现复杂多样,总体可以分为小细胞肺癌(small cel lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中非小细胞肺癌占80%。临床上将肺癌组织分为鳞状细胞癌、腺癌和大细胞癌3类。80%~90%的非小细胞肺癌与烟草烟雾直接相关,而小细胞肺癌几乎都与吸烟有关[14-15]。肺上皮细胞经B[a]P诱导后,既可以发展为鳞癌、腺癌,也可以发展为未分化细胞癌。一般动物模型可以同时出现肺鳞癌、腺癌和未分化癌,这种现象类似于临床肺癌。因此,本研究构建的小鼠肺癌模型不仅适用于研究肺癌的发病机制,也能用于评价肺癌的化疗、放疗方案及预后判断。本研究应用的小鼠肺组织经病理学诊断,根据B[a]P诱导的小鼠肺慢性炎症至肺癌模型中30、90、180 d的肺组织病理变化,可以明确判定小鼠可由肺慢性炎症发展为肺腺癌,为后续研究奠定了基础。
慢性炎症以持续的免疫细胞招募和炎性介质产生为主要特征,与癌症之间存在密切关系。越来越多的研究表明,肺慢性炎症与肺癌的发病机制相关。人类肺癌的发生主要是由慢性炎症淋巴细胞和髓源性细胞的浸润,以及免疫反应的改变导致。在荷瘤宿主中,有多种不同的免疫抑制细胞,构成了一个免疫抑制网络[16-17]。在不同功能的免疫抑制细胞中,CD11b+Gr-1+髓系起源细胞被认为是一种重要的免疫抑制细胞[18]。髓源抑制性细胞(MDSCs)是一种重要的调节免疫反应的异质性的细胞群体,由未成熟的巨噬细胞、粒细胞、树突状细胞和其它早期分化的髓系细胞组成,对肿瘤逃脱免疫反应做出了重要的贡献[19]。MDSCs是髓源抑制性细胞,其在小鼠中的特异性表面标志为CD11b+Gr-1+[20],主要包括单核系monocytic MDSCs(M-MDSCs,表型为CD11b+Ly6G-Ly6Chigh)和粒系granulocytic MDSCs(G-MDSCs,表型为CD11b+Ly6G+Ly6Clow)[21]。MDSCs通过抑制机体固有免疫系统和适应性免疫系统的能力抑制了宿主的抗肿瘤免疫反应,由于其具有免疫抑制功能近年来受到广泛关注。Gr-1是髓系分化状态细胞表达的蛋白。本研究通过构建小鼠肺癌模型、HE染色、免疫组化、流式细胞术等方法,研究了MDSCs在B[a]P诱导小鼠肺慢性炎症至肺癌发生发展过程中的关键作用。结合临床肺癌标本进一步验证MDSCs在肺癌病人肺组织中的表达情况,提示MDSCs可能在肺癌的发生发展中起着关键作用。在此研究基础之上,未来可对MDSCs在肺慢性炎症至肺癌发生发展过程中的具体分子机制做进一步研究,这对临床上将其作为治疗靶点,有针对性地对肺慢性炎症进行治疗及预防,从而对肺癌的早期预防起着重要的作用。
