液相色谱-质谱联用-定向进化酶组合技术应用于三萜类皂苷转化研究
2020-02-06孙红梅陆泽林赵幻希郑飞李晶刘明越皓于珊珊
孙红梅 陆泽林 赵幻希 郑飞 李晶 刘明 越皓 于珊珊

摘 要 利用定向进化技术重组糖苷酶ABQ,转化不同结构的三萜类皂苷(商陆皂苷甲、三七皂苷R1和柴胡皂苷A),通过高分离度液相色谱-四极杆飞行时间质谱鉴定转化的产物结构,阐明其转化机制。结果表明,重组糖苷酶ABQ能够催化商陆皂苷甲、三七皂苷R1和柴胡皂苷A侧链糖苷键的水解,转化为商陆皂苷乙、三七皂苷R2、柴胡次皂苷F和柴胡皂苷元F。根据色谱-质谱对反应产物的实时分析,ABQ对这3种三萜皂苷表现出不同的底物选择性,重组糖苷酶ABQ能够催化商陆皂苷甲C-3位外侧的葡萄糖水解,生成商陆皂苷乙;三七皂苷R1的C-20位葡萄糖被水解, 生成三七皂苷R2;重组糖苷酶ABQ能够首先催化柴胡皂苷A的C-3位葡萄糖水解, 生成柴胡次皂苷F,并繼续催化C-3位的岩藻糖苷水解,生成柴胡皂苷元F。定向进化技术重组酶能够提高酶活力和作用环境适应能力,色谱-质谱联用通过原型和产物实时检测评价重组酶的作用。
关键词 三萜皂苷; 生物转化; 液相色谱-质谱联用; 酶定向进化技术
1 引 言
三萜皂苷是自然界中广泛存在的一类重要的植物次生代谢产物,是由三萜皂苷元和糖以及其它有机质组成,存在于许多中药(如威灵仙、三七、柴胡、商路)中,具有广泛的药理活性,如抗癌、抗炎、抗糖尿病、提高免疫力等生物学活性,目前,已从自然界发现2万余种类型,常见的三萜皂苷主要包括四环三萜皂苷和五环三萜皂苷两大类。四环三萜可分为羊毛脂烷型、达玛烷型、葫芦素烷型、原萜烷型、环菠萝蜜烷型等;五环三萜可分为齐墩果烷型、乌苏烷型、羽扇豆烷型和木栓烷型等。其中,达玛烷型四环三萜和齐墩果酸型五环三萜是最为常见的两种三萜类皂苷,因而对这两类皂苷的研究也是目前的热点[1~7]。商陆皂苷甲和柴胡皂苷A均为齐墩果酸型五环三萜,前者是在其皂苷元基础上C-3位糖侧链由一分子木糖和一分子葡萄糖以β-(1,4)糖苷键连接而成,后者为其皂苷元上的C-3位糖侧链由一分子岩藻糖和一分子葡萄糖以β-(1,3)糖苷键组成;三七皂苷R1为达玛烷型四环三萜,在C-20位连接一个葡萄糖,C-3位糖侧链由一分子木糖和一分子葡萄糖组成,其连接方式以β-(1,2)糖苷键连接。以上3种三萜皂苷具有重要的药理活性,如商陆皂苷甲具有保护肝脏的作用, 柴胡皂苷A具有抑制病毒的活性, 三七皂苷R1对糖尿病具有治疗等作用[8~10]。
三萜皂苷化学结构的差异使其在生物利用度及生物活性等方面存在较大差别。如苷的极性与它所连接的糖基数量成正比,因而苷的极性比其次生苷或苷元的极性大,对应脂溶性相对较低,从而不利于吸收[11]。近期的研究还表明,三萜皂苷去糖基化后的代谢或转化产物表现出了更好的生物可吸收性及药理活性。如在治疗冠脉结扎导致的大鼠心肌缺血方面,三七皂苷R2的药效活性比三七皂苷R1高[12],三七皂苷R2与三七皂苷R1具有相同的皂苷元结构,其结构差别在于C-20位连接葡萄糖残基数量的不同,三七皂苷R1的C-20位连接一个葡萄糖, 而三七皂苷R2的C-20位无糖基取代,推测糖基的数量不同导致其药理活性的差异;商陆皂苷甲是商路的主要活性成分,因其具有显著的抗炎活性而得到越来越多的重视,然而商路皂苷甲的强溶血性极大地限制了其应用。通过生物转化方法对商路皂苷甲进行去糖基化处理后, 生成的商路皂苷乙不仅溶血性降低,抗炎活性也得到进一步增强[13,14]。因而,通过三萜皂苷的去糖基化结构修饰有望获得药效更加显著、安全低毒的皂苷化合物。
去糖基化可通过热转化、温和酸水解、酶水解、微生物转化法等方法实现,其中,微生物转化和酶水解因其具有较高的底物特异性及低副产物和高产率的特性而被广范应用[15]。于蓓蓓等[16]报道了在肠道微生物作用下柴胡皂苷A转化为柴胡次皂苷F,柴胡次皂苷F又进一步被转化为柴胡皂苷元F。Cui等[17]报道了应用葡萄糖苷酶将商路皂苷甲转化为商路皂苷乙。本研究组之前报道了利用重组内切纤维素酶Fpendo5A转化三七总皂苷并获得去糖基化皂苷化合物的研究[18]。到目前为止,能用于商路皂苷、柴胡皂苷及三七皂苷转化的微生物及酶的数量仍然较少,极大地限制了其理论研究及应用开发,因此,开发可用于转化商陆皂苷、柴胡皂苷、三七皂苷的新型酶,从而获得高效、稳定、低毒的活性皂苷具有重要意义。
重组糖苷酶ABQ来源于Flavobacterium johnsoniae菌, 在65℃、 Na2HPO4-柠檬酸缓冲液(pH=5.0)的条件下,具有很好的活性,此酶反应条件温和,适用于皂苷转化的研究。本研究利用重组糖苷酶ABQ对商陆皂苷甲、柴胡皂苷A和三七皂苷R1进行转化,应用高效液相色谱仪和快速分离液相色谱-四极杆飞行时间质谱联用仪对3种三萜皂苷的转化产物结构进行鉴定,从而阐明其转化机制。 本研究结果将有助于三萜皂苷生物转化工艺的开发,同时为三萜皂苷的药理研究及开发奠定基础。
2 实验部分
2.1 仪器与试剂
ThermoU-3000型高效液相色谱仪、NanoDrop2000超微量分光光度计(美国Thermo公司); Agilent RRLC 1200 SL-6520 Q-TOF-MS液相色谱-质谱联用仪(美国Agilent公司); 5811GK981477台式大容量高速冷冻离心机(德国Eppendorf公司); Medlum-S400超纯水机(上海和泰仪器有限公司); MLS-3751L高压蒸汽灭菌器(日本Panasonic公司)。
柴胡皂苷A、商陆皂苷甲、三七皂苷R1的皂苷标品(纯度≥98%,上海源叶生物科技有限公司); 乙腈、甲醇、甲酸(色谱纯,美国Fisher试剂公司); 对硝基苯基 -β-D-吡喃葡萄糖苷、对硝基苯基 -β-D-吡喃半乳糖苷、对硝基苯基 -α-L-呋喃阿拉伯糖苷、对硝基苯基 -α-L-吡喃阿拉伯糖苷、对硝基苯基 -α-L-吡喃鼠李糖苷、对硝基苯基 -β-D-吡喃木糖苷、邻硝基苯基 -β-D-吡喃葡萄糖苷、纤维二糖、龙胆二糖、昆布二糖、蔗糖(纯度98%,上海源叶生物科技有限公司); 异丙基 -β-D-硫代半乳糖苷(IPTG)、Kanamycin Sulfate(纯度≥99%,北京金泰宏达生物科技有限公司)。
2.2 实验方法
2.2.1 重组糖苷酶ABQ的表达及纯化 在100 mL LB液体培养基中培养工程菌,于37℃以180 r/min 转速下振荡培养12 h后,转移至 2 L LB 液体培养基中,相同的培养条件,当菌液在600 nm处的吸光度值(OD 600)达到0.6~0.8时,在培养基中加入1 mol/L IPTG,于30℃、120 r/min 转速下诱导过夜; 将发酵液于4℃以8000 r/min离心5 min,弃去上清液,收集菌体。称取约5 g菌体,加入50 mL 20 mmol/L Na2HPO4-柠檬酸缓冲液(pH=5.0)重悬,冰浴下超声破碎40 min,于4℃以10000 r/min離心40 min后,收集上清液; 采用镍柱亲和层析法纯化,将收集到的蛋白于相同的缓冲液中透析过夜,利用SDS-PAGE电泳鉴定样品纯度,最后将酶于-20℃保存,用于进一步的转化研究。
2.2.2 底物选择性测定 测定糖苷酶ABQ对不同糖苷底物的水解活力,底物包括对硝基苯基 -β-D-吡喃葡萄糖苷、对硝基苯基 -β-D-吡喃半乳糖苷、对硝基苯基 -α-L-呋喃阿拉伯糖苷、对硝基苯基 -α-L-吡喃阿拉伯糖苷、对硝基苯基-α-L-吡喃鼠李糖苷、对硝基苯基 -β-D-吡喃木糖苷、邻硝基苯基 -β-D-吡喃葡萄糖苷、龙胆二糖、纤维二糖、昆布二糖、蔗糖。
采用比色法[19],测定重组酶ABQ水解对硝基苯基 -β-D-吡喃葡萄糖苷、对硝基苯基 -β-D-吡喃半乳糖苷、对硝基苯基 -α-L-呋喃阿拉伯糖苷、对硝基苯基 -α-L-吡喃阿拉伯糖苷、对硝基苯基 -α-L-吡喃鼠李糖苷、对硝基苯基 -β-D-吡喃木糖苷、邻硝基苯基 -β-D-吡喃葡萄糖苷的水解活力。实验组为50 μL 20 mmol/L底物加入10 μL 0.040 mg/mL酶溶液,补加20 mmol/L Na2HPO4-柠檬酸缓冲液(pH=5.0)至总体积为100 μL,每个底物均做3个平行样品,反应的样品放于65℃恒温水浴中,准确计时10 min。时间结束后,反应样品立即放于冰水中终止反应,测定450 nm处的吸收值。空白组总反应体系为100 μL, 在50 μL 20 mmol/L 底物中加入50 μL 20 mmol/L Na2HPO4-柠檬酸缓冲液(pH=5.0),同上述实验组操作相同,作为对照。
采用经典的Miller方法[20],测定重组酶ABQ水解蔗糖、纤维二糖、龙胆二糖、昆布二糖的活力。还原糖的定量分析使用DNS试剂(3,5-Dinitrosalicylic acid reagent)。酶的水解活力通过测定糖底物所释放的还原糖量确定。将含有质量体积浓度1%底物(Sucrose、Gentiobiose、Cellobiose、Laminaribiose)的缓冲液在65℃水浴中预热15 min。加入适量酶液,与底物溶液充分混合,在65℃条件下反应1~5 min。终止反应后,取500 μL反应液加入到1 mL DNS 试剂中,煮沸5 min,流水冷却后,高速离心,并补加去离子水至20 mL,将测得的A529与葡萄糖标准曲线进行比较,计算反应产生的还原糖量(用相当量的葡萄糖表示)。
酶活力单位(IU)定义:每分钟催化产生1 μmoL还原糖所需的酶量定义为1 IU。
2.2.3 分析条件
色谱条件: C18反相色谱柱(5 cm×3.0 mm,2.7 μm; 美国Supelco公司),柱温30℃; 流动相A为体积分数0.1%的甲酸溶液,B为乙腈; 二元线性梯度洗脱: 0~5 min,15%~19% B; 5~10 min,19% B; 10~13 min,19%~25% B; 13~15 min,25%~28% B; 15~18 min,28% B; 18~22 min,28%~30% B; 22~25 min,30%~35% B; 25~30 min,35%~40% B; 30~35 min,40%~60% B; 35~38 min,60%~80% B; 38~40 min,80%~100% B; 40~45 min,100% B; 流速0.4 mL/min; 进样量5 μL。
质谱条件: 电喷雾负离子模式,干燥气温度(Gas temperature) 350℃,干燥气流速(Drying gas)8 L/min, 雾化气压力255 kPa,传输毛细管电压(DualESI VCap)3500 V,碎裂器电压(Fragmentor)175 V,锥孔电压(Skimmer)65 V。
2.2.4 重组糖苷酶ABQ转化三萜皂苷
配制1 mg/mL的3种皂苷溶液作为底物,等体积加入一定浓度的酶液,于65℃下反应,间隔时间取样,加入等体积的水饱和正丁醇终止反应,涡旋2~3 s后,于4℃以10000 r/min离心2 min,静置10 min,取等量的上层正丁醇溶液, 60℃水浴条件下蒸干,收集固体样品,用甲醇复溶并定容至1 mL,用于高效液相色谱仪和快速分离液相色谱-四极杆飞行时间质谱联用仪检测。
3 结果与讨论
3.1 糖苷酶ABQ的底物选择性
为获得糖苷酶ABQ对不同糖苷键的特异性,在65℃, 20 mmol/L Na2HPO4-柠檬酸缓冲液(pH=5.0)的条件下,考察了糖苷酶ABQ对带有不同糖苷键的底物的催化活性,结果(表1)表明,ABQ对对硝基苯基 -β-D-吡喃葡萄糖苷的水解活力最大; 对邻硝基苯基 -β-D-吡喃葡萄糖糖苷键、龙胆二糖糖苷键、纤维二糖糖苷键表现出较低的水解活力; 对对硝基苯基 -β-D-吡喃半乳糖苷、对硝基苯基 -α-L-阿拉伯糖苷、对硝基苯基 -α-L-吡喃阿拉伯糖苷、对硝基苯基 -α-L-吡喃鼠李糖苷、对硝基苯基 -β-D-吡喃木糖苷、昆布二糖、蔗糖没有水解活性。由此可见,重组糖苷酶ABQ属于β-葡萄糖苷酶类。
3.2 糖苷酶ABQ轉化三萜皂苷的产物鉴定
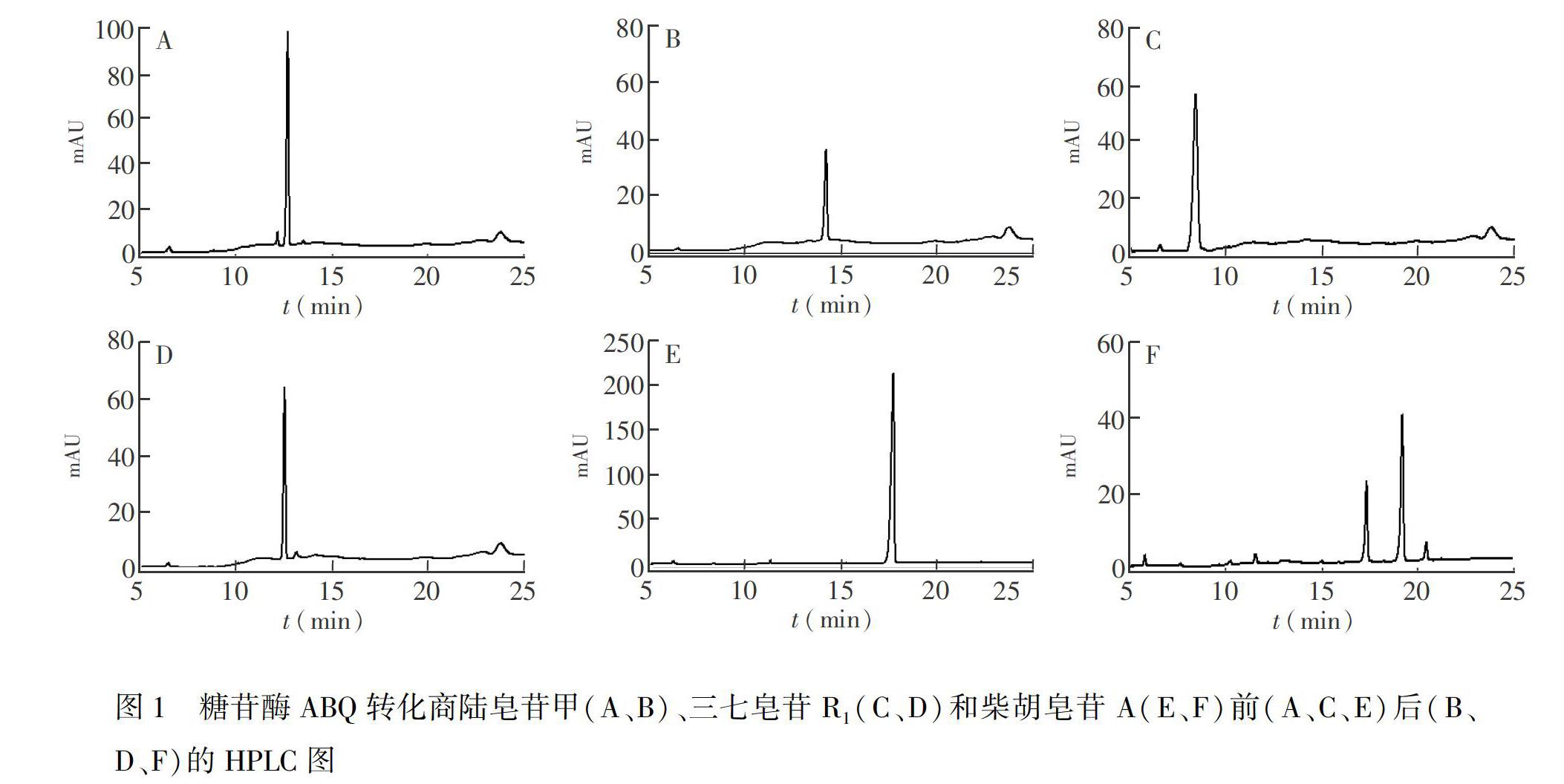
利用高效液相色谱法,对ABQ转化3种皂苷底物的转化过程进行了研究(图1),比较3种皂苷底物转化前后的高效液相色谱图发现,商陆皂苷甲在反应2 h时明显减少并伴有新化合物产生,底物与产物的保留时间分别为12.7和14.2 min; 糖苷酶ABQ对三七皂苷R1具有较强的转化能力,反应0.5 h时全部底物转化成单一产物,底物与产物的保留时间分别为8.3和12.4 min; 糖苷酶ABQ转化柴胡皂苷A时,反应4 h后有两个产物峰,柴胡皂苷A与其产物1和2的保留时间分别为17.7、19.2 和20.5 min。 由此可见,糖苷酶ABQ能够转化商陆皂苷甲、三七皂苷R1、柴胡皂苷A。为进一步阐明其转化机制,利用RRLC-Q-TOF-MS对产物结构进行了鉴定。通过液相色谱-质谱联用技术,可以获得化合物的保留时间和精确质荷比,通过以适当的碰撞能量使选择的母离子充分碎裂,获得化合物的特征碎片离子信息,从而阐明化合物的化学结构。以下离子的m/z值均用整数表示。
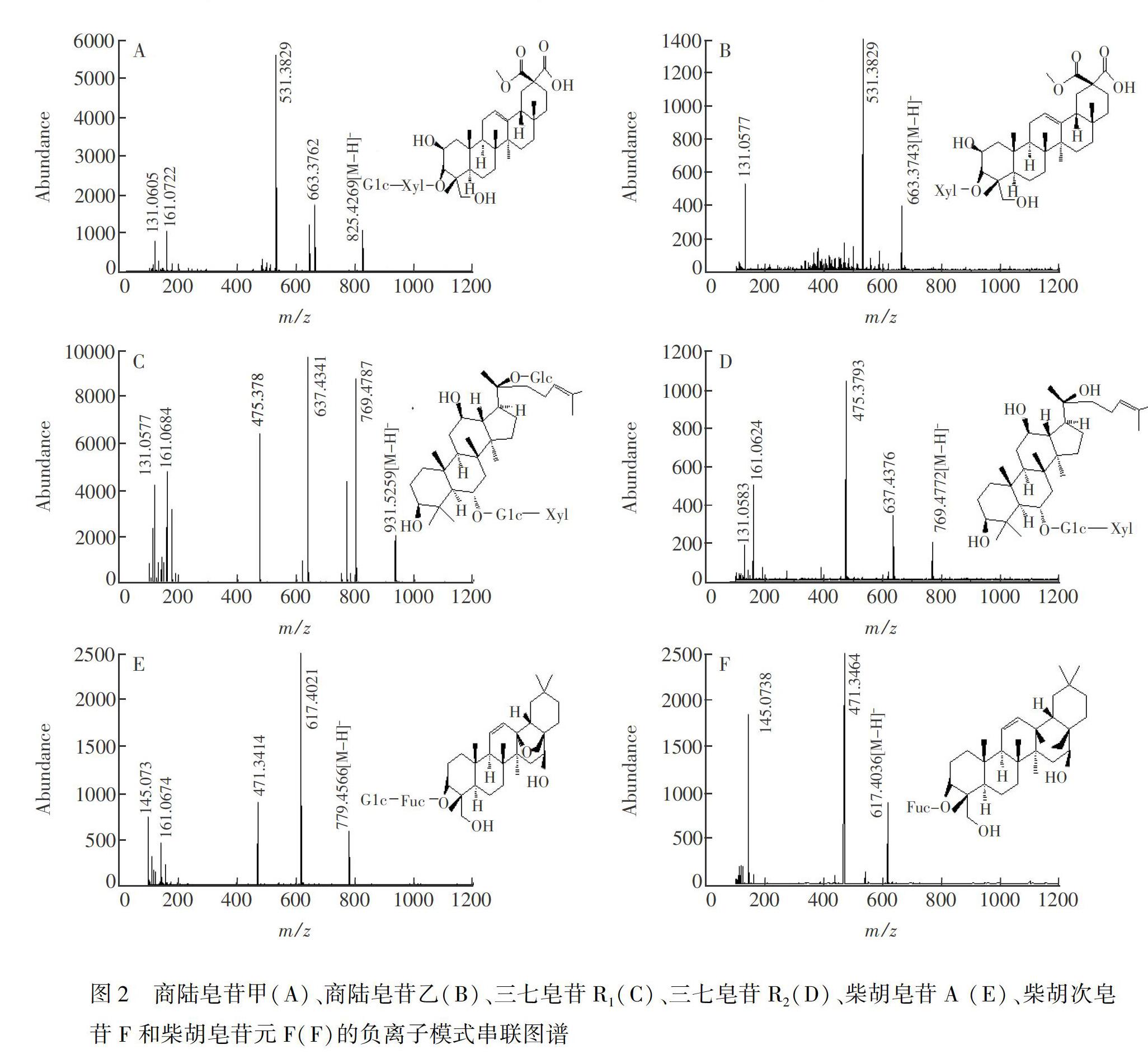
图2A中的离子m/z 825为商陆皂苷甲的[MH\]准分子离子,m/z 663为母离子丢失一分子葡萄糖而产生的[MHGlc\]碎片离子,m/z 531为[MHGlc\]继续丢失一分子木糖基得到的碎片离子[MH Glcl\]。商路皂苷甲转化产物的串联质谱见图2B,准分子离子[MH\]为m/z 663, m/z 531为[MH\]丢失一分子木糖基而产生的[MH\]离子,m/z 531是齐墩果酸型五环苷元的特征峰,经查阅文献[21],鉴定此产物为商陆皂苷乙。
同样,图2C中的m/z 931为母离子三七皂苷R1的[MH\]准分子离子,碎片m/z 769为母离子丢失一分子Glc 残基产生的 [MHGlc\]碎片离子,m/z 637为[M HGlc\]继续失去一分子木糖基得到的 [MHGlc \] 碎片离子,m/z 637继续丢失一分子Glc残基产生的碎片离子m/z 475为[MH\]离子,而m/z 475为三七皂苷R1的达玛烷型四环皂苷元的特征离子。对其转化产物进行串联质谱分析,图2D中的m/z 769为[MH\]准分子离子,m/z 637为[MH\]丢失一分子Xyl 残基产生的[MH\]碎片离子,m/z 637为再丢失一分子 Glc残基得到的碎片离子,m/z 475为达玛烷型四环皂苷元的特征离子,经查阅文献[22],鉴定此化合物为三七皂苷R2。
由图2E可知,m/z 779为母离子的[MH\]准分子离子,m/z 617为母离子丢失一分子葡萄糖残基而得到的[MH\]离子,离子[MH\]继续丢失一分子岩藻糖残基得到离子m/z 471[MH\]碎片离子。通过图2F可知m/z 617为产物1的[MH\]准分子离子,m/z 471为母离子丢失一分子岩藻糖残基得到的[MH\]离子,m/z 471是齐墩果酸型五环皂苷元的特征离子,经查阅文献[23,24],鉴定产物1为柴胡次皂苷F,产物2为柴胡皂苷元F。
3.3 糖苷酶ABQ转化三萜皂苷的转化机制研究
通过以上对转化产物的结构研究,进一步对ABQ转化3种三萜皂苷的转化机制进行分析。商陆皂苷甲和柴胡皂苷A均为齐墩果酸型五环三萜,前者是在其皂苷元基础上C-3位糖侧链由一分子木糖和一分子葡萄糖以β-(1,4)糖苷键连接而成,后者为其皂苷元上的C-3位糖侧链由一分子岩藻糖和一分子葡萄糖以β-(1,3)糖苷键组成。三七皂苷R1为达玛烷型四环三萜,在C-20位连接一个葡萄糖,C-3位糖侧链由一分子木糖和一分子葡萄糖组成,其连接方式为β-(1,2)糖苷键连接。
经鉴定,糖苷酶ABQ与商陆皂苷甲在反应2 h后C-3位外侧的葡萄糖被水解生成商陆皂苷乙; ABQ与三七皂苷R1在反应0.5 h后底物完全被转化,C-20位的葡萄糖被水解生成三七皂苷R2; ABQ与柴胡皂苷A在反应4 h后C-3位的葡萄糖首先被水解生成柴胡次皂苷F,继续水解C-3位的岩藻糖生成柴胡皂苷元F。综上,推测ABQ转化转化三萜皂苷的转化路径应为:糖苷酶ABQ可使部分三萜皂苷发生侧链糖基的水解反应,即商陆皂苷甲→商陆皂苷乙,三七皂苷R1→三七皂苷R2,柴胡皂苷A→柴胡次皂苷F→柴胡皂苷元F(图3)。通过糖苷酶的转化作用,使得皂苷底物的部分糖侧链发生水解,从而获得4种去糖基化皂苷化合物, 结构的改变使得脂溶性发生变化,生物利用度进一步增强,药理活性也随之产生差别。此项转化研究为未来应用该酶定向制备4种三萜皂苷(商陆皂苷乙、三七皂苷R2、柴胡次皂苷F和柴胡皂苷元 F)提供了新途径,同时,也为新药的筛选提供更多的候选分子,对于开发相关药品及保健食品具有重要作用。
4 结 论
利用高效液相色谱(HPLC)和高分离度快速液相色谱-四极杆-飞行时间质谱(RR LC-Q-TOF-MS)及其串联质谱(MS/MS)技术对重组糖苷酶ABQ转化3种三萜皂苷的产物进行了结构鉴定,通过比较转化前后的液相色谱图变化以及结合精确分子量和串联质谱碎片信息,快速鉴定出商陆皂苷甲的酶水解转化产物为商陆皂苷乙,三七皂苷R1的酶水解转化产物为三七皂苷R2,柴胡皂苷A的酶水解产物为柴胡次皂苷F和柴胡皂苷元F。因此,重组糖苷酶ABQ催化商陆皂苷甲,三七皂苷R1和柴胡皂苷A的转化路径分别是商陆皂苷甲→商陆皂苷乙; 三七皂苷R1→三七皂苷R2; 柴胡皂苷A→柴胡次皂苷F→柴胡皂苷元F。本研究为新酶源的开发及部分重要三萜皂苷的定向转化研究提供了方法。
References
1 Gong W, Jiang Z H, Sun P, Li L, Jin Y S, Shao L C, Zhang W, Liu B S, Zhang H W, Tang H, Chen Y F, Yi Y H, Zhang D Z. Chem. Biodivers., 2011, 8(10): 1833-1852
2 Liu L F, Ma X L, Wang Y X, Li F W, Li Y M, Wan Z Q, Tang Q L. J. Asian Nat. Prod. Res., 2009, 11(5): 389-396
3 Liu C L, Dong L H, Sun Z, Wang L, Wang Q P, Li H Y, Zhang J, Wang X J. Phytother. Res., 2018, 32: 2299-2311
4 Yang H, Chen Y J, Yu L J, Xu Y. Int. Immunopharmacol., 2017, 51: 148-157
5 Zhang B, Zhang J Y, Zhang C Y, Zhang X L, Ye J X,Kuang S H, Sun G B, Sun X B. Front. Pharmacol., 2018, 9: 1227
6 Abdullahi A Y, Kallon S, Yu X G, Zhang Y L, Li G Q. Bio. Med. Res. Int., 2016: 1510264
7 Karen T L, Yore M M, Sporn M B. Nat. Rev. Cancer, 2007, 7(5): 357-369
8 Wang L D, Zhang S L, Cheng H, Lv H M, Cheng G H, Ci X X. Free Radical Biol. Med., 2016, 101: 401-412
9 Chen J X, Duan M B, Zhao Y Q, Ling F F, Xiao K, Li Q, Li B, Lu C N, Qi W B, Zeng Z L, Liao M, Liu Y H, Chen W S. Oncotarget, 2015, 40(6): 42541-42556
10 Huang G D, Lv J Z, Li T Y, Huai G L, Li X, Xiang X W, Wang L L, Qin Z L, Pang J L, Zou B G, Wang Y. Int. J. Mol. Med., 2016, 38: 1179-1189
11 Silberberg M, Morand C, Besson C, Manach C, Scalbert A, Remesy C. Eur. J. Nutr., 2006, 45(2): 88-96
12 ZHOU Jia-Ming, YE Zu-Guang, CUI Xiu-Ming. Chinese Traditional Patent Medicine, 2010, 32(9): 1494-1497
周家明, 葉祖光, 崔秀明. 中成药, 2010, 32(9): 1494-1497
13 Escalante A M, Santecchia C B, López S N, Gattuso M A, Ravelo A G, Delle M F, Sierra M G, Zacchino S A. J. Ethnopharmacol., 2002, 82(1): 29-34
14 Escalante A, Gattuso M, Pérez P, Zacchino S. J. Nat. Prod., 2008, 71(10): 1720-1725
15 Yu S S, Zhou X L, Li F, Xu C C, Zheng F, Li J, Zhao H X, Dai Y L, Liu S Y, Feng Y. Sci. Rep., 2017, 7(1): 138
16 YU Bei-Bei, WANG Liang, YIN Li-Shun, SUN Rong. Chinese Traditional and Herbal Drugs, 2017, 48(2): 333-338
于蓓蓓, 王 亮, 尹利顺, 孙 蓉. 中草药, 2017, 48(2): 333-338
17 Cui P, Dou T Y, Sun Y P, Feng L, Zou L W, Wang P, Hao D C, Ge G B, Yang L. J. Mol. Catal. B, 2016: 25-31
18 LI Nan, ZHAO Huan-Xi, LI Jing, WANG Nan, YU Bo-Hao, YU Shan-Shan. Chem. J. Chinese University, 2017, 38(12): 2185-2192
李 男, 赵幻希, 李 晶, 王 楠, 于渤浩, 于珊珊. 高等学校化学学报, 2017, 38(12): 2185-2192
19 WANG Xin-Ying, FENG Li, XU Chun-Chun, YU Shan-Shan. Chinese Journal of Biologicals, 2014, 27(11): 1404-1407
王馨瑩, 冯 丽, 许春春, 于珊珊. 中国生物制品学杂志, 2014, 27(11): 1404-1407
20 Miller G. Anal. Chem., 1959, 31: 426-428
21 Wei F H, Prasad Singh R S, Fueth M, Swarts S, Okunieff P, Derendorf H. J. Pharmaceut. Biomed., 2015, 107: 82-88
22 ZHAO Jing, QIN Zhen-Xian, PENG Bing, LIU Yong-Gang, LIU Yong. Journal of Chinese Mass Spectrometry Society, 2017, 38(1): 97-108
赵 静, 秦振娴, 彭 冰, 刘勇刚, 刘 勇. 质谱学报, 2017, 38(1): 97-108
23 TIAN Wei, ZHEN Ya-Qin, CAO Wen-Li, CHEN Zhong, NIU Li-Ying. Chinese Pharmaceutical Journal, 2016, 51(23): 88-91
田 伟, 甄亚钦, 曹文丽, 陈 钟, 牛丽颖. 中国药学杂志, 2016, 51(23): 88-91
24 Meselhy M R. Japan Traditional Med., 2000, 17(1): 1-11
Abstract The directed evolution technology was used for recombination of glycosidase ABQ to transform triterpenoid saponins with different structures, including Esculentoside A, Notoginsenoside R1 and Saikosaponin A, and the biotransformation process of the triterpenoid saponins was investigated by rapid resolution liquid chromatography coupled with quadruple-time-of-flight mass spectrometry (RRLC/Q-TOF-MS). The result showed that ABQ had high activities for Esculentoside A, Notoginsenoside R1, Saikosaponin A, however, it showed different substrates selectivity for the three saponins. Besides, ABQ could catalyze the hydrolysis of C-3 lateral glucose of Esculentoside A and the C-20 lateral glucose of Notoginsenoside R1 to produce Esculentoside B and Notoginsenoside R2, repectively. And the recombinant glycosidase ABQ could catalyze the hydrolysis of C-3 lateral glucose of Saikosaponin A to produce Prosaikogenin F and then further catalyzed the hydrolysis of C-3 fucoside to produce Saikogenin F. In brief, the directed evolution technology could improve enzyme activity and environmental adaptability, and the chromatography-mass spectrometry could be used to evaluate the role of recombinant enzymes by real-time detection of prototypes and products.
Keywords Triterpenoid saponins; Biotransformation; Liquid Chromatography-mass spectrometry; Enzyme directed evolution
(Received 15 August 2019; accepted 8 November 2019)
This work was supported by the Jilin Province Science and Technology Development Plan Project (No.20170307029YY) and the Jilin Province Department of Education "13th Five-year" Scientific Program (No. JJKH2018125K).
