辛基功能化离子液体键合硅胶固相萃取海水中贝类毒素的方法研究
2020-02-06孙晓杰丁海燕谭杰邢钧郭萌萌邢丽红李兆新翟毓秀
孙晓杰 丁海燕 谭杰 邢钧 郭萌萌 邢丽红 李兆新 翟毓秀
摘 要 贝类毒素(Shellfish toxins)是重点监控的海洋污染物。本研究通过将辛基功能化离子液体接枝到硅胶表面,制备了一种混合模式的共价键合硅胶材料 (Silica-[SOIM\][PF6\]),利用红外光谱、核磁共振和元素分析进行了表征。采用自制材料填制固相萃取柱,通过固相萃取-液相色谱-质谱联用(SPE-LC-MS/MS)技术对海水中贝类毒素(大田软海绵酸毒素(OA)、鳍藻毒素-1 (DTX-1)和鳍藻毒素-2 (DTX-2))进行富集检测。研究发现,此固相萃取材料与目标贝类毒素可能存在疏水作用和离子交换作用等多重相互作用。分别对进样溶液的体积和pH值、淋洗剂和洗脱剂的种类、用量以及pH值范围等因素进行了优化。结果表明,此固相萃取材料对海水中3种贝类毒素具有良好的萃取效果,优于或与商用化萃取材料性能相当,检出限(LOD)为0.01 μg/L,定量限(LOQ)为0.05 μg/L,在0.02~2.50 μg/L范围内线性关系良好(R2>0.995),回收率在93.0%~116%之间。同时,材料具有良好的重现性,批内和批间的相对标准偏差均小于15%。本方法准确、灵敏、简便、可靠,可用于实际样品中贝类毒素的萃取检测。
关键词 离子液体; 固相萃取; 混合模式; 贝类毒素; 海水
1 引 言
我国是世界上最大的贝类养殖国。海洋中有毒微藻或微生物产生的贝类毒素,可污染海洋水体和海洋生物,并主要在双壳贝类中富集,可经食物链浓缩放大上万倍,最终危害人类的生存和健康[1~5]。贝类毒素已成为发达国家制定贸易和技术壁垒的重要指标。欧盟指令(EC)No.15/2011规定小鼠生物法测定贝类毒素含量作为官方标准于2014年以后停用,液相色谱-串联质谱法(LC-MS/MS)作为取代方法,可对单个组分分别进行定性和定量分析,已成为监测贝类毒素的重点发展方法[6~12],并建立了相应的检测标准[13]。然而,由于贝类毒素结构复杂、种类较多,提取富集等前处理技术成为限制其准确定量分析的主要瓶颈。为更好地评价贝类毒素对海洋生态的影响,监控赤潮等有毒藻类爆发,保障贝类等水产品的质量安全,亟需开发更有效的前处理方法和更灵敏的检测技术。
固相萃取是复杂样品富集净化的常用前处理技术,目前,用于污染物富集纯化的商用固相萃取柱与萃取对象作用模式单一。针对复杂样品中的多种组分分别提取纯化,步骤繁多, 耗时费力, 成本较高,同时耗用大量有机试剂,造成严重环境污染。因此,亟需研发含多种官能团的混合模式固相萃取材料,实现对样品中复杂多组分同时富集纯化, 提高分离检测效率。离子液体(Ionic liquids, ILs)是一种新型的萃取材料,凭借良好的热稳定性、低可燃性、不易挥发及低毒性等优点被广泛用于色谱样品的前处理[14,15]。经过多年研究,离子液体色谱材料的选择性能得到了逐步改善。将离子液体键合固定到载体上,可得到具有离子液体功能结构的固相萃取(Solid phase extraction, SPE)新材料。目前,固定化的离子液体多用于液相色谱柱[16~18]、气相色谱柱[19,20]及毛细管电色谱柱[21,22]的固定相,极少作为固相萃取吸附剂使用。Tian等[23] 于2009年首先提出了离子液体固相吸附剂的研究方案,与离子液体-液液萃取相比,可有效克服离子液体粘度大、不易操作等缺点,同时增大了被分离物质与离子液体的接触面积,在痕量组分的分离富集中具有良好的应用前景。固定化离子液体的相关研究起步较晚,主要用于萃取分离常见有机污染物[24,25]。离子液体固相萃取材料可在保留原有固相载体性质的基础上,同时发挥离子液体的特异选择性。另外,萃取材料可再生重复利用,将有效减少离子液体的使用量,增加萃取材料的使用率,降低前处理成本。因而,制备新型的离子液体固相萃取材料,是发展高效萃取技术的重要途径之一。
本研究通过接枝方法将辛基功能化离子液体固定到硅胶载体上,即形成离子液体共价键合硅胶材料,是具有混合模式的功能化萃取材料,可实现对样品中多性质组分分离纯化的目标。由于离子液体具有大体积的阳离子和小体积的阴离子,与偏酸性目标物可能存在阴离子交换作用。因此,选择3种弱酸性贝类毒素(大田软海绵酸毒素(Okadaic acid, OA)、鳍藻毒素-1 (Dinophysistoxin-1, DTX-1)和鳍藻毒素-2 (Dinophysistoxin-2, DTX-2))作为目标物,将ILs-SPE技术应用于海水样品中OA、DTX-1和DTX-2的富集和净化。优化了进样溶液的体积和pH值、淋洗剂和洗脱剂的种类、用量及pH值等条件,考察了各种因素对萃取效果的影响,评价了检测方法的可行性和重现性。
2 实验部分
2.1 仪器与试剂
TSQ Quantum AccessTM 液相色谱-串联质谱仪(美国Thermo Fisher Scientific公司); Kinetex XB C18色谱柱(150 mm × 2.1 mm,4 μm,美国Phenomenex公司); XW-80A型旋涡混合器(上海医大仪器厂); Milli-Q型超純水仪(美国Millipore公司); Thermo Sorvall Biofuge Primo型离心机(美国Thermo Fisher Scientific 公司); Karlsruhe红外光谱仪、Avance II spectrometer核磁共振仪(德国Brucker公司); Vario EL cube元素分析仪(德国Elementar公司)。Oasis HLB固相萃取(SPE)柱(3 mL, 60 mg,美国Waters公司)和C18固相萃取柱(3 mL,60 mg,天津博纳艾杰尔科技有限公司)。
OA和DTX-1标准品(纯度≥95%,台湾Algal Science公司); DTX-2标准溶液((4.7±0.3) μg/mL, 加拿大海洋生物科学研究所); 甲醇 (色谱纯,德国Merck公司); 乙腈(色谱纯,德国CNW公司); 甲酸、甲酸铵(色谱纯,德国Fluka公司); 1-苄基咪唑(色谱纯,Fluka公司); 六氟磷酸钾(色谱纯,J&K Chemical公司)。 其余溶剂和试剂均为分析纯, 实验用水为来自Milli-Q超纯水系统的超纯水。
混合标准使用液:分别称取适量的OA和DTX-1标准品,用甲醇定容,配制成10.0 μg/mL 的标准储备液,于-18℃避光保存。准确吸取适量的OA、DTX-1和DTX-2标准储备溶液,用甲醇配制1.00 μg/mL的混合标准溶液,于-18℃避光保存。
2.2 仪器条件和参数
柱温:35℃; 流速:0.3 mL/min; 进样量:10 μL; 流动相,A:2 mmol/L 甲酸铵溶液,B:乙腈-2 mmol/L甲酸铵溶液 (95∶5, V/V),梯度洗脱程序:0 min,30% B; 0~3.00 min,30%~90% B; 3.00~6.00 min,90% B; 6.00~6.01 min, 90%~30% B; 6.01~8.00 min, 30% B 。
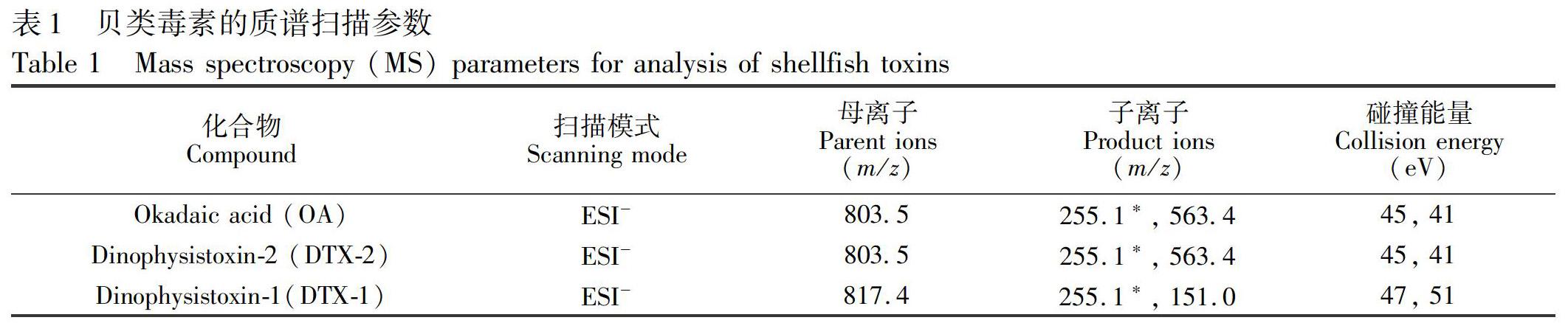
电喷雾电离源(ESI),多反应监测(MRM)离子模式; 负离子监测; 喷雾电压为4000 V; 鞘气和辅助气体均为高纯氮气,鞘气压力:36 L/min,辅助气压力:10 L/min,碰撞气为氦气; 离子传输杆温度为350℃。碰撞能(Collision energy)及其它相关质谱条件见表1。
2.3 辛基离子液体键合硅胶(Silica-[SOIM\][PF6\])的制备
离子液体及键合硅胶的制备过程参照图1。
2.3.1 辛基咪唑的合成 将体积分数为36%甲醛(8.35 g)和体积分数为32%乙二醛(18.1 g)加入250 mL三口烧瓶中,搅拌加热至50℃回流,然后分别将体积分数28%氨水(6.05 g)和辛胺的甲醇溶液(12.9 g溶于50 mL甲醇)逐滴加入到三口烧瓶,加完后继续回流反应4 h,纯化干燥得到淡黄色辛基咪唑产品。
2.3.2 硅烷基辛基咪唑氯盐的合成 将γ-氯丙基三甲氧基硅烷的甲苯溶液(0.08 mol, 15.9 g,溶于25 mL甲苯)加入三口烧瓶中, 将2.3.1节制得的辛基咪唑(0.08 mol, 14.4 g)加入溶解并搅拌均匀,在氮气气氛下回流48 h,产物纯化干燥得到粘稠状淡黄色液体, 即硅烷基辛基咪唑氯盐([SOIM\][Cl\])。
2.3.3 硅烷基辛基咪唑六氟磷酸盐的合成 将硅烷基辛基咪唑氯盐的甲醇溶液(0.05 mol, 18.9 g, 溶于25 mL甲醇中)加入圆底烧瓶中,同时将等摩尔的KPF6溶于甲醇(0.05 mol, 9.20 g, 溶于10 mL甲醇),将两种溶液混合,室温搅拌反应24 h,得到淡黄色沉淀; 纯化干燥得到粘稠状淡黄色液体, 即硅烷基辛基咪唑六氟磷酸盐( [SOIM\][PF6\] )。
2.3.4 离子液体键合硅胶的制备 选择粒径200~300目的硅胶粉,通过一定浓度的HCl或甲烷磺酸酸化,使硅胶外表面带有羟基,调节pH至中性后高温干燥,备用。称取约2 g辛基离子液体[SOIM\][ PF6]溶于10 mL乙腈,再加入HCl处理的硅胶(40~60目)约4 g,氮气保护下回流反应24 h后; 将反应液过滤,用乙腈和去离子水冲洗去除残留物,80℃真空干燥5 h,得到淡黄色离子液体键合硅胶Silica-[SOIM\][PF6\],产率约80%。
2.4 离子液体键合材料性能分析
通过多种仪器分析商用硅胶和离子液体键合硅胶的结构、构型以及二者的差异。首先通过红外光谱表征比较键合离子液体前后硅胶材料官能团结构的变化; 其次,采用核磁共振技术于确定功能化离子液体的结构; 然后,通过元素分析,得到离子液体键合硅胶材料中C、H、N元素的百分含量,并计算硅胶表面离子液体的键合含量。
2.5 固相萃取柱的制备
选用固相萃取柱的柱管体积为3 mL,柱管材料为聚丙烯,进出口筛板选用高纯度聚乙烯材料(直径6.4 mm,孔径20 μm,厚度1.5 mm),内部填充固相萃取填料选用自制的Silica-[SOIM\][PF6\](50 mg,粒径40~60 μm)。先在空柱管底部放入出口筛板,然后装入自制离子液体键合硅胶层,轻轻敲打使其分布均匀,其上垂直压入进口筛板,最后用甲醇冲洗填实,并保证所有小柱填充后,填料高度保持(5±0.05)mm。
2.6 样品处理
海水水样用0.45 μm滤膜过滤,除去悬浮颗粒。固相萃取柱使用前,分别用2.0 mL甲醇和2.0 mL 50 mmol/L乙酸铵活化,弃去流出液。取20 mL过滤后的海水样品,以约5.0 mL/min流速通过活化的固相萃取小柱进行富集。用2.0 mL 50 mmol/L乙酸铵淋洗,减压抽干后, 用3.0 mL 体积分数为5%的NH4OH-甲醇洗脱,洗脱液在40℃下氮气吹干, 用0.5 mL初始流动相复溶,充分涡旋溶解残渣, 滤液经0.22 μm滤膜过滤,供液相色谱-串联质谱测定。
3 结果与讨论
3.1 红外光谱分析
红外光谱(IR)是提供结构和构象信息的有力工具[26,27]。 对离子液体[SOIM\][PF6\]的红外光谱表征发现,3127和3059 cm-1对应于咪唑环上CH的伸缩振动,2958、2932和2868 cm-1对应于甲基和亚甲基的伸缩振动,1156 cm-1对应于SiC的伸缩振动,1083 cm-1和1023 cm-1对应于SiO的伸缩振动,证明存在硅烷基。
與未修饰的商用硅胶材料相比,制备的离子液体键合硅胶在1570 cm-1处出现了一个弱峰(图2)。因为酰胺基的特征峰处于1500~1600 cm-1之间[28],这说明一些带有CN基团的离子液体与商用硅胶有效的化学键合生成了新的物质。上述结果表明成功制备了功能化离子液体键合硅胶。
3.2 核磁共振谱分析
离子液体[SOIM\][PF6\]核磁共振分析结果如下: 1H-NMR (DMSO, 不含TMS; 400 MHz; δ ppm): 9.16 (s, 1H), 7.78 (m, 2H), 4.15 (m, 4H), 3.47 (m, 9H), 1.85 (m, 4H), 1.25 (m, 10H), 0.86 (t, 3H), 0.54(m, 2H)。其中, 9.16和7.78对应咪唑环上的H的位移, 4.15对应与咪唑环相连的两个亚甲基上H的位移,3.47对应硅烷基上H的位移, 1.85对应与咪唑环相连的第二个亚甲基H的位移,1.25对应辛基取代基上5个亚甲基H的位移,0.86对应辛基取代基上甲基H的位移,0.54对应于与硅烷基相连的亚甲基H的位移。结果表明,成功制备了辛基功能化离子液体。
3.3 元素分析
对修饰前后的硅胶材料进行元素分析,未修饰硅胶中只测得H元素的含量(0.983%),辛基功能化离子液体修饰后,N、C和H元素的质量百分含量分别为2.73%、9.65%和2.07%,说明离子液体成功修饰到硅胶上,并可根据N元素的含量推算出1 g硅球表面有机基团键合量,对应辛基功能化离子液体的键合量为1.95 mmol。
3.4 固相萃取条件优化
采用制备的辛基离子液体键合硅胶Silica-[SOIM\][PF6\]填制固相萃取柱(3 mL,50 mg),用于富集净化水中3种贝类毒素OA、DTX-1和DTX-2。采用空白基质加标方式(0.5 μg/L),对影响萃取效率和回收率的参数进行优化,包括样品预处理条件、样品溶液进样条件、杂质淋洗条件和目标物洗脱条件,每个条件下做6个平行实验。
3.4.1 进样溶液体积的影响 固相萃取填料有载样上限,超负荷进样,会影响目标物的回收率和净化效果。取适量贝类毒素(OA、DTX-1和DTX-2)混合加标浓度为0.5 μg/L的海水进行分析,研究不同进样体积(5、10、20、30和50 mL)对萃取效果的影响(本研究部分均采用2.0 mL纯水淋洗,2.0 mL甲醇洗脱),结果见图3。
根据公式(1)计算富集倍数(EFs):
EFs =Ct/C0 = (nt/Vt)/C0(1)
其中,Ct为最终样品溶液中目标物浓度,C0为初始样品溶液中目标物浓度,nt为目标物最终摩尔量,Vt为最终定容溶液体积。
当最终定容溶液体积Vt和初始样品溶液浓度C0确定后,进样量越大,对应最终摩尔量nt越大,富集倍数越高,方法灵敏度越好。然实验中发现,随着进样体积增大,引入杂质增多,对目标物的干扰增大,且进样速度变缓,50 mL整体进样时间超过0.5 h, 增大了净化难度。综合考虑方法的前处理效率和灵敏度,最终选择进样体积为20 mL。
3.4.2 进样溶液pH值的影响 辛基离子液体键合硅胶Silica-[SOIM\][PF6\]含有阴阳离子基,可能与目标贝类毒素发生疏水作用、离子交换作用和静电作用等多种模式作用。如图4所示,3种贝类毒素的结构中都含有羧基,在不同pH值条件下稳定态不同,可能影响其回收率。分别通过甲酸和氨水调整进样海水pH值,取20 mL海水进样,比较了pH 5.5(5%甲酸)、pH 10.5(5%氨水)、pH 7.0和8.0(常规海水pH值为7.5~8.3)的贝毒加标海水样品(0.5 μg/L)的回收率(均采用2.0 mL纯水淋洗,2.0 mL甲醇洗脱)。结果表明,当进样液pH值为7.0和8.0时,目标贝类毒素的回收率均大于80%(图5),明显高于弱酸(pH 5.5)和弱碱(pH 10.5)条件,说明离子交换作用可能不是Silica-[SOIM\][PF6]型小柱与贝类毒素间的主要作用力。为操作方便和方法的可重复性,海水样品可采取直接萃取富集,不调整pH值的方式。
3.4.3 淋洗溶剂的影响 对复杂基质样品,为排除基质干扰及提高检测灵敏度,洗脱目标物之前需增加淋洗步骤。由于硅胶表面修饰了离子液体,同时检测对象为海水样品,沸点高且盐含量较高,为避免对质谱仪器造成污染,固相萃取过程的第一步淋洗剂采用纯水,可去除大量水溶性干扰物。取20 mL贝类毒素(OA、DTX-1和DTX-2)混合加标浓度为0.5 μg/L的海水进样,分别评价了30%甲醇、纯水和50 mmol/L乙酸铵溶液作为淋洗液的净化效果和回收率(2.0 mL甲醇洗脱)。结果发现,30%甲醇和纯水淋洗时,3种贝类毒素都有不同程度损失,说明离子交换作用可能不是自制Silica-[SOIM\][PF6\]柱与目标贝类毒素间的主要作用力。当使用50 mmol/L乙酸铵作为淋洗液时,目标贝类毒素的回收率最高、損失最小。此外,为确定淋洗液的用量,考察了不同体积(1.0~6.0 mL)淋洗液的效果,当体积小于2.0 mL时,随淋洗液用量增加,洗出液的干扰量逐渐增大; 当淋洗液大于2.0 mL后,不再出现干扰峰。因此,选择2 mL 50 mmol/L乙酸铵作为后续研究的淋洗剂。
3.4.4 洗脱溶剂的影响 如图4所示,3种目标贝类毒素结构中都含有羧基基团,属于弱酸性物质。考虑到Silica-[SOIM\][PF6\]上咪唑基的弱碱性,适当pH值的洗脱溶剂可使辛基离子液体键合硅胶Silica-[SOIM\][PF6\]或目标贝类毒素变为中性,从而可能打破吸附剂与目标分子间的相互作用力。因此,洗脱溶剂pH值可能是影响贝类毒素从Silica-[SOIM\][PF6\]柱上洗脱效果的重要因素。以5% NH4OH-甲醇、2% HAc-甲醇和纯甲醇作为洗脱溶剂进行了初步测试。结果表明(表2),采用纯甲醇洗脱时,3种贝类毒素的回收率均大于85%,推测Silica-[SOIM\][PF6\]材料的保留性能同反相C18小柱相似,与目标贝类毒素间存在疏水作用力; 另外,5% NH4OH-甲醇洗脱不仅能得到无色、澄清的流出液体,而且回收率优于2% HAc-甲醇和纯甲醇,推测Silica-[SOIM\][PF6\]材料与3种贝类毒素间同时存在阴离子交换作用,部分以阴离子状态存在的贝类毒素转化成分子形式被洗脱下来。
因此,选择含有NH4OH的甲醇溶剂洗脱分析物。在此基础上,考察甲醇中NH4OH含量(0%、2%、5%和10%)对回收率的影响。结果表明,NH4OH含量从0增加到5%,3种分析物的回收率迅速增加,当浓度进一步增加
[FQ(72。242,Y-WZ][HT5”SS][HJ*4]表2 不同洗脱溶剂对贝类毒素各组分回收率的影响到10%时,回收率增大幅度变慢。因此,选择5% NH4OH-甲醇作为洗脱溶剂。对洗脱剂体积进行了优化,结果表明, 3 mL 5% NH4OH-甲醇即可充分洗脱分析物,过量会延长氮吹浓缩时间。因此,选择洗脱体积为3 mL。
3.5 与商用萃取柱比较
贝类毒素的相关研究多采用HLB柱、C18柱等净化材料。本研究通过空白海水加标方式(0.50 μg/L),分别对比了最优条件下自制离子液体键合硅胶柱(Silica-[SOIM\][PF6\])和两种商用化固相萃取柱(HLB柱和C18柱(3 mL,60 mg))的净化效果和回收率。加标海水进样体积均为20 mL。两种商用固相萃取小柱预先用5 mL甲醇和5 mL水活化,进样后用2 mL水淋洗、2 mL甲醇洗脱。相应条
件下做6个平行,回收率见表3。结果表明,自制离子液体键合硅胶柱回收效果与商用HLB柱相当,均优于C18柱。自制的离子液体键合硅胶柱(Silica-[SOIM\][PF6\])与商用C18柱相比,不仅具有辛基疏水基团,与目标物间还可能存在离子交换作用等多种混合作用力,萃取效果明显改善。同时,自制小柱填料量(3 mL,50 mg)少于商用HLB柱(3 mL,60 mg),说明其萃取性能与同时具有亲脂亲水性能的HLB柱相当。
3.6 方法评价
3.6.1 方法的检出限及定量限 取0.02~2.50 μg/L的混合贝类毒素海水进样,以色谱峰面积与贝毒混合标准溶液浓度绘制校正曲线,3种贝类毒素线性相关方程分别为: OA, y=-2.96676+2944.44x (R2=0.9969); DTX-2, y=622.875+904.353x (R2=0.9995); DTX-1: y=20.3688+2463.97x (R2=0.9997)。 3种贝毒的检出限(LOD, S/N>3)为0.01 μg/L,定量限(LOQ, S/N>10)为0.05 μg/L,表明制备的离子液体键合硅胶具有较好的萃取效果。
3.6.2 方法的精密度及萃取材料的重现性 在优化条件下,通过贝类毒素加标水样(0.50 μg/L),考察方法的日内(n=5)和日间(n=3)精密度。在不同时间,测得3种贝类毒素的RSD在2.8%~12.3%之间,表明此方法精密度较好。对同一批次和不同批次制备材料的萃取效果进行重现性评价,同一批次萃取材料(n=5)在同一时间对3种贝类毒素的RSD在 3.8%~9.5%之间,不同批次萃取材料(n=3)在同一时间测得结果RSD为6.2%~11.6%,说明此萃取材料的制备重现性良好。
3.7 实际应用
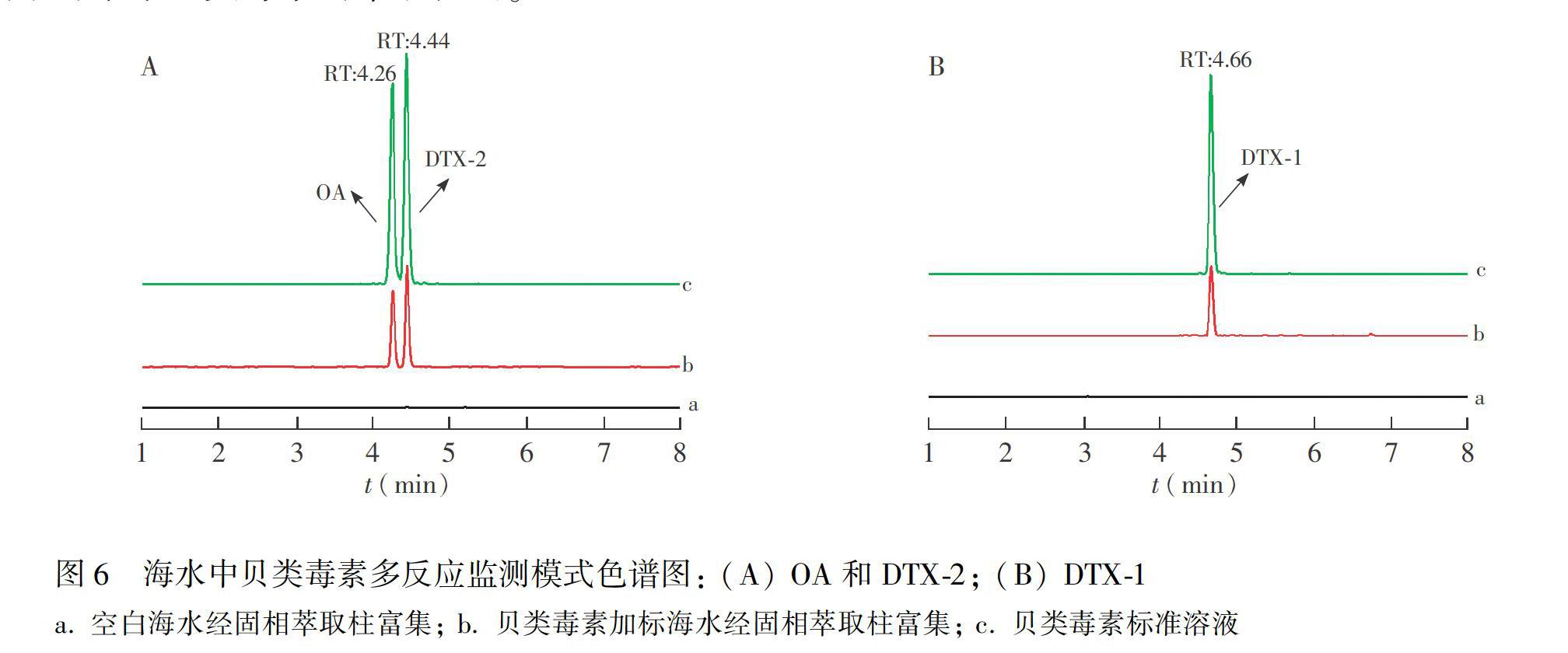
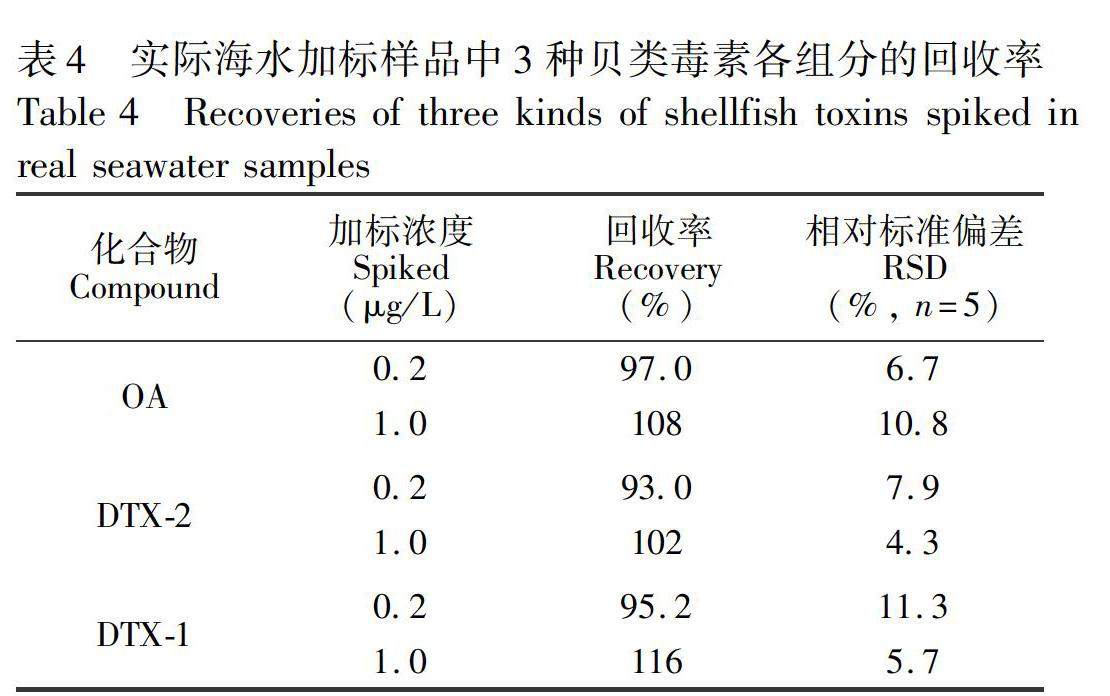
参照本研究2.2和2.6节的仪器检测方法和样品处理方法,按最优的萃取方法对取自青岛沙子口的海水样品进行处理,如图6A所示,海水样品中不含贝类毒素。为评价方法的富集净化效果,以此样品作为空白样品,添加两个浓度水平(0.2和1.0 μg/L)的贝类毒素,测定方法的回收率。贝类毒素加标海水样品的多反应监测(MRM)图见图6B,经离子液体键合硅胶柱处理后,贝类毒素得到了有效富集净化,根据公式(1)计算富集倍数约为40。如表4所示, 3种贝类毒素的加标回收率在93.0%~116.0%之间,RSD均小于12%。结果表明,自制离子液体键合硅胶固相萃取材料及相关前处理方法适用于海水中贝类毒素的萃取检测。
4 结 论
制备了一种混合模式辛基功能化离子液体共价键合硅胶萃取材料,并应用于海水中贝类毒素的萃取分析。研究表明, 此固相萃取材料可能通过疏水作用、离子交换作用等多种模式与目标贝类毒素(OA、DTX-1和DTX-2)作用,结合液相色谱-串联质谱,对海水中3种贝类毒素的检测显示了良好的灵敏度和准确性。优化的萃取条件为:进样20 mL海水,用2 mL 50 mmol/L乙酸铵溶液淋洗、3 mL 5 % NH4OH-甲醇洗脱。结果表明,本方法的萃取效果优于商用C18柱,与HLB柱性能相当,表明本方法是一种测定海水中贝类毒素含量的可行的替代方法。同时,此離子液体功能化硅胶材料具有良好的重现性,可通过淋洗再生,反复使用,降低了检测成本。另外,可灵活设计制备具有多个不同基团的离子液体,通过键合硅胶作为功能化萃取材料,实现对环境和食品不同基质中污染物的富集净化,具有良好的应用前景。
References
1 Harwood D T, Selwood A I, Ginkel R V. Toxicon, 2014, 90: 213-225
2 Pérez-Gómez A, Ferrero-Gutierrez A, Novelli A. Toxicol. Sci, 2006, 90(1): 168-177
3 Sheppeck J E, Gauss C M, Chamberlin A R. Bioorg. Med. Chem., 1997, 5(9): 1739-1750
4 Valdiglesias V, Méndez J, Pásaro E, Cemeli E, Anderson D, Laffon B. Mutat. Res., 2010, 689(1-2): 74-79
5 Dominguez H J, Paz B, Daranas A H, Norte M, Franco J M, Fernández J J. Toxicon, 2010, 56: 191-217
6 Cho Y, Ozeki R, Yotsu-Yamashita M. Harmful Algae, 2013, 25: 47-53
7 Cho Y, Tsuchiya S, Yoshioka R. Harmful Algae, 2015, 49: 58-67
8 Mattarozzi M, Milioli M, Bianchi F, Cavazza A, Pigozzi S, Milandri A, Careri M. Food Control, 2016, 60: 138-145
9 YAO Jian-Hua, TAN Zhi-Jun, ZHOU De-Qing. Chinese J. Anal. Chem., 2010, 38(12): 1714-1720
姚建華, 谭志军, 周德庆. 分析化学, 2010, 38(12): 1714-1720
10 YAO Jian-Hua, TAN Zhi-Jun, ZHOU De-Qing, GUO Meng-Meng, XING Li-Hong, YANG Shou-Guo. Chinese Journal of Chromatography, 2010, 28(4): 363-367
姚建华, 谭志军, 周德庆, 郭萌萌, 邢丽红, 杨守国. 色谱, 2010, 28(4): 363-367
11 YANG Xiao, HUANG Hua-Wei,WU Yuan-An,WAN Yi-Wen, LI Xiao-Ling, HUANG Xiang-Rong. Chinese Journal of Chromatography, 2019, 37(5): 505-511
杨 霄, 黄华伟, 伍远安, 万译文, 李小玲, 黄向荣. 色谱, 2019, 37(5): 505-511
12 Berre M L, Kilcoyne M, Kane M. Toxicon, 2015, 103: 169-175
13 GB 5009. 212-2016, Detection of Diarrhetic Shellfish Poisoning in Shellfish. National Standards of the People's Republic of China
食品安全国家标准贝类中腹泻性贝类毒素的测定. 中华人民共和国国家标准. GB 5009. 212-2016
14 Poole C F. J. Chromatogr. A, 2004, 1037(1-2): 49-82
15 Sun X J, Tan J, Ding H Y, Tan X J, Xing J, Xing L H, Zhai Y X, Li Z X. J. Anal. Methods Chem.,2018: 3765682
16 Liu S J, Zhou F, Zhao L, Xiao X H, Liu X, Jiang S X. Chem. Lett., 2004, 33(5): 496-497
17 Qiu H D, Jiang S X, Liu X. J. Chromatogr. A, 2006, 1103(2): 265-270
18 Wang Q, Baker G A, Baker S N. Analyst, 2006, 131(11): 1000-1005
19 Sun X J, Zhu Y L, Wang P, Li J, Wu C Y, Xing J. J. Chromatogr. A, 2011, 1218(6): 833-841
20 Sun X J, Wu C Y, Xing J. J. Sep. Sci., 2010, 33(20): 3159-3167
21 Qin W D, Li S F Y. Electrophoresis, 2002, 23(24): 4110-4116
22 Qin W D, Li S F Y. J. Chromatogr. A, 2004, 1048(2): 253-256
23 Tian M L, Yan H Y, Row K H. J. Chromatogr. B, 2009, 877(8/9): 738-742
24 Qiu H D, Jiang Q, Wei Z, Wang X S, Liu X, Jiang S X. J. Chromatogr. A, 2007, 1163(1-2): 63-69
25 Qiu H D, Jiang S X, Liu X. J. Chromatogr. A, 2006, 1103(2): 265-270
26 Gremlich H, Yan B. Infrared and Raman Spectroscopy of Biological Materials. New York: Marcel Dekker Press, 2000: 1
27 ZHU Nan-Nan, SUN Zhi-Rong, QU Ji-Xu,HE Yu-Xin, MA Fang, SUN Su-Qin. Spectroscopy and Spectral Analysis, 2018, 38(11): 3407-3413
朱南南, 孙志蓉, 曲继旭, 贺雨馨, 马 芳, 孙素琴. 光谱学与光谱分析, 2018, 38(11): 3407-3413
28 Kilimann K, Doster W, Vogel R, Hartmann C, Gnzle M. Biochim. Biophys. Acta, 2006, 1764(7): 1188-1197
Abstract Shellfish toxins are a kind of important marine pollutant. In this study, a novel ionic liquid bonded silica gel material (silica-[SOIM\][PF6\]) was prepared by grafting octyl-functionalized ionic liquid onto silica gel, which was characterized and analyzed by infrared spectroscopy (IR), nuclear magnetic resonance (NMR), and elemental analysis. Solid phase extraction cartridge of silica-[SOIM\][PF6\], coupled with LC-MS/MS technique was used to extract and determine the concentration of shellfish toxins [Okadaic acid (OA), Dinophysistoxin-1 (DTX-1) and Dinophysistoxin-2 (DTX-2)\] in seawater for the first time. It was found that the solid phase extraction material silica-[SOIM\][PF6\] had multiple interactions with the 3 kinds of shellfish toxins, such as hydrophobic and ion-exchange. The method was optimized in aspects of volume and pH of the loaded sample solution, as well as the usage of rinsing and eluting reagents. Results indicated that the silica-[SOIM\][PF6\] had good extraction effect on target shellfish toxins in seawater, which was better than or equivalent to the performance of commercial extraction materials. The method had a good linearity (R2>0.995) in the concentration range of shellfish toxins from 0.02 μg/L to 2.50 μg/L, with limit of detection (LOD) of 0.01 μg/L and limit of quantification (LOQ) of 0.05 μg/L. The average recoveries for 3 kinds of shellfish toxins were 93.0%-116.0% at different spiking levels in blank seawater. Simultaneously, the material had good reproducibility, with the relative standard deviation (RSD) of less than 15% intra- and inter-batch. This method was accurate, sensitive, simple and reliable, and could be used for the extraction and detection of shellfish toxins in actual samples.
Keywords Ionic liquid; Solid phase extraction; Multiple mode; Shellfish toxins; Seawater
