基于UF、GFC及RP-HPLC的长牡蛎(Crassostrea gigas)蛋白抗衰老小分子活性肽(Zel'ner)的纯化及结构解析*
2020-02-06何定芬梁瑞萍李海波
何定芬 谢 超 梁 佳 梁瑞萍 李海波
(1.浙江国际海运职业技术学院 舟山 316021;2.浙江海洋大学食品与医药学院 舟山 316022)
随着社会的发展,海洋生物已被认为是具有重要营养和药用价值的生物活性化合物的丰富来源。牡蛎是世界养殖第一大贝类,也是中国养殖最大的贝类(阙华勇等,2003;于文超等,2015),因富有极高的营养,被誉为“海底牛奶”(陈艳辉等,2011)。牡蛎含有钙、磷、锌和维生素等营养物质,高蛋白,低脂肪(董晓伟等,2004;叶盛权等,2009;刘慧等,2012;邱娟等,2017),具有避免过度疲劳、改善身体机能等功能(汪何雅等,2003),是我国第一批被列为药食同源的食品之一。
近年来,海洋生物活性肽引起了人们的广泛关注,其具有多种生物学特性,例如抗氧化、抗高血压、抗人类免疫缺陷病毒、抗增殖、抗凝血、抗肥胖、抗糖尿病活性等(姜红,2008),对人体健康有许多有利的影响。相比于蛋白质,小分子肽具有分子量小、结构简单、毒副作用小且易被机体吸收等优点(庞婉婷等,2018),相比大分子量的多肽活性更强,能够直接作用于人体细胞且效果十分迅速(范秀萍等,2008)。但是,目前我国对牡蛎的深加工能力还十分欠缺,而研究小分子肽产品可以使牡蛎的营养和价值得到高效利用,因此,牡蛎小分子肽的研究有着非常大的市场前景和社会意义。
罗齐军等(2013)发现补充牡蛎多肽可以改善长期大负荷训练导致的低血糖。牡蛎肽可在一定程度上增强小鼠免疫功能(陈晓文等,2016),牡蛎水解产物对小鼠有抗肿瘤活性和免疫作用(Wanget al,2010)。尽管有关牡蛎肽的加工国内外已有不少报道(Zhanget al,2009;Lauet al,2013;Zhanget al,2017),但是有关牡蛎小分子肽的情况却研究甚少。本研究通过对牡蛎小分子肽分离纯化,得到牡蛎天然肽,并对其分子量和氨基酸成分进行了分析,提高了牡蛎的综合利用,为牡蛎的加工提供了新的方向和思路。
1 材料与方法
1.1 原料与试剂
牡蛎购于舟山常青海洋食品有限公司,采用低温碎冰保鲜运送方式30min内送至实验室,于-80°C下保藏;DPPH梯希爱(上海)化成工业发展有限公司;胰岛素等标准品,美国Sigma公司;氨基酸标准品,北京普天同创生物科技有限公司。
1.2 主要仪器和设备
紫外检测器HD-21-2,北京京普科技有限公司;高效液相色谱仪1100,上海硅仪生化科技有限公司;氨基酸分析系统LC98-I AAA,北京温分公司。
1.3 方法
1.3.1 牡蛎蛋白水解液制备 在风味蛋白酶酶添加量1.3%、pH 7、酶解5h条件下进行酶解,煮沸12—15min灭酶,8000—9600r/min离心 30—45min,滤液即为水解液。
1.3.2 硫酸铵分级沉淀 向水解液中加入硫酸铵粉末,使之饱和度分别达到30%、70%和100%,分别得到沉淀a、b、c,再分别过0.2—0.25μm微孔滤膜得到各个组分的蛋白。
1.3.3 超滤(UF)膜分子量分级 收集水解液,稀释后分别通过截留分子量1kDa、3kDa的超滤膜,收集两组牡蛎小分子蛋白肽,组分a:Mw<1kDa;组分b:1kDa<Mw<3kDa。
1.3.4 凝胶过滤层析(GFC)取2g冻干水解液样品悬液和2mL 0.05mol/L PBS,pH 7.0,然后离心1500r/min 20min。将透明上清液涂于Sephadex G-15柱(1.6cm×80cm),用0.01mol/L PBS按流速0.3mL/min洗脱通过测定,得到洗脱曲线,用紫外分光光度计在230nm和280nm处测定吸光度。表现出清除羟基自由基活性的组分收集并冻干得到粉末。利用反相高效液相色谱,以乙腈为有机改性剂(丛艳君等,2017),在线性梯度洗脱条件下进行分离;色谱柱:Kromasil ODS柱;流动相:洗脱液A(0.1%三氟乙酸),洗脱液B(90.4%乙腈和0.1%三氟乙酸)。
1.3.5 反相高效液相色谱(RP-HPLC)确定牡蛎蛋白小分子肽的分子量 选用胰岛素标准品配置0.2mg/mL标准溶液,测定分子量分布范围。凝胶色谱柱:TSK gel 2000 PWXL(7.8mm×300mm);流动相:含 0.1%的三氟乙酸的乙腈水溶液(1:1);流速:0.5mL/min;柱温:室温;检测波长220nm;进样量:10μL。组分a对照品色谱条件同上,进样量设置为50μL(黄丹丹等,2017)。
1.3.6 DPPH自由基清除能力的测定 取1mL H2O和样品分别加入250μL浓度为0.02%DPPH,99.5%乙醇和1mL乙醇作为空白组和实验组,取1mL样品加入250μL乙醇和1mL乙醇作为对照组,避光放置6min,于517nm处测吸光度。DPPH清除率计算公式如下:

式中:A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度(邱军强等,2017)。
1.3.7 样品溶液配制 根据北京温分公司LC98-I AAA氨基酸分析系统标准配置标准溶液。取样品粉末100mg,加6mol/L盐酸4mL,充入氮气,于110°C下反应22—24h,拿出后放置至室温;参考李智等(2017)的方法进行酸水解;参考于文清等(2014)的方法在35°C的电热恒温鼓风干燥箱中进行衍生反应,所得样品作为牡蛎小分子肽样品溶液。
1.3.8 牡蛎小分子肽氨基酸的成分测定 采用北京温分公司LC98-I AAA氨基酸分析系统,准确量取对照品、样品溶液60μL完成进样,每次实验做两次平行,得到牡蛎小分子多肽的色谱图。
1.4 数据统计分析
采用Excel 2007对数据进行制图。
2 结果与分析
2.1 牡蛎酶解液蛋白沉淀结果
盐析可以从酶解液中沉淀分离目标蛋白质,为进一步分离牡蛎蛋白小分子肽做准备(袁梦媛,2016)。将沉淀的固体用去离子水复溶后发现,浓度为30%—100%的硫酸铵处理后的分离效果明显优于低于30%硫酸铵的分离效果。将牡蛎蛋白沉淀复溶后,稀释样品浓度约为1.0mg/mL,DPPH自由基清除能力的测定结果如表1,硫酸铵浓度30%—100%综合的DPPH自由基清除率达52.43%,而且DPPH自由基清除率较高,说明此时的蛋白具有高生物活性(韦献雅等,2014),可进一步对其进行分离纯化。

表1 硫酸铵分级沉淀牡蛎蛋白结果Tab.1 Ammonium sulfate fractional precipitation of oyster protein results
2.2 牡蛎两组小分子蛋白肽的凝胶过滤层析(GFC)
实验通过葡聚糖凝胶SephadexG-50对两组牡蛎小分子肽组分进行凝胶过滤层析,如图1中分别为组分a、组分b的洗脱曲线。由图1可知,洗脱曲线都出现两种明显的峰,前者是盐等杂质被洗脱出来,后者是多肽被洗脱出来。分光光度计测量吸光值,收集两个组分的多肽,然后冷冻干燥,即得到纯化后的两种牡蛎天然肽:组分a(Mw<1kDa)、组分 b(1kDa<Mw<3kDa)。

图1 牡蛎两组小分子肽的洗脱曲线Fig.1 Elution curves of two groups of small molecular peptides in oyster
2.3 牡蛎两组小分子肽的分子量分布
采用RP-HPLC来估计牡蛎酶解多肽组分a的分子量分布情况,结果如图2,通过各标准品对应的出峰时间绘制标准曲线,可知标准品的分子量对数与出峰时间呈良好的线性关系,线性相关系数为0.9958,拟合程度较好,线性回归方程为:y=-0.1469x+6.1883。

图2 标准对照品分子量分布标准曲线Fig.2 Standard curve of molecular weight distribution of standard reference material
图3和图4分别为胰岛素对照品和组分a的RP-HPLC图谱,可知主要有4种物质组成牡蛎小分子多肽组分a中的蛋白,这四个峰出峰时间分别为18.708、19.857、20.552、23.591min,其中出峰时间为18.708min的峰为主要峰,说明该组分中分离提纯的牡蛎小分子肽纯度较高,具有研究价值。结合标准曲线计算,组分a中的牡蛎酶解液中小分子肽分子量分布约为 1995.2、1258.9、1023.3、398.1Da。因此,可以看出分离的活性多肽分子量较小,而小分子肽在各方面存在广泛的应用(Gaoet al,2010;马国兴等,2015;庞秀枰等,2015),此研究为更深层次探讨牡蛎多肽的组成提供研究依据,为探究牡蛎小分子肽的营养组分做准备。
2.4 牡蛎小分子肽氨基酸图谱分析
如图5和图6所示,分别为18种混合氨基酸对照品图谱和牡蛎小分子肽样品氨基酸图谱。经单一对照品预实验可知,18种氨基酸出峰顺序分别为:天门冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、甘氨酸(Gly)、组氨酸(His)、苏氨酸(Thr)、丙氨酸(Ala)、精氨酸(Arg)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、胱氨酸(Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)、赖氨酸(Lys)。对应的出峰时间分别为:3.232、3.290、10.698、12.273、15.898、16.973、17.757、18.023、18.365、24.373、25.390、26.832、28.932、29.448、29.832、32.332、33.340min。
2.5 牡蛎小分子肽氨基酸含量
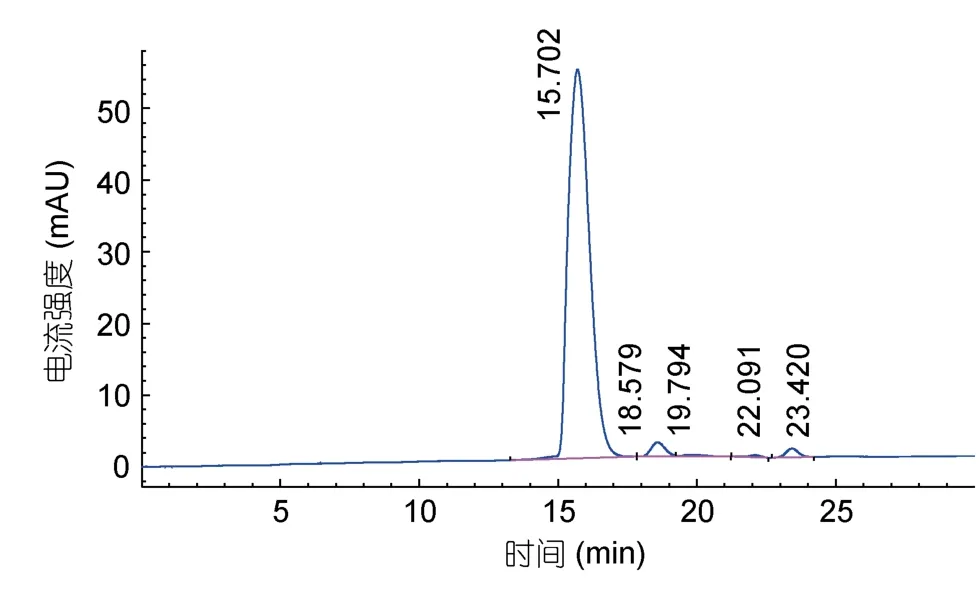
图3 胰岛素对照品的HPLC图谱Fig.3 HPLC spectrum of insulin reference substance
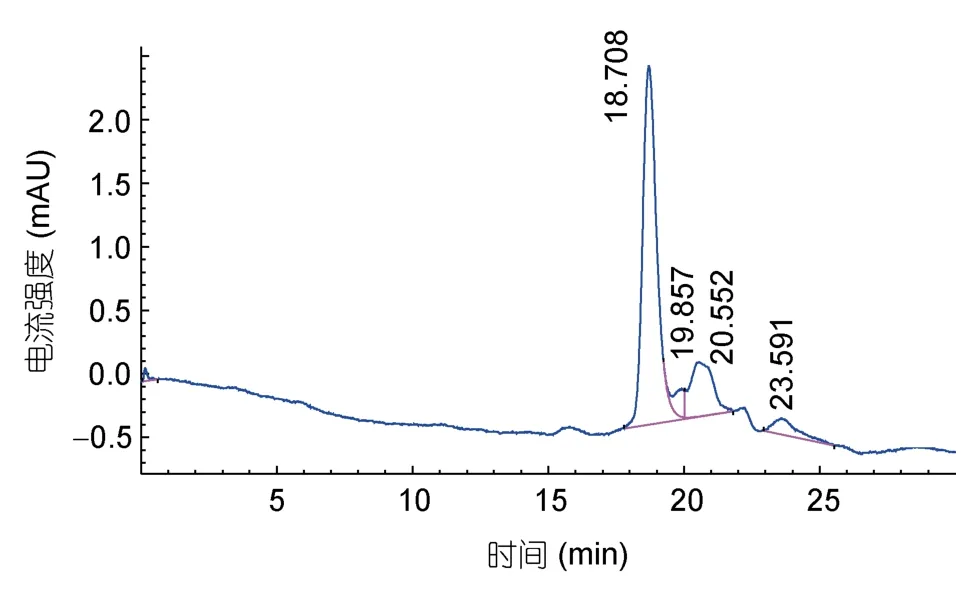
图4 牡蛎小分子组分a的HPLC图谱Fig.4 HPLC spectrum of micromolecule component a in oyster
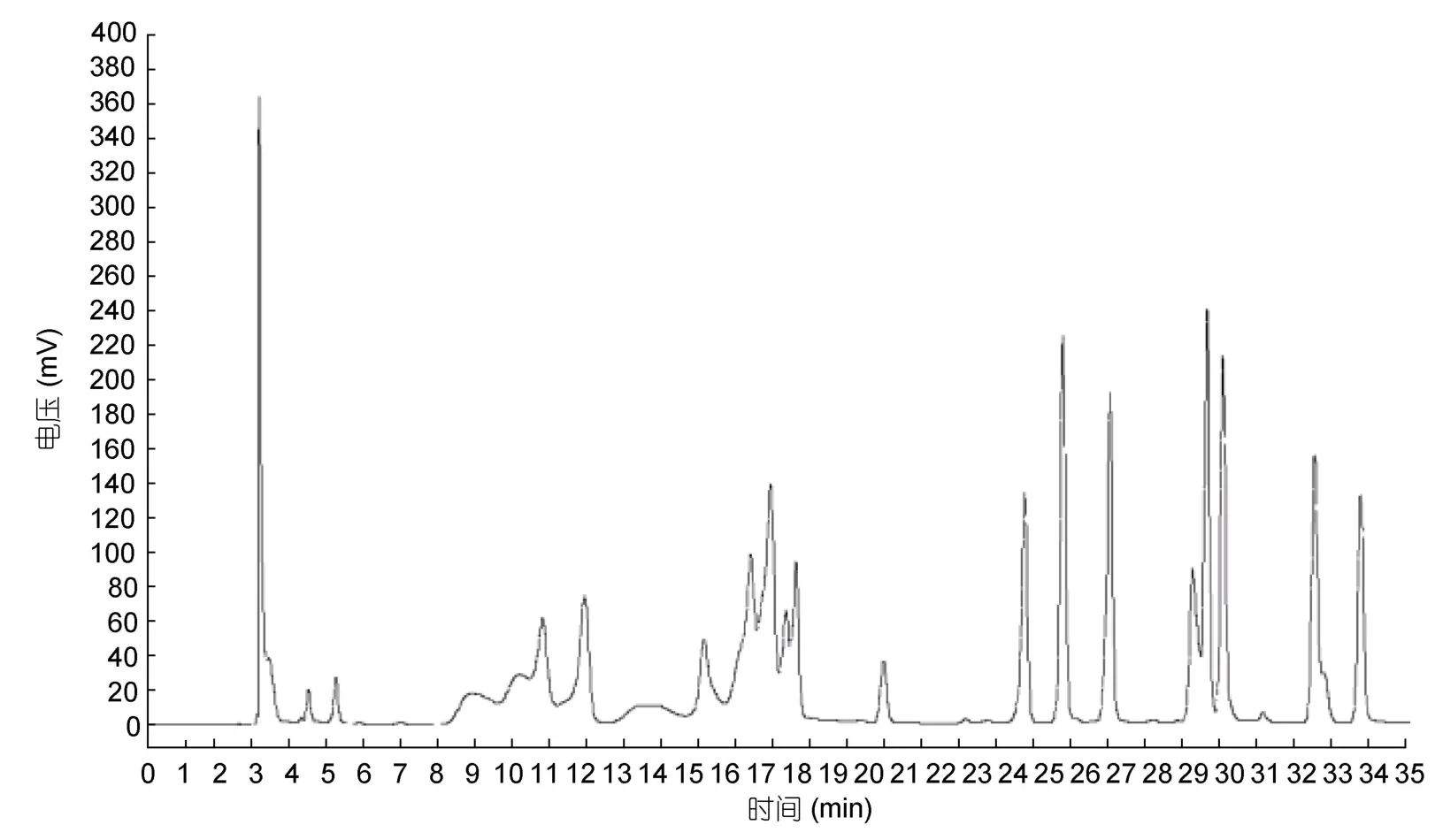
图5 18种混合氨基酸对照品图谱Fig.5 Diagram of 18 mixed amino acid reference substances
氨基酸的检测结果见表2,样品中能够检测到17种氨基酸,其中胱氨酸检测值为0。由表2可知,牡蛎小分子肽中含量最多的氨基酸是谷氨酸6.1632%,其次是赖氨酸5.2110%,说明经酶解提取的牡蛎小分子肽中氨基酸含量丰富。检测到8种必需氨基酸均存在,其余为9种非必需氨基酸。牡蛎小分子肽样品中均含有丰富的赖氨酸(5.2110%)、谷氨酸(6.1632%)、甘氨酸(3.0640%)、精氨酸(1.3473%)和酪氨酸(0.9171%),这些氨基酸有助于维持蛋白质的营养平衡,调节氨基酸的吸收。
牡蛎的营养价值与必需氨基酸的含量以及氨基酸的种类有密切的关联,由表3可知,牡蛎小分子多肽必需氨基酸(EAA)含量为18.863%,总氨基酸(TAA)含量为43.3748%,必需氨基酸占总氨基酸的43.49%,必需氨基酸与非必需氨基酸(NEAA)的比例为76.95%;风味氨基酸(FAA)含量为18.9147%,占总氨基酸含量43.61%。由此可知,将牡蛎蛋白质提纯或酶解成小分子多肽后,营养成分丰富,富含多种氨基酸种类,可作为营养强化剂添加到婴儿食品、保健食品或饲料中(刘娜等,2016;张元可等,2019),补充营养从而改善体质。
3 结论
通过对牡蛎蛋白酶解液进行分离纯化,发现浓度为30%—100%的硫酸铵处理后的分离效果明显优于低于30%硫酸铵的分离效果,其DPPH自由基清除率达52.43%;得到纯化后的两种牡蛎天然肽:组分a(Mw<1kDa)、组分b(1kDa<Mw<3kDa)。采用高效液相法分析组分a的分子量组成,结果表明主要有4种物质组成牡蛎小分子多肽组分a中的蛋白,这四种物质对应峰出峰时间分别是 18.708、19.857、20.552、23.591min,其中出峰时间为18.708min的峰为主要峰,说明该组分中分离提纯的牡蛎小分子肽纯度较高,具有研究价值。其中小分子肽分子量分布约为 1995.2、1258.9、1023.3、398.1Da。
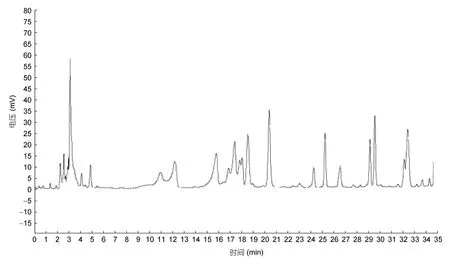
图6 牡蛎小分子肽样品氨基酸图谱Fig.6 Graph of amino acid of oyster small-molecule peptide sample

表2 氨基酸分子量、浓度及峰面积Tab.2 Molecular weight,concentration and peak area of amino acids

表3 牡蛎小分子多肽各种类氨基酸占比情况Tab.3 Proportions of various amino acids in oyster small-molecule polypeptides
经检测发现牡蛎小分子多肽氨基酸种类及含量丰富,其中必需氨基酸(EAA)含量为18.863%,总氨基酸含量(TAA)为43.3748%,必需氨基酸占总氨基酸的43.49%,必需氨基酸与非必需氨基酸(NEAA)的比例为76.95%;风味氨基酸(FAA)含量为18.9147%,占总氨基酸含量的43.61%。随着生活水平的提高,食品越来越追求安全、营养和功能,牡蛎小分子肽在食品中将得到更广泛的应用。
