三亚蜈支洲岛珊瑚礁-沙质底复合区棘皮动物群落结构*
2020-02-06黄端杰李秀保薛英楼吴沛霖
黄端杰 许 强 李秀保 薛英楼 吴沛霖 高 菲
(南海海洋资源利用国家重点实验室 海南大学海洋学院 海口 570228)
我国南海的珊瑚礁生态系统是生物资源宝库,同时也蕴藏着丰富的底栖棘皮动物资源。大型底栖动物与珊瑚礁之间存在密切的相互依存关系,如以棘皮动物为代表的底栖动物群落能够反映珊瑚礁生态系统的健康状况,其生物多样性对珊瑚礁的稳定和功能具有重要的意义(朱文涛等,2018)。研究表明,珊瑚礁生态系统的健康程度与栖息在礁内生物的多样性呈正相关关系。李元超等(2015)通过调查三亚后海海域珊瑚礁健康状况后分析得出,珊瑚礁区高密度的植食性动物是该区域珊瑚礁生态系统保持健康的主要原因之一,珊瑚礁区海胆通过摄食珊瑚礁上附着的藻类,确保珊瑚能够正常生长。因此,礁区生物多样性是反映珊瑚礁生态系统变化的重要指征之一(Vázquez-Domínguez,2003;Langmeadet al,2004)。
棘皮动物作为大型底栖动物的重要类群,在维护和调节珊瑚礁底栖生态系统中起着不可或缺的作用(廖玉麟等,2011)。以珊瑚礁生态系统里的海参纲和海胆纲为例,海参纲多以海底沉积物为食,净化海底同时促进营养盐循环,珊瑚礁内海参(玉足海参和花刺参)通过肠道消化含有碳酸盐的沙子和碎石,在摄入食物同时溶解碳酸钙增加珊瑚礁碱度,防止海水酸化,有利于珊瑚礁的生长(Schneideret al,2011)。海胆在珊瑚礁生态系统中扮演着极其关键的角色,海胆以藻类为食,可以抑制大型藻类的过度生长,避免其争夺珊瑚正常的生长空间(Tuyaet al,2005)。因此,珊瑚礁内棘皮动物群落生物多样性调查和生态学分析可以作为指示礁区健康监控手段之一。
海南三亚海域拥有中国大陆发育最好的岸礁型珊瑚礁区域,与此同时,也频繁受到人为活动影响,因此是研究人类活动-珊瑚礁生态系统健康相关关系的绝佳区域。位于海棠湾蜈支洲岛的珊瑚礁区在三亚蜈支洲岛旅游区(5A级)的综合管理下,通过采取严格的资源环境管护措施,使得岛礁周边的珊瑚生态系统得以有效保护,因此成为海南省珊瑚礁分布的代表区域之一。在2011年对海南岛东、南部珊瑚礁生态健康初步调查中,发现蜈支洲岛活珊瑚种类数量仅次于鹿回头,且盖度分布最高(吴瑞等,2013)。近几年,国内对三亚海域珊瑚群落现状的研究较多,但反映珊瑚礁健康情况的底栖生物群落研究较为匮乏。本文拟选择蜈支洲岛珊瑚礁代表区域,调查研究棘皮动物群落多样性现状及其季节变化,评估其群落健康状况,进一步为该区域珊瑚礁生态系统健康状况评价提供参考数据。
1 材料与方法
1.1 研究区域概况
蜈支洲岛位于三亚东南侧海棠湾内,是典型的近岸热带岛礁(图1)。岛东西两端相距1500m,南北两端相距1100m,全岛总面积为1.48km2。海岸至水深4—5m处的底质类型主要由珊瑚生长发育形成的岩礁、5—10m主要为活珊瑚生长地带,海底沉积物类型有基岩、珊瑚礁→粗砂→细砂→中砂混合→中细砂→细砂→粉砂,逐渐变细。岛北岸西部沙滩由主要泥沙落淤形成,西北侧还形成了沙咀(颜慧慧,2017)。
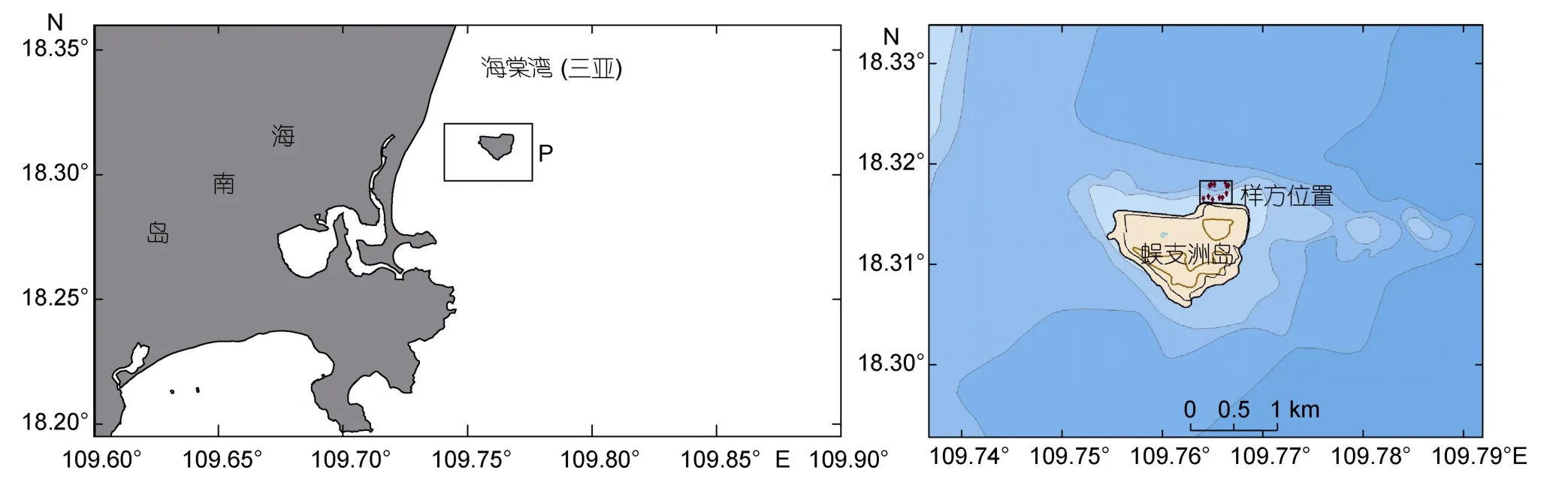
图1 蜈支洲岛海域棘皮动物调查范围图Fig.1 The investigation area of echinoderms in Wuzhizhou Island
在前期的底栖生境调查中发现,蜈支洲岛东南侧近岸海域为活珊瑚礁-岩礁底质复合区,海底地形陡峭,10m以浅水域狭窄;岛西南侧以沙质底为主,珊瑚覆盖度较低;而岛北侧近岸海域为活珊瑚礁块-沙质底复合分布区,海底平缓,在该处分布的棘皮动物栖息密度(特别是海参类)远较其它区域高。同时,岛北侧靠近游艇码头,为旅游潜水地点,人为活动频繁,因此本文选择岛北侧活珊瑚礁块-沙质底复合分布区作为重点研究区域。
1.2 调查方法与内容
1.2.1 调查时间 2018—2019年共进行了四个季度月调查,分别为2018年8月、2018年11月、2019年1月和2019年4月。
1.2.2 水质因子调查 利用多参数水质测试仪(美国,YSI-650)对调查区域表层水体(水下1m)进行基本水质理化因子监测,指标包括温度、盐度、pH和溶解氧。
1.2.3 棘皮动物群落调查方法 棘皮动物群落调查采用随机样带结合视频定量调查法。具体操作如下:
(1)随机样带设置
在研究区域(18°19.000′—18°19.067′N,109°45.890′—109°46.009′E,图)内利用手持式测深仪测量水深,分别在浅水区(3—5m)和深水区(8—10m)用绳子随机布置3条100m样带,样带两侧各1m为视频拍摄定量范围,最终构成100m×2m(200m2)的样方,作为资源密度的统计基准。
(2)视频拍摄方法
潜水员手持水下高清摄像机(GoPro 5,美国)沿样带拍摄,分辨率为2.7kp,帧速为60帧/秒,拍摄时潜水员的平均游泳速度为0.17m/s。拍摄视频的截图清晰,能够满足水下棘皮动物种类鉴定的要求。
(3)种类鉴定
由于采用视频拍摄数据和单一种类水下照片进行种类鉴定,本研究中仅将形态特征显著的常见棘皮动物种类纳入统计范围。代表性种类特征图片和特征描述参考《中国动物图谱:棘皮动物》(张凤瀛,1964)和《中国动物志:棘皮动物门 海参纲》(廖玉麟,1997),分类采用Pawson et Fell(1965)的分类系统。
1.3 数据处理
利用Excel将各季节和不同水深的棘皮动物数量换算为单位面积的栖息密度(ind./10m2)。
生物多样性指数(物种丰富度指数、多样性指数、均匀度指数)和优势度的计算方法分别采用牛翠娟等(2015)和董栋等(2015)。
a.优势度(Y)

式中,fi为第i个种在各样方中出现频率,ni为群落中第i个种在空间中的个体数量,N为群落中所有种的个体数总和。
b.栖息密度ρ

式中,ρ为棘皮动物栖息密度,N为所有样方中棘皮动物的数量,S为所有样方面积,单位为ind./10m2。
1.4 统计分析
采用数据分析软件SPSS(PASW Statistics 18,美国)进行数据分析,分别对4个季节的水质因子,浅水区和深水区棘皮动物栖息密度进行单因素方差分析(ONE-WAYANOVA),检验不同季节水环境指标,浅水区和深水区栖息密度的差异,显著性水平设置为0.05。
2 结果
2.1 蜈支洲岛北海域水质特征
在2018—2019年4次监测中,冬季水温最低,为23.72°C,夏季水温最高,为27.39°C。全年盐度相差不大,变化范围为31.54—33.77。溶解氧为5.16—5.49mg/L,春季最高,冬季最低。pH为7.61—8.40,最低为春季,最高为冬季。
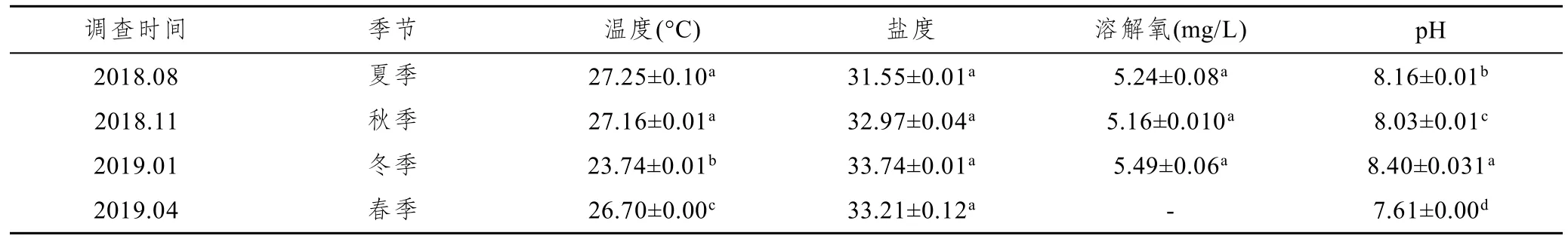
表1 调查期间基本水文特征Tab.1 Basic hydrological characteristics during the investigation period
2.2 棘皮动物种类组成
在为期一年的调查中,共发现棘皮动物15种,隶属于4纲10科:海参纲有6种,占总数的40%;海星纲有5种,占34%;海胆纲2种,占13%;海百合纲2种,占13%。在不同季节调查中,春季发现棘皮动物种类最多,有13种。周年调查中均以海参纲占优势(表2)。
不同深度调查中,夏季浅水区分布的棘皮动物种类多于深水区,而秋季和冬季深水区高于浅水区。两个深度分布的种类大致相同,海参纲均占优势。周年调查中,两个水深共有的种类是红腹海参、黑海参、吕宋棘海星、刺冠海胆和许氏大羽花。对比之下,绿刺参未在冬季浅水区发现,本氏海齿花未在秋季浅水区发现,这2种在其他季节和深度均有分布。玉足海参未在秋冬季节浅水区发现,黄疣海参未在春秋两季深水区发现,这2种在其他季节和深度均有分布。面包海星仅在春冬两季深水区发现,多筛指海星仅发现于夏季浅水区和秋季深水区。斑锚参仅发现在春季浅水区,长棘海星仅发现于夏季浅水区(表3)。
2.3 不同纲棘皮动物分布密度的季节与深度变化
棘皮动物栖息密度季节变动情况整体呈现出春夏高,秋冬低的特点。不同纲的棘皮动物栖息密度在春夏两个季节呈现出升高趋势,到了秋冬季节呈现下降趋势。全年棘皮动物平均栖息密度变化较大,以冬季最低,仅为3.9ind./10m2;夏季最高,为10ind./10m2;春季稍低于夏季,为9.2ind./10m2;秋季为7.7ind./10m2(表4)。
总体上,深水区分布的棘皮动物栖息密度高于浅水区,但差异并不显著(F=5.08,P>0.05,图2)。海参纲、海星纲和海胆纲的优势种在深水区栖息密度远高于浅水区,例如海参纲红腹海参和黑海参数量远高于其他海参,2种数量之和占全部海参总数的91.25%;海星纲以吕宋棘海星为主,数量占到全部海星的 61.29%(表4)。
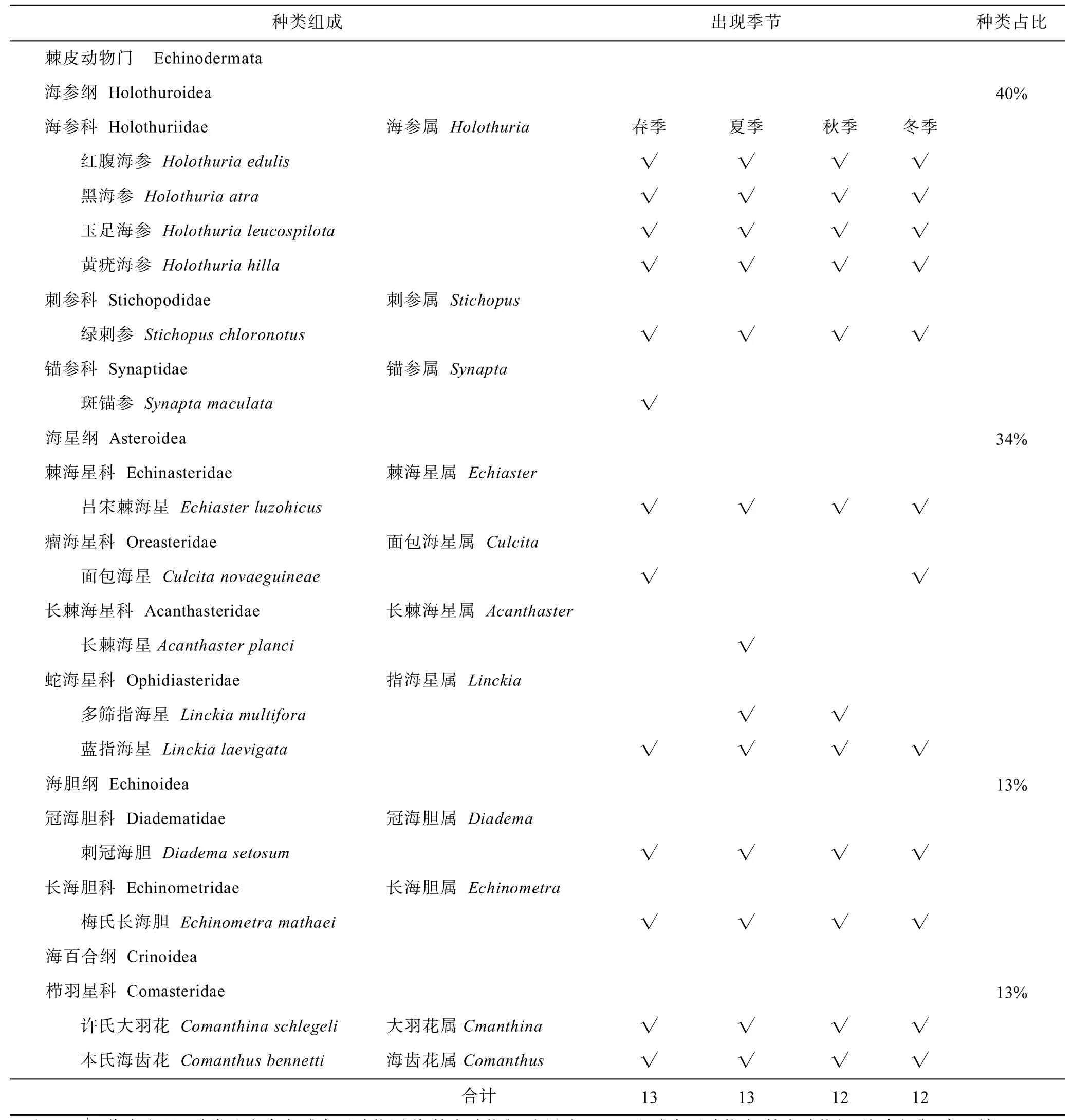
表2 不同季节棘皮动物种类组成情况Tab.2 Species composition of echinoderms in different seasons
2.4 棘皮动物优势种的季节变化
按优势度≥0.02来划分优势种类,共发现8种优势种类,分别是黑海参、红腹海参、黄疣海参、绿刺参、吕宋棘海星、许氏大羽花、本氏海齿花、刺冠海胆,优势类群以海参纲占优势。第一优势种为红腹海参,优势度在夏季达到0.52。黑海参、刺冠海胆和许氏大羽花优势度较红腹海参小,但也达到了较高水平,其他种类优势度一般。
各季节优势种数量为7种,其中属于全年优势种的有黑海参、红腹海参、吕宋棘海星、许氏大羽花和刺冠海胆。属于三季优势种为本氏海齿花和绿刺参。黄疣海参仅在夏季为优势种。
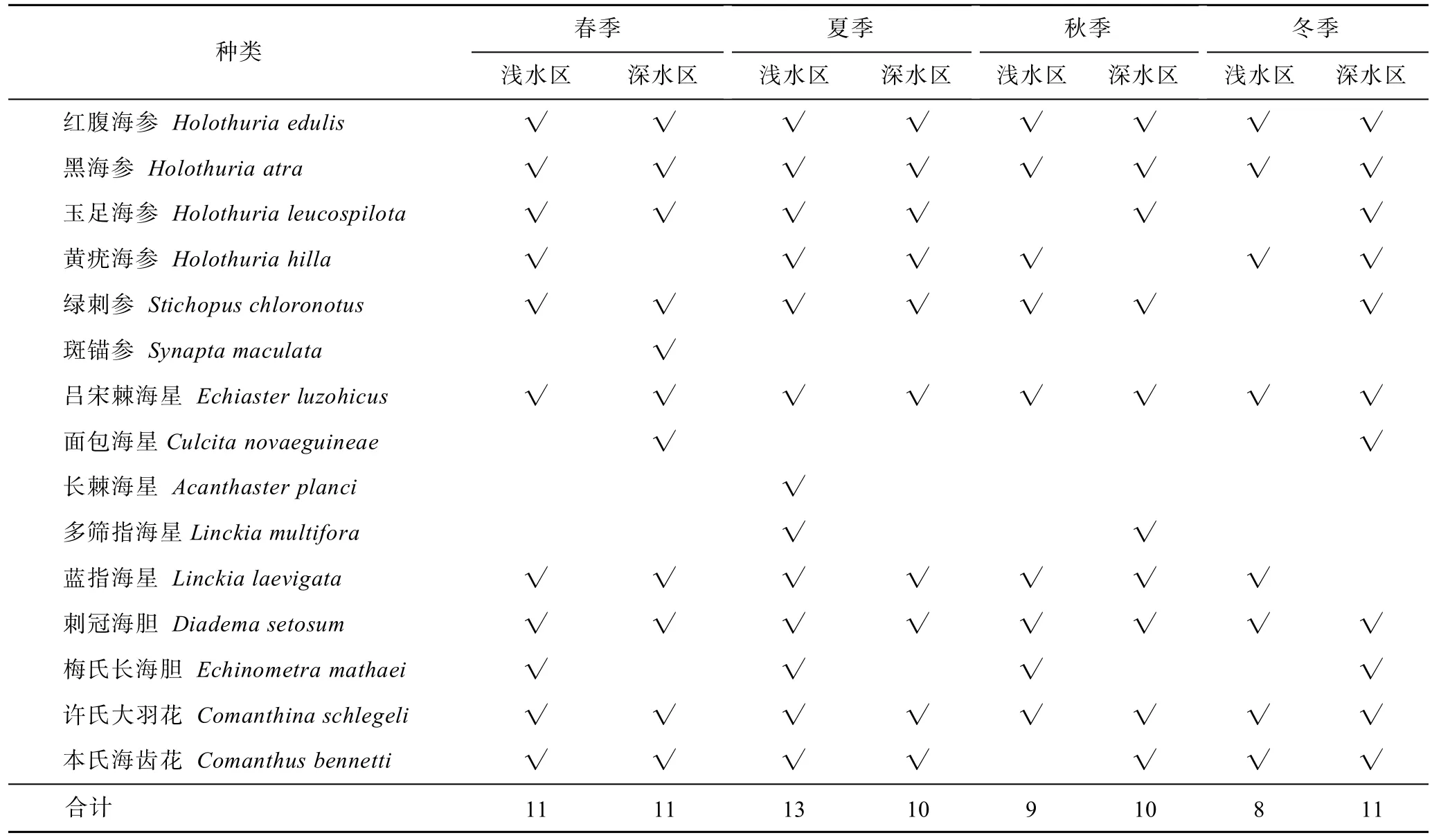
表3 不同季节浅水区和深水区棘皮动物种类组成Tab.3 Species composition of echinoderms in shallow water and deep water in different seasons

表4 不同季节浅水区和深水区棘皮动物栖息密度(单位:ind./10m2)Tab.4 Density of echinoderms in shallow water and deep water in different seasons
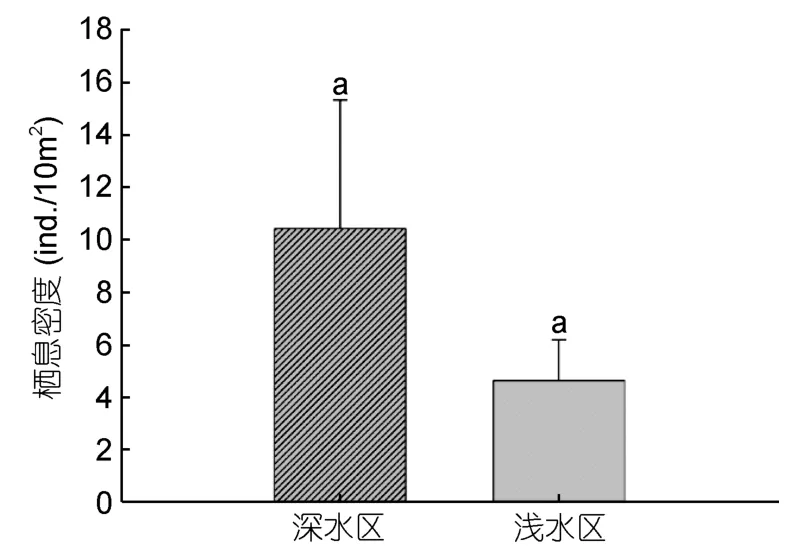
图2 不同季节浅水区和深水区棘皮动物栖息密度Fig.2 Density of echinoderms in shallow water and deep water in different seasons
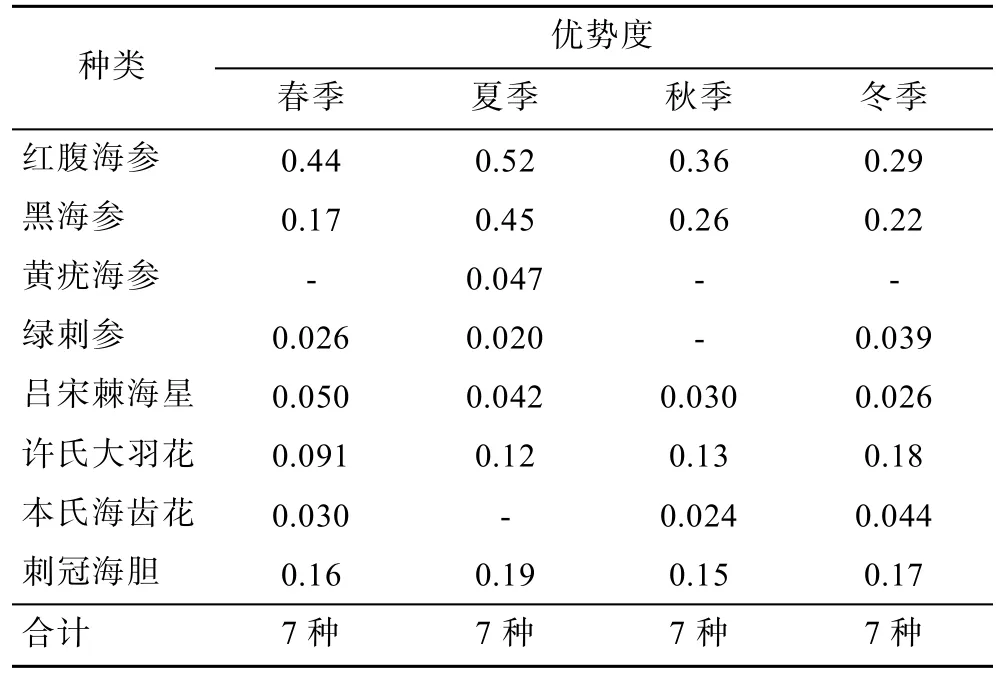
表5 不同种类棘皮动物优势度季节变化Tab.5 Dominant species of echinoderms in different seasons
2.5 棘皮动物生物多样性指数的季节变化
均匀度指数全年变动较大,呈现交替变化。多样性指数全年变化较大,春季和秋季最低,为2.4。物种丰富度指数在夏季有一定下降,其他季节变化不大。
对于各个纲,海参纲均匀度指数全年变动较大,呈现交替变化。多样性指数全年变化较大,秋季最低,为1.0。物种丰富度指数在夏季有一定下降,其他季节变化不大。海星纲种丰富度指数全年变化很小,均匀度指数在夏季有一定下降,多样性指数全年变化最大,夏季最低,为0.56。由于海百合纲和海胆纲只发现2种,得出的生物多样性指数无讨论意义,故不计算(表6)。
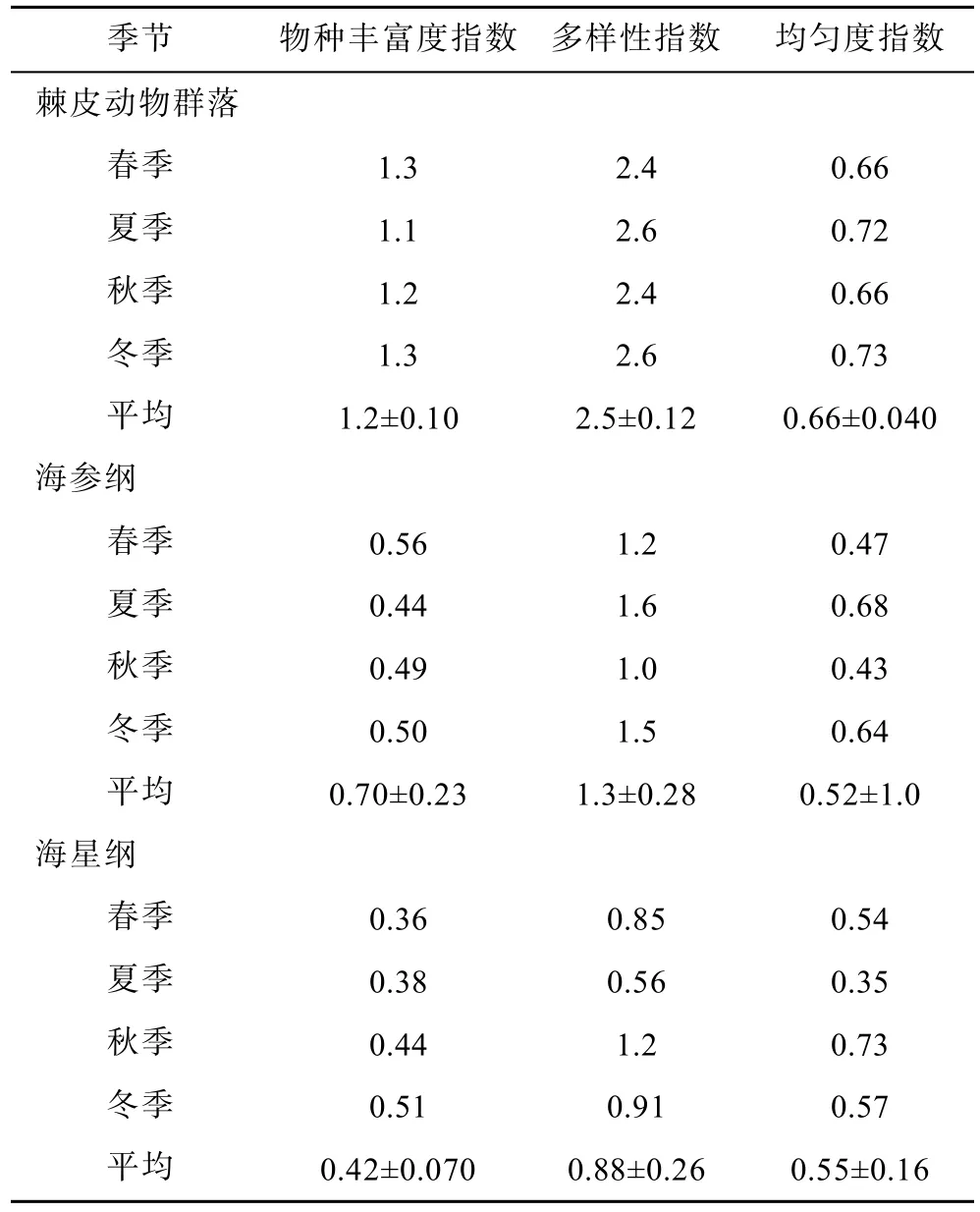
表6 棘皮动物群落生物多样性指数季节变化Tab.6 Seasonal variation of echinoderms diversity index
3 讨论
对比本研究与历史文献结果,三亚蜈支洲岛目前棘皮动物群落种类组成更为多样,种类多于三亚其他海域,且相较于同海域十年前显著增加。2004到2008年,吴钟解等(2011)等对蜈支洲岛珊瑚礁区底栖动物进行了监测,发现了19种珊瑚礁动物,其中8种为棘皮动物,以海参和海星为主。本次调查结果,棘皮动物种类增加到15种,种类明显增多,群落结构更趋多样化。2011年西岛、鹿回头和亚龙湾3个珊瑚礁自然保护区内大型底栖动物共有166种,其中棘皮动物有11种,全部为蛇尾类(董栋等,2015)。对比南海其它岛礁海域,李新正等(2007)采用轻潜采集方式调查南沙渚碧礁大型底栖动物群落特征,采集到314种珊瑚礁动物,其中棘皮动物有23种,主要种为黑栉蛇尾Ophiocoma erinaceus和画栉蛇尾Ophiocoma pica。综合上述对比可见,目前蜈支洲岛棘皮动物群落种类组成较多,资源保护较好,这很可能得益于蜈支洲岛旅游区严格的资源管护措施。
3.1 群落组成与底质分布特点
蜈支洲岛海域棘皮动物种类组成中,海参纲占绝对优势,夏季栖息密度最高,为6.5ind./10m2,特别是属于全年优势种的红腹海参和黑海参,2种数量之和占全部海参总数的91.25%,分布范围广泛,这与该岛海域底质类型更适合海参的栖息习性有着密不可分的关系。Dissanayake等(2010)研究发现,黑海参更倾向分布在长有海草的栖息地,在具有藻类和海草的岩石区域发现了高密度的红腹海参,对特定栖息地的偏好似乎与两种海参摄食和保护有关。现场潜水调查发现,蜈支洲岛北部为泥沙、基岩以及珊瑚礁构成的错综复杂的生境,非常适合活动能力较弱,喜隐蔽栖息的沉积食性海参生存。
3.2 群落分布密度季节变动原因
棘皮动物栖息密度呈现出春夏高、秋冬低的特点,这可能与不同季节水温和饵料可获得性的波动相关。李新正等(2004)对胶州湾底栖棘皮动物的数量变化及与环境因子的关系进行了初步研究,认为棘皮动物主要分布在底质沉积类型为粉砂-黏土、有机质含量较高的区域,同时其数量变化与温度、初级生产力关系较明显,二者升高,其生物量、密度也较明显升高。对蜈支洲岛底栖生境的同步调查发现,笔者推测棘皮动物平均栖息密度受饵料可获得性影响较大。如海底大型藻类(如绿藻类)仅在春季和夏初丰度较高,其释放的有机质对底栖饵料贡献较大,棘皮动物食物来源丰富,故棘皮动物平均栖息密度较高,但该推论尚需进一步实验验证。
3.3 深度对棘皮动物栖息密度的影响
不同深度棘皮动物分布结果表明,总体上深水区棘皮动物的栖息密度高于浅水区,但是差异不显著。造成该分布差异的因素较为复杂,诸如水温差异、底质类型、饵料适宜性以及隐蔽场所可获得性等方面均会造成影响。一般来说,浅水区光照条件优良,底栖初级生产力水平更高,饵料获得性高,适宜于小个体栖息。但同时受风浪影响可能更大,而深水区环境更为稳定,大个体较多栖息于此。以海参纲为例,海参在自然界常呈不均匀或者斑块分布(Purcellet al,2009),这主要归结于底质类型、底部沉积物特征、食物来源、深度、躲避捕食者和隐蔽场所这些因素。同时,海参对于生境存在一定的选择偏好(Uthickeet al,1999;Mercieret al,2000;Uthickeet al,2004;Shiellet al,2010;Slateret al,2010;张宏晔等,2015)。据研究,底泥沉积物特征与深度存在着一定联系,随着深度增加,粉砂含量增加而砾石含量减少(Martinet al,2009),细小颗粒的沉积物更是海洋生物的营养丰富食物来源(Mayeret al,1985;Yamamotoet al,1985)。笔者推测,深水区受风浪影响较小,水流平稳,基岩和珊瑚礁等自然礁体可以更加有效地沉降自然水体中细颗粒的沉积物,同时其表面可以附着底栖微藻和其他微型生物(王吉桥等,2008;秦传新等,2009),这有利于海参获得营养丰富的食物。另外,Conand(2008)和Purcell等(2009)发现,红腹海参和黑海参在珊瑚礁和岩石上会存在较大规模的集群分布,并且认为这与海参躲避波浪和急流有关。相较于浅水区,深水区水流更加平稳,受波浪影响小,且基岩和珊瑚礁组成的自然礁体更有利于海参找到隐蔽场所来躲避恶劣海况(张宏晔等,2015)。综上所述,由于深水区具有水流平稳,受波浪影响小的特点,栖息在深水区的棘皮动物不仅可以更加有效获得营养丰富的饵料,同时,基岩和珊瑚礁能够为行动迟缓的棘皮动物提供重要的栖息地来躲避恶劣的海况,因此深水区分布有较多的棘皮动物。
3.4 棘皮动物生物多样性评价
优势种通常控制群落中的能量流和物质循环(Roy,1998),并且通过数量上的优势以及种间关系(竞争、捕食和他感作用)以扩大对生境资源的利用,主导大型底栖动物的分布格局。稳定的优势种种群是生态系统稳定性的重要指征。Conand等(2002)对La Re′union岛调查发现17种海参,其中,黑海参为最常见的种类;Eriksson等(2012)对西印度洋(Mayotte)珊瑚礁内海参群落栖息密度和多样性进行了研究,发现22种海参,其中黑白尼参Bohadschia atra和黑乳海参Holothuria nobilis数量最为丰富,上述海域均对应着健康稳定的珊瑚礁生态系统。对蜈支洲岛全年调查中,各季节的优势种数量稳定,为7—8种。全年优势种的有黑海参、红腹海参、绿刺参、吕宋棘海星、许氏大羽花和刺冠海胆,其中,属于第一优势种的红腹海参在夏季优势度达到0.52,表明蜈支洲岛海域珊瑚礁生态系统保持较好的稳定性。
按Shannon-Wiener指数分级评价标准,蜈支洲岛海域棘皮动物平均多样性指数为2.5,大于2小于3,属于轻度的人为干扰。2016年,蜈支洲岛旅游区年接待游客达到254.79万人次(周扬等,2018),在如此高的游客接待量下能保持该人为干扰程度,应得益于经营企业对珊瑚礁生态系统的有效保护与严格的游客管理措施。Woo等(2013)研究南海、苏禄海和苏拉威西海3个珊瑚礁海参群落的分布及其多样性,采集到12种海参,对比该区域历史研究结果,发现这3个珊瑚礁生态系统海参群落及其多样性目前正受到威胁。调查结果发现,除了南海受到严格的监管和安全监测外,其他两个海域珊瑚礁缺少执法,海参群落长期面临过度捕捞而日益减少,加上传统的捕鱼方式,如炸鱼等严重破坏珊瑚礁行为导致海参栖息地严重减少。综合上述对比可知,良好的珊瑚礁生态系统离不开严格的监管和保护,蜈支洲岛旅游区在对于珊瑚礁保护的管护措施非常到位,因此棘皮动物群落结构趋于多样化。
4 结论
本研究发现,三亚蜈支洲岛海域棘皮动物种类较以往研究显著增加,群落结构趋于多样化。沉积食性海参红腹海参、黑海参以及牧食性刺冠海胆是主要的全年优势种,这3个种在维护珊瑚礁生态系统物质能量循环过程将发挥重要生态作用。珊瑚礁区沉积食性的海参将覆盖在珊瑚礁上的泥沙清除,有利于珊瑚正常生长;植食性的海胆负责摄食生长在珊瑚礁上及其周围藻类,为珊瑚提供更多的生存空间。根据Shannon-Wiener指数分级评价标准,该海域属于轻度干扰,人为扰动小,群落生物多样性高。综上所述,蜈支洲岛海域珊瑚礁生态系统保护效果良好,应继续保持当前保护力度。



附图 蜈支洲岛海域常见棘皮动物生态照片(共计15种)Photos of common echinoderm species in the waters of Wuzhizhou Island(15 species in total)
