近20年南海四带笛鲷(Lutjanus kasmira)种群特征变化*
2020-02-06陈作志董俊德林昭进孙典荣
张 俊 陈作志 董俊德 张 魁 林昭进 孙典荣
(1.中国科学院热带海洋生物资源与生态重点实验室 广东省应用海洋生物学重点实验室 中国科学院南海海洋研究所广州 510301;2.中国水产科学研究院南海水产研究所 农业农村部外海渔业开发重点实验室 广州 510301;3.南方海洋科学与工程广东省实验室 广州 510301;4.中国科学院大学 北京 100049)
珊瑚礁是海洋中生物多样性最高的生态系统,其中生活着4000多种鱼类,全球10%的经济鱼类与珊瑚礁有关(Moberget al,1999;Souteret al,2000)。作为珊瑚礁生态系统重要组分,鱼类通过参与珊瑚礁各项生态过程而发挥重要的生态功能。由于气候变化和人类活动的影响,全球珊瑚礁鱼类资源持续衰退,严重危及到珊瑚礁鱼类的可持续发展及生态系统健康(Rummeret al,2017)。近年来,珊瑚礁鱼类的恢复和保育及其与珊瑚礁的相互作用的研究已引起国际社会的普遍重视(Allgeieret al,2016)。
珊瑚礁是我国南海最具特色的生态系统,已记录依赖珊瑚礁生活的鱼类近千种(李永振等,2011;赵焕庭等,2016)。我国在南海珊瑚礁鱼类资源结构、生物学、种群评估等方面开展了许多调查研究工作,但主要关注群岛尺度上鱼类种群及群落现状的研究,而关于鱼类种群特征的长期变化方面的研究极其缺乏(陈国宝等,2007;李永振等,2007,2011;张俊等,2015)。因此,在全球珊瑚礁鱼类资源衰退的大背景下,开展南海珊瑚礁鱼类种群特征长期变动研究对深入了解南海珊瑚礁鱼类种群特征演变及其对气候变化和人类活动的响应等有重要意义。
四带笛鲷(Lutjanus kasmira)隶属于鲈形目笛鲷科笛鲷属,为典型礁栖鱼类,分布于印度-太平洋区,在我国分布于南海、台湾海域和东海南部(陈大刚等,2015)。在南海珊瑚礁鱼类调查中四带笛鲷出现频率及优势度均较高,作为南海珊瑚礁鱼类的代表鱼种之一,适合用于开展珊瑚礁鱼类种群长期演变趋势方面的研究。国外学者在四带笛鲷的摄食习性、栖息特征、年龄和生长等方面已经开展过一些相关研究(Rangarajan,1970;Morales-Ninet al,1990;Vignonet al,2008),但关于种群特征长期变化方面的研究尚未见报道。本文根据1998—2018年南海典型珊瑚礁区四带笛鲷调查数据,对其群体结构、性比和初次性成熟体长、摄食强度及肥满度等生物学特征的年代际变化进行研究。研究结果将丰富南海珊瑚礁鱼类种群生物学的研究,提升对南海珊瑚礁鱼类种群特征演化过程及其对气候变化和人类活动的响应等科学问题的认识。
1 材料与方法
1.1 样品采集
四带笛鲷的生物学数据根据中国水产科学研究院南海水产研究所在南海南沙群岛和西沙群岛进行珊瑚礁鱼类调查时采集的样品测定(图1),其采样时间、区域、渔具及规格等见表1。1998年及1999年的调查时间分别为4月5日—5月7日及5月15日—6月4日,为便于表述,本文统称为1998年4月及1999年5月。
1998年调查船为“中国渔政35号”,总吨位300t,主机功率441.3kW。1999年调查船包括“粤远渔730”和“粤远渔733”,总吨位分别为98t和89t,主机功率分别为253kW和285kW。2003年调查船包括“粤阳东19001”和“粤阳东19008”,总吨位均为75t,主机功率分别为201kW和204kW。2013—2018年调查船为“南锋号”,总吨位1537t,主机功率1920kW,及其工作艇(总吨位1t,主机功率14.7kW)。
手钓为底层作业,利用群众渔船在礁缘或礁坪行钓,“南锋”号及其工作艇在泻湖内行钓,时间一般为 07:00—11:00、12:00—17:00 和 18:00—22:00,水深为10—80m,钓饵采用新鲜渔获物。流刺网作业地点主要在礁坪区、礁缘浅水区和泻湖内,通常18:00放网,次日06:00起网。

图1 南海四带笛鲷西沙群岛和南沙群岛采样区示意图Fig.1 The area of sampling of L.kasmira in coral reefs in the Xisha Islands and NanSha Islands,South China Sea
1.2 生物学测定
四带笛鲷样品现场浸入海水急冻后带回实验室作生物学测量,包括体质量、体长、性腺成熟度及摄食等级等。体长和体质量测定精度分别为1mm和0.1g。性腺成熟度以Ⅰ—Ⅵ期划分。摄食等级以0—4标准划分;其中,0级表示胃中无食物;1级表示胃中有少量食物,食物占胃体积小于二分之一;2级表示胃中有中等程度的食物,食物占胃体积大于二分之一;3级表示胃中充满食物,但胃壁不膨大;4级表示胃中充满食物,且胃壁膨大(费鸿年等,1990;李波等,2019)。四带笛鲷样品共1522尾,其中785尾样品作详细生物学测定(1998—1999年113尾,2016—2018年672尾),余下样品仅测量体长和体质量。

表1 南海四带笛鲷生物样品采集信息Tab.1 Information of biological sampling of L.kasmira specimens in the South China Sea
1.3 体长与体质量关系
体长以5mm为组距分组,各时期分别进行体长频次分析,规定占样本总尾数8%以上的体长组为优势组。应用M-W和K-S非参数检验比较各时期以及雌雄间体长构成差异,并应用一维方差分析检验平均体长的年间差异。
四带笛鲷体长与体质量符合幂函数关系:

式中,W为体质量(g),L为体长(mm),a、b分别为条件因子和异速生长因子。用自然对数转换的体质量和体长的线性回归方程和最小二乘法求解参数a和b(Froese,2006):

式中,lna为截距(a=exp(lna)),b为斜率。当点位于回归直线95%置信度预测带之外即认为该点对应的体长 - 体质量关系异常。使用协方差分析检验参数a和b的年际差异。
1.4 性比与初次性成熟体长
分析各时期四带笛鲷雌、雄比及性腺成熟度情况。采用卡方检验分析各时期雌雄比例是否为1。规定性腺成熟度Ⅳ期及以上个体达到性成熟。四带笛鲷最小性成熟体长为样本中性成熟个体的最小体长,初次性成熟体长(L50)采用LSM拟合以下逻辑斯蒂模型得到(Vilaet al,2010):

式中,Pi为体长组Li对应的成熟个体比例,r为模型参数。
1.5 肥满度
肥满度用于描述鱼类生长条件状况,其基本假设是在鱼类个体长度一定时,体质量越大则其生活状况越好(黄真理等,1999)。本文用相对体质量Wrm(%)表示各调查时期四带笛鲷的肥满度(Froese,2006;李忠炉等,2011):
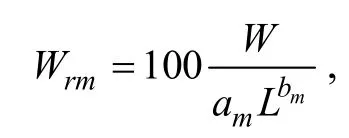
式中,L为体长,W为实测体质量,am为四带笛鲷各时期非异常a值的几何平均值,bm为各时期非异常b值的算术平均值。为减小体长结构差异对肥满度的影响,各时期选取相同体长组的样本计算肥满度,为兼顾各时期共存体长组及保持一定的样本量,本研究分别以13.0—18.0cm、11.0—16.0cm及13.0—18.0cm体长组样本计算各时期雌性、雄性及全部群体的肥满度,应用T检验比较肥满度的年际和雌雄差异,利用相关性分析探讨影响肥满度的因子。
2 结果与分析
2.1 群体结构
1998—2018年,四带笛鲷雌性、雄性及全部群体的体长和体质量分布范围呈缩小趋势,平均及最大体长减小,表明群体中大个体减少(表2,图2,图3,图4)。与20世纪90年代末相比,2003年全部群体体长分布及平均体长增大且极显著(P<0.01),这主要因为2003年样品是由流刺网采集,群体中大个体的比例更高所致;2013—2018年,各年份同季节雌性、雄性及全部群体体长分布差异均极显著,平均体长均变小且极显著(P<0.01)。与2013年8月相比,2016年11月、2017年5月及2018年9月全部群体的平均体长均显著减小(P<0.05)。2016年11月雌性个体最大体长明显小于2017年12月,这可能与测量样本量较少有关系。
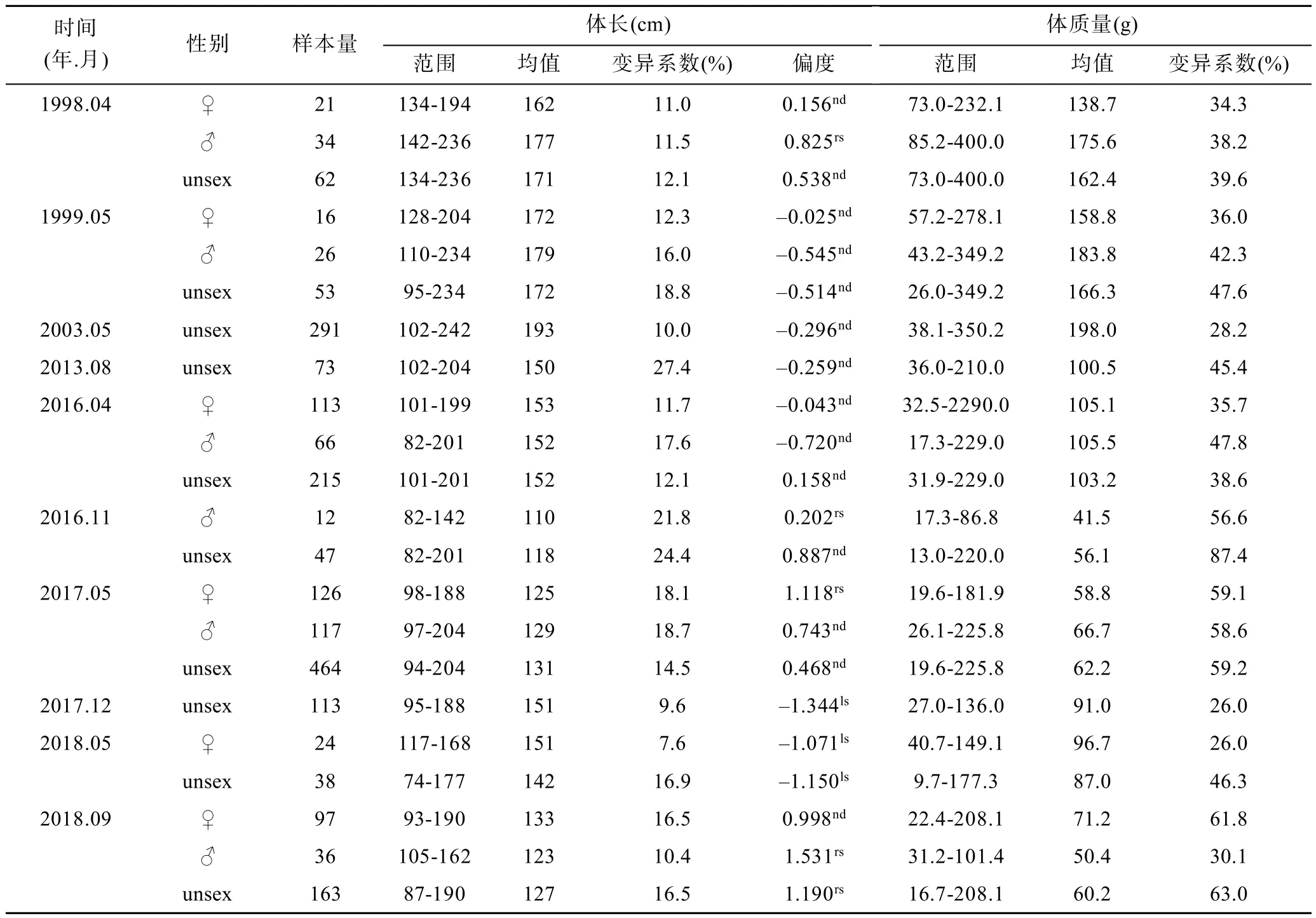
表2 四带笛鲷体长和体质量分布特征Tab.2 Distribution characteristics of body length and weight of L.kasmira

图2 四带笛鲷平均体长的年际变化Fig.2 Mean body length of L.kasmira and the interannual variation in the South China Sea
1998—1999年及2003年全部群体的优势体长组分别为165—180mm及180—205mm,分别占36.8%及51.5%(图4)。2013—2017年各年份优势体长组趋向分散,断续由多组构成。2017年5月优势体长组包括105—115mm和125—150mm,分别占19.9%和51.9%。2018年5月优势体长组为140—165mm,占57.9%。从1998年到2018年,优势体长组呈缩小趋势。
非参分析表明,1998年雌雄个体体长分布有显著差异(P<0.05),有记录的其他年份的雌雄个体体长分布均无显著差异(P>0.05);2016—2018年全部群体的体长分布和平均体长季节差异极显著(P<0.01)。从2016年11月,体长分布逐渐从正态分布为主转变为偏态分布为主,这反映出群体体长分布的连续性受到影响。

图3 四带笛鲷最大体长的年际变化Fig.3 Maximum body length of L.kasmira and the interannual variation in the South China Sea
2.2 体长与体质量关系参数
南海四带笛鲷雌性、雄性及全部群体的体长-体质量关系参数如表3所示。雌性群体除2017年5月呈负异速生长外(b<3),其余各年份以正异速生长为主(b>3);雄性群体在1998年、1999年和2016年4月等速生长(b=3),在2016年11月、2017年和2018年则转变成负异速生长。
协方差分析表明,2018年5月雌性b值显著大于其他年份(P<0.05),2017年5月显著小于其他月份;雄性b值年际间变化不显著(P>0.05);1998—1999年、2016年及2018年全部群体b值显著大于2003年及2017年12月(P<0.05)。除2017年5月,其余年份雌性b值均大于雄性,但雌雄差异并不显著(P>0.05)。

图4 1998—2018年各年-月四带笛鲷全部群体体长分布Fig.4 Body length distribution of unsex L.kasmira in the South China Sea during 1998 to 2018

表3 四带笛鲷体长-体质量关系参数Tab.3 Estimated parameters of body length vs body weight of L.kasmira
2.3 性比和初次性成熟体长
1998年、1999年、2016年4月、2017年5月和2018年9月雌雄比分别为0.62、0.77、1.69、1.08和2.65。卡方检验分析显示,1998年和1999年雌性均显著少于雄性(P<0.01),2016年4月、2017年5月和2018年9月雌性均显著多于雄性(P<0.01)。
1999年5月雌性性成熟比例最高(30.0%),2017年5月最低(6.3%),2017—2018年性成熟比例显著低于1998—1999年(P<0.01)。从1998年到2018年,四带笛鲷L50总体呈变小趋势,如1998—1999年L50为19.1cm,2016年4月和2017年5月L50仅16.8cm;2018年9月L50为17.5cm,与之前年月相比虽有所变大,但两者月份不同,不能说明L50出现回升(图5)。
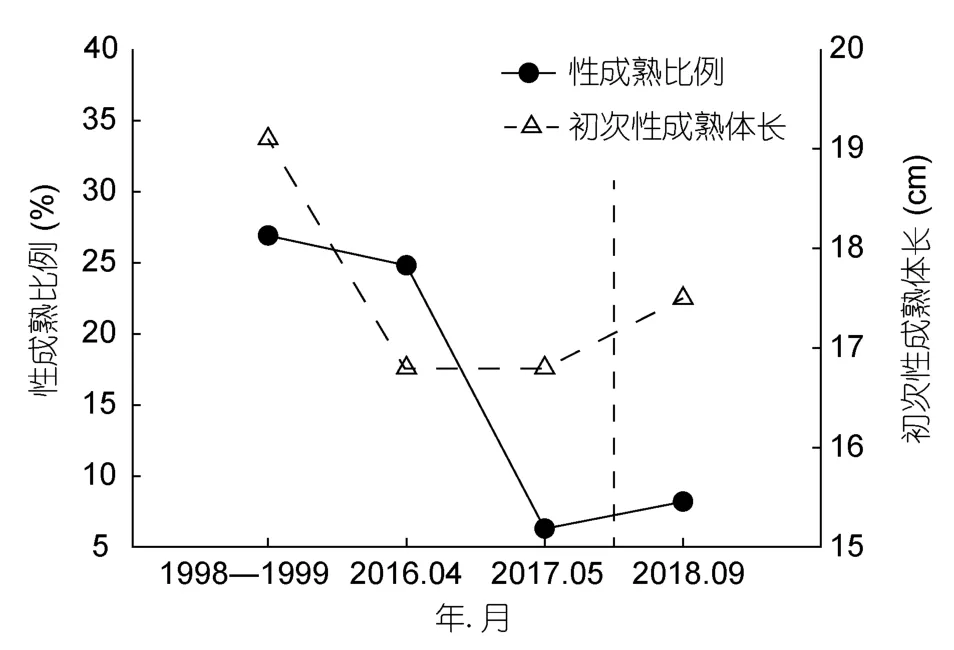
图5 南海雌性四带笛鲷性成熟比例和初次性成熟体长的年际变化Fig.5 Proportions of mature individuals and first maturity lengths,and the interannual variation of female L.kasmira in the South China Sea
2.4 摄食强度
从1999年到2018年,雌性、雄性和全部群体摄食等级为1级的样本占总样本的百分比逐渐升高,而摄食等级为4级的样本占总样本的百分比则明显下降,如全部群体2016年4月、2017年5月、2018年5月和2018年9月摄食等级为0级及1级的样本所占百分比分别是1999年5月的2.0倍、2.4倍、2.9倍和3.3倍,而摄食等级为4级的样本所占百分比仅分别是1999年5月的25.1%、29.9%、21.1%和4.8%(图6)。
1999—2018年雌性、雄性和全部群体的平均摄食等级明显下降(图7),如雌性及全部群体的平均摄食等级1999年5月分别为2.40和2.47,2018年5月分别下降至1.45和1.50,仅是1999年的60.4%和60.7%。2018年9月雌性、雄性和全部群体的平均摄食等级比2018年5月更低。四带笛鲷摄食强度持续降低表明其食物保障受到破坏,生境中食物的数量、质量及可获得性下降。
从2018年50个四带笛鲷胃含物样本镜检分析结果看,四带笛鲷以底栖动物(蟹类、虾类、腹足类、双壳类)和鱼类为主要摄食对象,也摄食头足类、珊瑚和藻类。值得一提的是,在四带笛鲷的胃含物中发现未消化的鸡骨和鸡肉残余,这表明礁区人类活动已经直接影响到期其摄食过程。
2.5 肥满度
除2018年9月雄性群体的条件因子a和异速生长因子b属于异常值外,其余各群体的a和b无异常值。排除异常值后各群体的lga与b的线性关系如图8,得到am=0.0317,bm=2.9630。本研究基于表1中各时期四带笛鲷的样本量、体长和体质量数据,计算各体长组肥满度,然后取算术平均值,得到各群体的平均肥满度,结果如图9所示。

图6 南海四带笛鲷全部群体、雌性和雄性各摄食等级数量百分比及其年际变化Fig.6 Percentage of specimens at different feeding levels and the interannual variation for L.kasmira in the South China Sea

图7 南海四带笛鲷全部群体、雌性和雄性的平均摄食等级及其年际变化Fig.7 Mean feeding level and the interannual variation for L.kasmira in the South China Sea
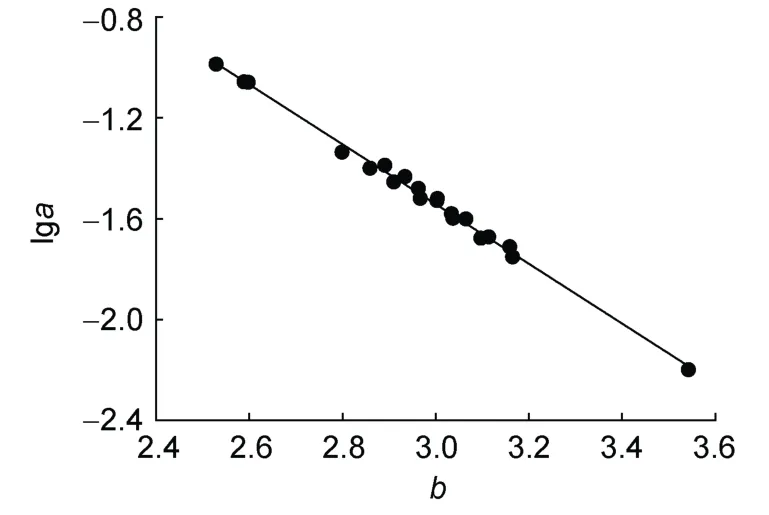
图8 南海四带笛鲷lga与b的线性关系Fig.8 Linear relationship between lga and b for L.kasmira in the South China Sea
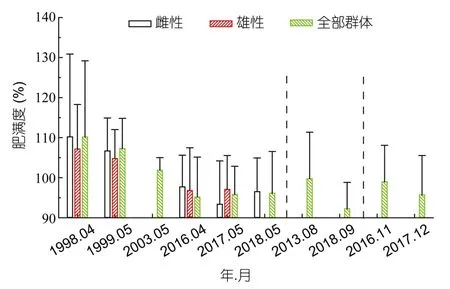
图9 南海四带笛鲷肥满度的年际变化Fig.9 Interannual variation in relative fitness of L.kasmira in the South China Sea
1998—2018年,雌性、雄性和全部群体的肥满度总体呈持续减小趋势。2017年5月雌性的肥满度小于雄性,其余年份雌性肥满度均大于雄性,但雌雄间差异不显著(P>0.05)。雌性肥满度2017年5月最低(93%),2018年5月略有回升(97%)。2016年4月和2017年5月雄性肥满度均是97%,2018年9月最低(92%)。全部群体的肥满度在2016年4月达到低值后回升,再持续下降,2018年9月仅92%。2016—2018年雌性、雄性和全部群体的肥满度低于1998—1999年且变化极显著(P<0.01),而季节间差异不显著(P>0.05)。
四带笛鲷雌性、雄性及全部群体的肥满度与平均摄食等级的Pearson相关系数分别为0.946、0.876及0.965,这表明摄食强度的下降对肥满度下降有极重要的影响;全部群体的肥满度与性成熟比例及雌雄比的Pearson相关系数分别为0.346及-0.669(表4,图10,图11)。

表4 四带笛鲷肥满度及其对应的平均摄食等级、性成熟比例、雌雄比Tab.4 Relative fitness of L.kasmira and corresponding average feeding intensity,proportion of sexual maturity and ratios of female to male
3 讨论
3.1 南海四带笛鲷群体生物学特征的长期演变趋势
3.1.1 个体小型化及性早熟现象 自1998年以来,南海四带笛鲷体长结构发生了很大变化,表现为群体体长和体质量范围逐渐缩小,平均体长、最大体长及优势体长组逐渐变小。如2018年5月全部群体的平均体长和体质量仅是1998年4月的83.0%和53.6%。四带笛鲷L50同样呈逐渐减小趋势。如2016年4月和2017年5月的L50仅是 1998—1999年的88.0%,比后者小2.3 cm。因此,南海四带笛鲷群体可能已经出现小型化及性早熟现象。这种现象在中国近海经济鱼类中均已发生,如南海二长棘犁齿鲷、黄海小黄鱼、东海带鱼等(周永东等,2002;单秀娟等,2011;张魁等,2016b),但在南海礁栖鱼类中还是首次被发现。

图10 南海四带笛鲷肥满度与平均摄食等级的关系Fig.10 Relationship between relative fitness and mean feeding level
在本研究中,从1998年到2018年四带笛鲷雌鱼占比逐年上升,1998—1999年雄鱼多于雌鱼,但从2016年雌鱼开始多于雄鱼。与此同时,性成熟比例和初次性成熟体长逐渐降低。单秀娟等(2011)研究表明黄海中南部小黄鱼也存在雌鱼比例上升并从低于雄鱼到高于雄鱼的现象。南海北部湾二长棘犁齿鲷和短尾大眼鲷种群同样存在雌鱼比例升高现象(张魁等,2016a,b)。雌雄比不断升高可能有助于饵料资源流向雌性及种群补充。四带笛鲷性成熟比例和L50降低过程中,其摄食强度持续下降,这表明并非是充足的饵料引起性成熟提前。因此,气候因子和捕捞驱动可能是影响其小型化及性早熟的重要原因(Law,2000;Domínguez-Petitet al,2008;李忠炉等,2012;Fidleret al,2018),而雌鱼比例不断升高可能是其对不断增强的气候变化和人类活动压力的一种适应性选择,但其中的具体机制则需要更多的深入研究。
3.1.2 异速生长因子b的年际变化 四带笛鲷异速生长因子b存在年际变化和季节波动,但基本在2.5—3.5范围内,除2018年5月雌性群体b大于3.5。许多因素会引起b值变化,如体长结构、雌雄比例、繁殖状态等,而Froese(2006)研究表明样本体长范围是影响体长-体质量关系参数的主要因子。四带笛鲷全部群体b值与平均体长、体长偏斜度、峰度、雌雄比例及性成熟比例的Pearson相关系数分别为-0.480、0.594、-0.288、0.684及-0.180。2018年5月,四带笛鲷雌性群体样本体长范围较窄(11.7—16.8cm)且集中分布于14.0—16.5cm,这可能是导致b值偏高的主要因素。2003年样品由流刺网采集,体长明显偏大且集中分布于15.5—22.0cm,由于流刺网倾向于在较长的鱼中选择形状较薄的鱼,从而在b中引入误差(Kipling,1962)。
南海四带笛鲷体长-体质量关系参数a的对数与b呈显著负线性相关关系。与Fishbase数据库中报道的关岛、新喀里多尼亚、北马里亚纳群岛等海域四带笛鲷lga与b的负线性关系相比,南海四带笛鲷lga与b的线性关系的斜率比前者低7.92%,截距比前者高34.3%(Froeseet al,2019)。因此,不同海域四带笛鲷的lga与b线性关系有所差异。这种差异是否是由于不同地理种群的差异造成的,还有待进一步研究加以确定。

图11 南海四带笛鲷肥满度与性成熟比例及雌雄比的关系Fig.11 Relationship between relative fitness and proportion of sexual maturity and ratios of female to male of unsex population
3.1.3 摄食强度及肥满度下降 鱼类的摄食活动是维持种群生存的基础。在本研究中,四带笛鲷的空胃率升高,平均摄食强度逐渐下降,这可能表明其食物供应不畅(李波等,2019)。2018年5月四带笛鲷摄食强度高于9月,这可能与其摄食习性的季节差异也有关系(Rangarajan,1970)。相关分析显示,其平均摄食等级与性成熟比例的Pearson相关系数为0.618,这表明摄食强度的下降对性成熟比例的下降有重要贡献。值得一提的是,四带笛鲷的胃中出现鸡骨和鸡肉残余,这是四带笛鲷“饥不择食”地摄取,还是偶然的“误食”,或者四带笛鲷本身就属于机会主义摄食者,尚待研究。但无论如何,这无疑是人类活动影响珊瑚礁鱼类的直接证据,应当引起警惕。为减小人类活动对珊瑚礁鱼类及生态系统的破坏,礁区活动应具有严格的标准规范。
肥满度是重要的渔业生态学指数,反映了鱼类的生理和营养状况,常用于比较不同种群鱼类的饵料保障的丰欠和利用程度,一般而言,鱼类营养条件越好,其肥满度越高(黄真理等,1999;Froese,2006;李忠炉等,2011)。自1998年以来,南海四带笛鲷的肥满度呈持续下降趋势,且与平均摄食等级的下降趋势一致并高度相关,这表明其生长状况不断恶化,饵料供应不足可能是主要原因。四带笛鲷肥满度与性成熟比例呈正相关,与雌雄比呈负相关,这可能反映了食物保障和生长状况变差(表现为肥满度下降),不利于性腺发育,导致性成熟比例下降;在此情况下,四带笛鲷通过提高雌雄比有助于雌性获得更多资源,繁殖更多后代,有利于维持种群规模。
3.2 南海四带笛鲷种群特征变化的影响因素
引起鱼类种群特征变化的因素很多,主要包括气候变化和人类活动两个方面。珊瑚礁鱼类遭受的气候变化来自全球变暖、海洋酸化和台风等现象,其中海洋温度升高是当前最受关注的气候变化之一(Mundayet al,2008)。高温会导致珊瑚大规模白化及死亡,引起鱼类栖息地退化甚至丧失,最终造成鱼类种群迅速减少或长期持续下降。Hempson等(2018)对塞舌尔群岛珊瑚礁鱼类的研究表明,1998年高温导致的珊瑚白化造成生态系统发生以珊瑚为主到以藻类为主的生态相变,直接影响小型鱼类种群;白化事件发生16年后,生态相变的珊瑚礁中的高营养级鱼类的丰度和生物量均显著低于那些未发生生态相变并处于恢复中的珊瑚礁。生态相变缩短珊瑚礁食物链,引起鱼类种群增长率、繁殖力及存活率下降,对高级鱼类构成延迟致死效应。海洋温度升高还会影响珊瑚礁鱼类的生理表现和行为,特别是在早期生命阶段(Mundayet al,2008)。
本研究通过分析16年来5月份南海的海表温度(sea surface temperature,SST),发现南沙群岛和西沙群岛SST均呈不断上升趋势(图12),这与四带笛鲷的群体结构、摄食强度及肥满度的持续下降正相反。贾丹丹等(2018)研究表明南沙和西沙礁区SST的升温趋势分别为 0.096°C/(10a)和 0.180°C/(10a)。如 1998年及2015年EI Niño事件期间南海大部分海区的温度比正常年份最高温度上升2—6°C,南海出现大范围珊瑚白化及死亡现象(赵焕庭等,2016;DeCarloet al,2017)。不断上升的海水温度通过影响珊瑚的正常生长而破坏礁栖鱼类的栖息地,威胁礁鱼的食物链健康,而且还与过度捕捞及环境污染相互作用,对礁栖鱼类群落造成重大而持久的影响。
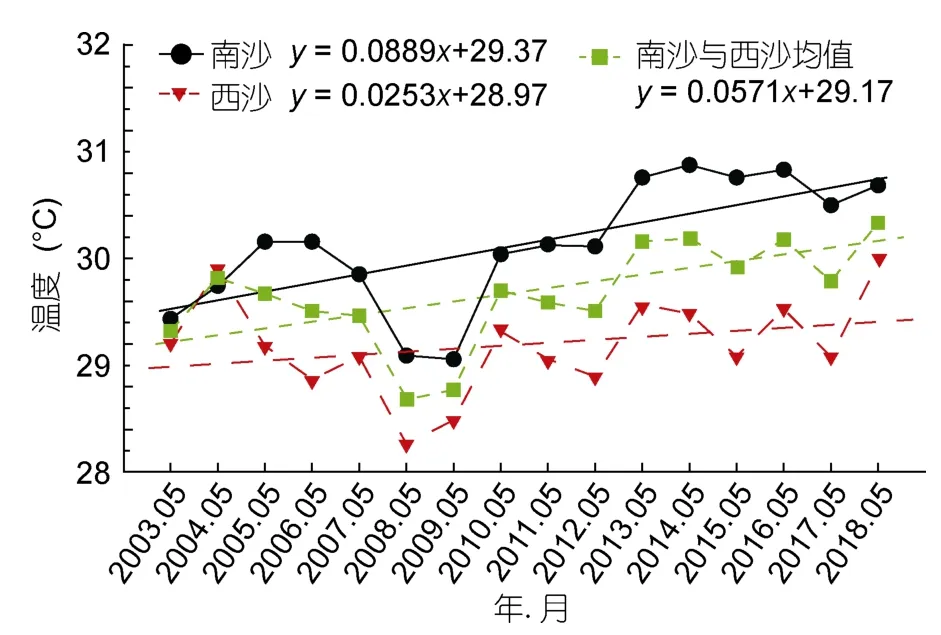
图12 南海南沙群岛和西沙群岛2003—2018各年份5月海表温度变化Fig.12 Interannual variation of sea surface temperatures in May of each year from 2003 to 2018 in Nansha Islands and Xisha Islands in the South China Sea
过度捕捞是导致珊瑚礁大型鱼类个体数量下降或消失的主要人类活动之一(Allgeier,2016;Robinsonet al,2017)。Graham等(2005)研究表明,随着捕捞强度增加,珊瑚礁鱼类粒径谱坡度增大而高度减小,其原因是大型鱼类相对丰度的减少。捕捞除了造成珊瑚礁鱼类体长结构变小,还导致鱼类种群规模及营养级降低。因此,南海四带笛鲷体长结构逐渐缩小可能与捕捞有关。如本研究中2017年5月雌性优势体长(13—15mm)和b值(2.799),均低于其他各年份,其原因可能是采样时样品本身的生物学发育阶段,以及过度捕捞等原因。一般而言,过度捕捞会导致鱼类的体长结构和b值会变小,因为捕捞会造成幼鱼比例升高。但由于缺少南海珊瑚礁渔业生产的详细的统计资料,还无法直接分析捕捞对其种群结构的影响。
破坏性捕捞是影响珊瑚礁鱼类种群变化的重要人为压力。南海50%—60%的珊瑚礁受到过炸鱼、毒鱼等不当捕捞方式的威胁(赵焕庭等,2016)。破坏性捕捞对珊瑚礁鱼类的影响是毁灭性的和长期性的,不但直接造成鱼类和珊瑚大量死亡,破坏鱼类赖以存在的栖息地基础,还会对珊瑚礁生态系统的结构和功能产生整体的影响,导致生态失去平衡和生产力下降,破坏鱼类的食物供给,持续影响鱼类的生长。四带笛鲷群体结构变小、摄食强度及肥满度下降可能与生境破坏及其导致的食物供给不足有关。虽然我国早已禁止破坏性捕捞行为,但南海周边一些国家至今还存在炸鱼、毒鱼及拖网捕捞珊瑚礁鱼类的行为(Arai,2015)。其他的人为活动,如踩挖活动、污染物排放、沉积物威胁等也是影响珊瑚礁鱼类生长的重要因素。
4 结论
近20年来,南海四带笛鲷体长结构逐渐缩小;其异速生长因子存在年际变化和季节波动,但基本在2.5—3.5范围内,体长范围及集中程度的差异是导致b值波动的主要因素;其雌雄比逐年升高,性成熟比例及初次性成熟体长总体不断降低,这可能是其对不断增强的气候变化和人类活动压力的一种适应性选择;其平均摄食强度和肥满度逐渐降低,表明其食物供给不足,生存环境恶化。本研究结果对理解南海珊瑚礁鱼类种群特征演化及对气候变化和人类活动的响应有重要意义。
致谢中国水产科学研究院南海水产研究所江艳娥、蔡研聪、杨玉滔及龚玉艳帮助进行生物学测定,“南锋”号科考船全体船员协助样品采集,谨致谢忱。
