某三甲医院恶性肿瘤患者严重药品不良反应分析*
2020-02-06宁丽娟沈爱宗
宁丽娟,苏 丹,黄 莺,沈爱宗
(中国科学技术大学附属第一医院·安徽省立医院药剂科,安徽 合肥 230001)
恶性肿瘤是一类严重威胁人类健康的疾病,目前已成为我国重大的公共卫生问题[1]。2019年1月,国家癌症中心发布的全国癌症统计数据显示,2015年我国新发恶性肿瘤患者约392.9万例,死亡约233.8万例,发病率和死亡率持续上升[2]。药物治疗已成为肿瘤综合治疗的重要方式,但由于抗肿瘤药物无法精准杀伤肿瘤细胞,常不同程度地损伤机体的正常组织、器官,易导致全身细胞毒性和免疫功能缺损[3],引发不同程度的药品不良反应(ADR),影响抗肿瘤疗效和患者生存质量,甚至导致患者死亡。临床监测严重药品不良反应(SADR),有助于提高患者用药的安全性与有效性,减少药物损害,防止ADR的发生。本研究中分析医院2016年抗肿瘤药物引发SADR的特点,为临床安全用药提供参考。现报道如下。
1 资料与方法
1.1 一般资料
收集医院2016年上报“全国ADR监测网络”的218例SADR病例报告,依据原患疾病,筛选出恶性肿瘤患者SADR报告104例。
1.2 方法
采用回顾性分析法,以第17版《新编药物学》和药品说明书等为参考依据,利用医院信息系统(HIS),对218例SADR报告的患者年龄、性别、药物分类与发生SADR关系、SADR累及器官/系统及主要临床表现等汇总,并采用2010版Excel软件进行分析。
1.3 相关定义
SADR:依据2011年《药品不良反应报告和监测管理办法》(卫生部令第81号)的规定,是指因使用药品引起以下损害情形之一的反应——导致死亡;危及生命;致癌、致畸、致出生缺陷;导致显著的或永久的人体伤残或器官功能损伤;导致住院或住院时间延长;导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的ADR:是指药品说明书中未载明的ADR。说明书中已有描述,但ADR发生的性质、程度、后果或频率与说明书描述不一致或更严重。
新的SADR:是指同时满足新的ADR及SADR。
2 结果
结果见表1至表6。

表1 2016年SADR全部患者和肿瘤患者年龄、性别分布

表2 恶性肿瘤患者SADR累及器官/系统及临床表现

表3 各科室肿瘤患者SADR分布及新的ADR
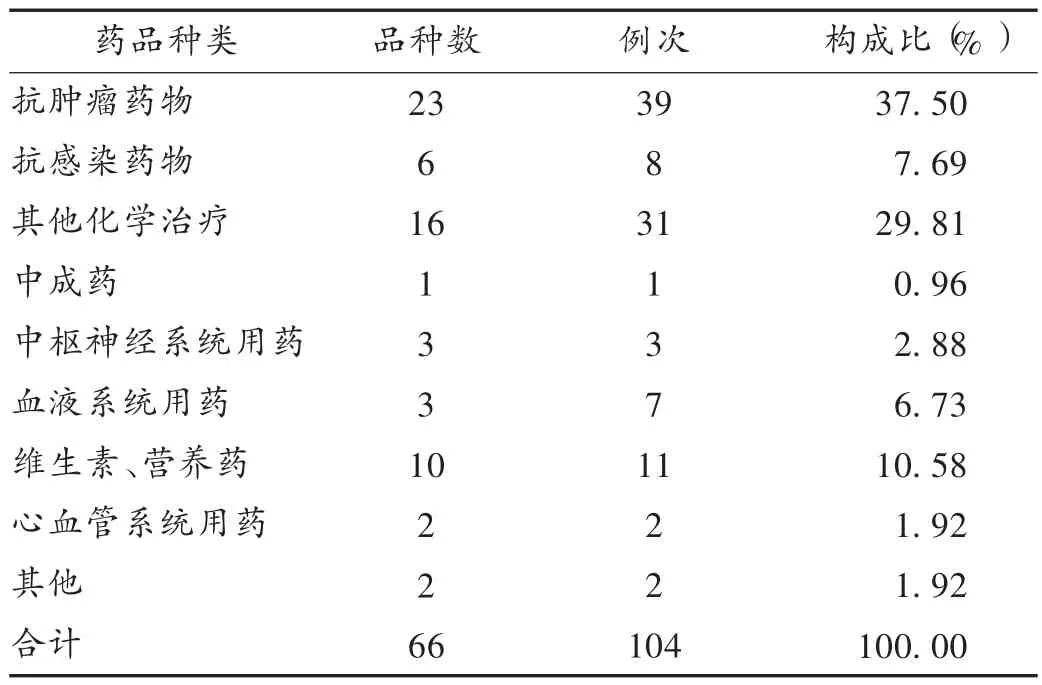
表4 恶性肿瘤患者SADR涉及药品的药理分类
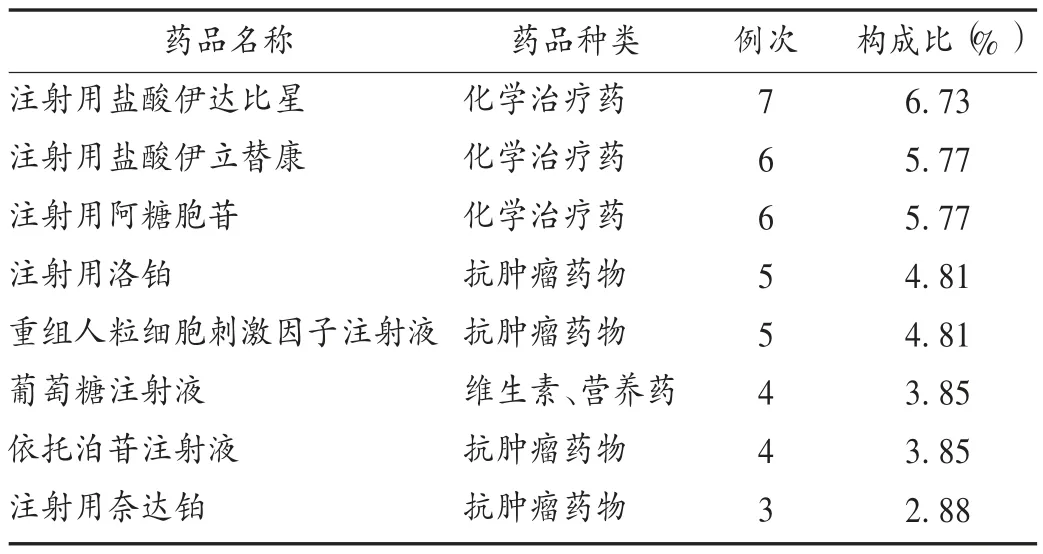
表5 恶性肿瘤患者SADR报告中药品使用率居前8位品种统计
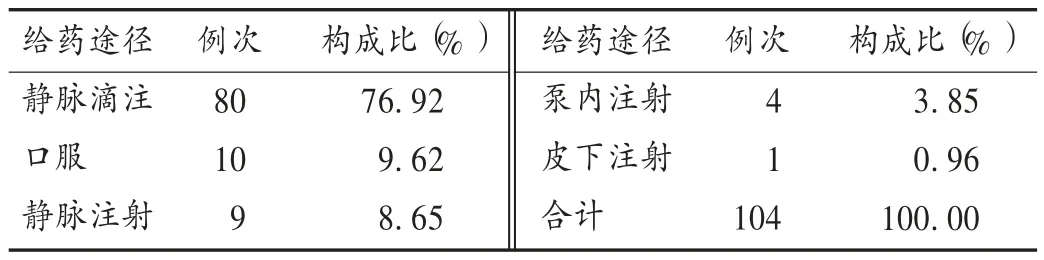
表6 恶性肿瘤患者SADR与给药途径的关系统计
3 讨论
3.1 恶性肿瘤患者SADR报告的基本情况
各科室发生的SADR例数及构成比:根据2016年度发生的SADR统计结果,104例恶性肿瘤患者的SADR发生例数最多的科室为白血病科(28例,26.92%);其次为消化道肿瘤诊疗科(21例,20.19%),日间肿瘤化疗科(13例,12.5%)。恶性肿瘤患者SADR占总的SADR的比例为47.71%,占比较大,一方面可能是由于随着恶性肿瘤患者就诊人数的增加,其药物治疗中的ADR发生率不断增加,另一方面也可能与医务人员加强了ADR上报率有关。
新的SADR报告情况:104份恶性肿瘤患者的SADR报告中,新的SADR报告15份(14.42%),涉及药品12例,其中重组人粒细胞刺激因子注射液3例,注射用盐酸伊达比星2例,酒石酸唑吡坦片、注射用奥沙利铂、替吉奥胶囊、依诺肝素钠注射液、中/长链脂肪乳注射液(C6-24)、ω-3鱼油脂肪乳注射液、注射用伏立康唑、盐酸多巴胺注射液、利妥昔单抗注射液、注射用阿糖胞苷各1例。发生的主要ADR临床表现有,多汗5例,心悸4例,低血容量性休克3例,高血压2例等。另外,还有1例为酒石酸唑吡坦片所致意识水平减低,呼吸急促,1例为注射用伏立康唑所致烦躁,1例为盐酸多巴胺注射液所致频发阵发性室性心动过速,腹痛。临床医师和药师应加强监测上述药品引起的SADR。
3.2 恶性肿瘤患者SADR的一般情况及临床表现
本研究调查结果发现,218例SADR中恶性肿瘤患者104例(47.71%),位居第一,且以血液科、肿瘤科上报量较多,可能与这2个科室的肿瘤患者基数较大、抗肿瘤药物使用率高有关。由SADR患者性别与年龄分布可见,男性多于女性;40~79岁的中老年人发生率较高,其中,60~69岁年龄段占25.96%,位居首位。老年患者发生ADR相对较多,分析原因可能为:老年患者的生理功能的自然衰退,血浆蛋白水平降低,药物代谢率下降,药物在体内的吸收、分布、代谢和排泄均受影响等因素[4];老年患者常同时伴有高血压、糖尿病、冠心病等慢性疾病,多病同治和多重用药概率较高,大大增加ADR发生率。据报道,在对老年患者ADR的防范评价中发现,77.5%的剂量相关ADR是可避免的[5]。因此,提高老年患者ADR的防范意识,加强处方合理性管理,重视药物监测和患者依从性,有利于降低ADR的发生率。
肿瘤患者SADR累及器官/系统以血液系统最多,其中最常见的为骨髓抑制,可能与多数抗肿瘤药可不同程度损伤骨髓造血干细胞,引起骨髓抑制有关[6],同时血小板减少和粒细胞缺乏表现也较多。其次为消化系统,临床以呕吐、恶心最常见,这可能是由于肿瘤患者接受治疗时,化疗药物会影响骨髓造血干细胞、消化道黏膜、皮肤及其附件等器官或组织的细胞生长,抑制其肝肾功能、胃肠功能和免疫功能等[7],进而引起相应的ADR。本研究结果显示,全身性损害的SADR构成比也较高,主要表现为发热、休克等,临床医务人员应加强此类ADR的监护。临床药师也必须担任起合理用药教育的责任,做好SADR的宣教工作。
3.3 恶性肿瘤患者SADR用药情况及用药建议
从104例恶性肿瘤患者SADR的报告数据分析得出,抗肿瘤药物居第1位,其中以注射用盐酸伊达比星使用最多,然后是注射用盐酸伊立替康、注射用阿糖胞苷、注射用洛铂,且三者例次相当。在引起104例SADR的抗肿瘤药物中,涉及铂类药物的品种数最多,包括奥沙利铂、奈达铂、洛铂和卡铂等。另外,植物来源的抗肿瘤药物及其衍生物如紫杉醇也发现了SADR。上述这些抗肿瘤药物多为全身作用,治疗窗较窄,个体差异会影响药物的治疗结局,增加SADR的发生率[8]。因此,加强对不同肿瘤患者进行药物敏感性的检测,使用敏感性高的药物治疗,从而提高药物的疗效,降低ADR发生率。
目前,各种新型肿瘤分子靶向及免疫治疗药物已逐渐应用于临床[9],药物基因组学在肿瘤治疗中的研究也进展迅速[10],抗肿瘤药物的使用更精准,能在最大限度保护机体正常细胞的同时,选择性地杀死肿瘤细胞,减少ADR的发生。由于受到医院药品采购目录限制,本研究中未能涉及新型抗肿瘤药物,望在今后研究中加强对该类药物的监测,确保临床治疗的合理、有效。
综上所述,抗肿瘤药物引起的SADR与年龄、剂型、给药途径相关,需充分发挥专科临床药师的作用,集中监测抗肿瘤药物引起的ADR报告,结合恶性肿瘤患者的自身特点,有目的地进行合理给药,预防或减少SADR的发生。
