枸杞-黄精化学成分分析及颗粒制剂工艺的研究
2020-02-04王结鑫丁艳王倩褚海清赵雨张立明
王结鑫 丁艳 王倩 褚海清 赵雨 张立明
【摘 要】 目的:測定枸杞-黄精多糖类、黄酮类化学成分,优化枸杞-黄精颗粒制剂工艺。方法:采用HPLC确定枸杞-黄精多糖类成分与黄酮类成分,多糖类成分色谱柱为安捷伦XDB-C18(4.6mm×250mm,5μm),以磷酸盐缓冲液(pH 6.8 )(A)-乙腈(B)为流动相,等度洗脱,流速为1mL·min-1,检测波长:250nm,柱温为30℃;黄铜类成分色谱柱为安捷伦XDB-C18(4.6mm×250mm,5μm),流动相为乙腈∶水∶冰乙酸=5∶94.5∶0.5(A)和乙腈∶水∶冰乙酸=70∶29.5∶0.5(B);梯度洗脱,流速为1mL·min-1,检测波长:254nm,柱温为30℃,确定枸杞-黄精中的抗糖尿病生物活性的成分多糖、黄酮。以颗粒剂性状、成型率、溶化性、吸湿率为评价指标,对枸杞-黄精组方中填充剂、润湿剂、抗黏性辅料、抗吸湿性辅料进行考察筛选,确定枸杞-黄精颗粒制剂最优制剂工艺。结果:枸杞-黄精中含有葡萄糖、甘露糖及芦丁等抗糖尿病的活性成份;颗粒制剂工艺得到枸杞-黄精干膏粉与微晶纤维素的最佳比例为2∶1;确定润湿剂为3% PVP K30醇溶液(70% ),用量为40%。筛选抗黏性辅料最佳用量为滑石粉1%,硬脂酸镁0.75%;抗吸湿性辅料最佳用量为甘露醇9%,硫酸钙6%。经本工艺制成的颗粒制剂,取三批次检查水分、装量差异、粒度和溶化性,均符合要求。结论:化学成分中含有抗糖尿病生物活性成分,枸杞-黄精颗粒制剂工艺稳定可行。
【关键词】 枸杞;黄精;化学成分;颗粒剂;制剂工艺
【中图分类号】R284 【文献标志码】 A【文章编号】1007-8517(2020)23-0024-08
Study on Chemical Constituents and Granule Preparation Technology of Lycium barbarum-Huangjing
WANG Jiexin1 DING Yan1 WANG Qian1 ZHANG Liming1,2,3*
1.College of Pharmacy,Ningxia Medical University,Yinchuan 750004,China;2.Ningxia Engineering and Technology Research Center for Modernization of Hui Medicine,Yinchuan 750004,China;3.Key Laboratory of Hui Ethnic Medicine Modernization, Ministry of Education(Ningxia Medical University),Yinchuan 750004,China
Abstract:Objective The chemical constituents of Lycium barbarum-Huangjing polysaccharide and flavonoids were determined, optimization of granular preparation of Lycium barbarum-Huangjing formation. Methods HPLC was used to determine the components of Lycium barbarum - huangjing polysaccharide and flavonoids,the chromatographic conditions of polysaccharides are as follows: the analysis was carried out on a Agilent XDB - C18column (4.6mm×250mm,5μm) ,with the phosphate buffer (pH 6.8) (A) -acetonitrile (B) was used as the mobile phase for isocratic elution,and the flow rate was 1.0 mL·min-1,and the detectionwavelength was set at 250 nm, the column temperature was set at 30 ℃.The conditions of flavonoids chromatography were as follows:Agilent XDB - C18 column (4.6mm×250mm,5μm),The mobile phase was acetonitrile: water: glacial acetic acid = 5∶94.5∶0.5 (A) and acetonitrile: water: glacial acetic acid = 70∶29.5∶0.5 (B) for gradient elute,and the flow rate was 1.0mL·min-1,and the detectionwavelength was set at 250 nm, the column temperature was set at 30 ℃.To determine the components of polysaccharides and flavones in the anti - diabetic bioactivity of Lycium barbarum – huangjing.Taking granule granulation, particle forming rate, particle dissolution and particle moisture absorption rate as the evaluation index, the filler, wetting agent, anti-viscosity excipient and anti-hygroscopic excipient in Lycium barbarum-Huangjing prescription were investigated and screened to determine the optimal preparation process of Lycium barbarum-Huangjing granule preparation and to check whether it met the requirements of pharmacopoeia.Results Lycium barbarum - HuangJing contains anti-diabetic active ingredients such as glucose, mannose sugar and rutin;Get the best ratio of medlar-yellow essence dry paste powder to microcrystalline cellulose is 2∶1; determine the wetting agent is 3% PVP K30 alcohol solution (70%), the dosage is 40%. The optimum dosage of anti-viscous excipient was 1% talc powder ,0.75% magnesium stearate ,9% mannitol and 6% calcium sulfate. The granule preparation made by this process, take three batches to check the moisture content, loading quantity difference, particle size and solubility, all meet the requirements. Conclusion The chemical components contain anti-diabetic bioactive components, the preparation technology of Lycium barbarum-Huangjing granules is stable and feasible.
Keywords:Lycium Barbarum;Huangjing;Chemical Composition;Granules;Preparation Technology
枸杞-黄精组方在古方中又称二精方、二精丸,来源于《奇效良方卷之二十一·诸虚门》中,具有补精气作用。枸杞具有滋补肝肾、益精明目的功效,黄精具有补精益气等作用,方中枸杞多糖、总黄酮,黄精多糖、总黄酮均具有抗氧化、调节糖代谢活性,对糖尿病具有一定的预防和治疗作用。本课题组前期研究表明枸杞-黄精配伍使用具有很好的降糖作用,且以枸杞-黄精1∶1比例配伍降糖效果最佳[1],故本实验拟通过以HPLC方法分析枸杞-黄精中多糖、黄酮类成分,确定枸杞-黄精中抗糖尿病生物活性的成分。以颗粒剂性状、成型率、溶化性、吸湿率为考察指标,对枸杞-黄精颗粒的制剂工艺进行多指标综合优化,为二精方进一步开发利用提供研究基础。
1.仪器与材料
1.1 实验仪器 高效液相色谱仪 (Agilent 1260);分析天平(梅特勒-托利多);DHG-9075A型电热鼓风干燥箱(上海一恒科学仪器有限公司);循环水式多用真空泵(郑州长城科工贸有限公司);电子计重秤(厦门佰伦斯电子科技有限公司);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);粉碎机(屹立工贸有限公司);玻璃干燥器;HH-4水浴锅(上海力辰邦西科技有限公司)。
1.2 实验材料 枸杞(批号:070101,产地:宁夏,购自宁夏明德饮片厂);黄精(批号:070101,产地:四川,石家庄市柏林药材加工厂);标准品:D-葡萄糖(中国食品药品检定研究院,批号:110833-201506);D-甘露糖(中国食品药品检定研究院,批号:140651-201504);芦丁(中国食品药品检定研究院,批号:100080-200707);聚乙烯比咯烷酮K30(MYM生物科技有限公司);微晶纤维素(北京凤礼精求医药股份有限股份有限公司,批号:K792);硬脂酸镁(上海麦克林生物有限公司,批号:M813581);滑石粉(北京凤礼精求医药股份有限股份有限公司,批号:20180326);甘露醇(上海广诺化学科技有限公司,批号:20180810)。
1.3 实验试剂 乙醇(分析纯,天津市科密欧化学试剂有限公司,批号:20130128);三氯甲烷(分析纯,天津市大茂化学试剂厂,批号:20160709);正丁醇(分析纯,天津市科密欧化学试剂有限公司,批号:201340506);甲醇(分析纯,天津市科密欧化学试剂有限公司,批号:20151120);乙腈(色谱纯,美国 Fisher 公司);甲醇(色谱纯,美国 Fisher 公司);三氟乙酸(分析纯,上海中秦化学试剂有限公司,批号:20170915);1-苯基-3-甲基-5-吡唑啉酮(分析纯,天津市光复精细化工研究所,批号:20100729);娃哈哈水。
2 实验方法
2.1 化学成分分析
2.1.1 HPLC色谱条件 多糖类成分的色谱条件[2-5]:安捷伦XDB-C18(4.6mm×250mm,5μm)色谱柱,磷酸盐缓冲液(pH 6.8 )(A):乙腈(B)=84:16等度洗脱;流速为1mL·min-1,检测波长:250nm,柱温为30℃,进样量为10 μL。
黄酮类成分的色谱条件[6-9]:安捷伦XDB-C18(4.6mm×250mm,5μm)色谱柱,流动相为乙腈∶水∶冰乙酸=5∶94.5∶0.5(A)和乙腈∶水∶冰乙酸=70∶29.5∶0.5(B);梯度洗脱条件:0~14min:100%~86%(A);14~22min:86%~84%(A);22~40min:84%~70%(A);40~60min:70%~100%(A);流速为1mL·min-1,检测波长:254nm,柱温为30℃,进样量为10μL。
2.1.2 供试品溶液制备 将枸杞与黄精分别按照1∶1的比例混合,加入75%的乙醇,70℃回流提取1.5h,过滤,回流提取2次,合并滤液,即得醇提取液[10]。将醇提液浓缩并醇沉(使醇含量达到80%左右),静置过夜,过滤,沉淀用80%乙醇润洗多次,干燥后得到粗多糖,将粗多糖加水溶解,加入氯仿-正丁醇(4∶1)混合溶液脱蛋白,剧烈振荡后3000r/min 离心10min,得上清液,在上清液中加入无水乙醇(使醇含量达80%左右),静置过夜后过滤,所得沉淀依次用 95%乙醇、无水乙醇、丙酮、乙醚洗涤,烘干得精制多糖[11]。取药物多糖10mg,精密称定置试管中,加三氟乙酸2mL,使溶解密封,于100℃ 烘箱中水解8h,吹干,殘渣加甲醇1mL,使溶解,吹干,重复3次,加水 2mL使溶解,即得药物多糖水解液。在水解液中加 1.2mL的1-苯基-3-甲基-5-吡唑啉酮(PMP) 甲醇溶液,1mL 0.3mol·L-1的氢氧化钠溶液,混匀,置70℃ 水浴加热 30min,取出,冷却至室温,加0.3mol·L-1盐酸溶液调节pH至中性,混匀,用等体积三氯甲烷萃取3次,取水层,针筒式微孔滤膜过滤,滤液作为多糖的供试品溶液[3-5]。
将枸杞与黄精提取,石油醚脱脂,残渣加入80%乙醇,60℃超声两次,每次30min,滤过,合并滤液,减压浓缩,浓缩液经HPD-600型大孔树脂,蒸馏水除去水溶性杂质后,50%乙醇洗脱,收集乙醇洗脱液,针筒式微孔滤膜过滤,滤液作为黄酮的供试品溶液[12-13]。
2.1.3 标准品溶液制备 精密称取葡萄糖、甘露糖分别置于试管中,分别加入5mL 0.3mol·L-1的NaOH溶液,振荡溶解,取溶解后的溶液100μL,加入0.5mol·L-1的PMP甲醇溶液50μL,70℃水浴中反应30min后冷却至室温,加0.3mol·L-1的盐酸100μL中和,混匀,用等体积三氯甲烷萃取3次,取水层,针筒式微孔滤膜过滤,滤液作为多糖类成分对照品溶液。
精密称取芦丁,置于10 mL容量瓶中,加乙醇溶解并定容至10mL。色谱分析时,对照品溶液过针筒式微孔滤膜,续滤液即为黄酮类成分对照品溶液。
2.2 干膏粉的制备[14] 将枸杞-黄精(1∶1)药材进行粉碎,过20目筛。将药粉回流提取3次,每次1h,料液比均为1∶10,过滤,合并3次滤液,滤液减压浓缩至一定浓度,加入4%微晶纤维素(MCC)混匀,置于烘箱中烘干后进行粉碎,过5号筛,得干膏粉。
2.3 制剂工艺参数考察 采用湿法制粒法。在湿法制粒中,填充剂和黏合剂对颗粒质量有较大影响,故以制粒情况(捏之成团,触之即散)、成型率、吸湿率、溶化性为参考指标,选择辅料,对制粒工艺进行考察。
2.3.1 填充剂 将微晶纤维素作为填充剂,以制粒情况、成型率、吸湿率和溶化性为指标筛选干膏粉与微晶纤维素最佳比例。
2.3.2 润湿剂的选择 本实验分别以纯化水、乙醇水溶液(70%)、3% PVP K30 醇溶液(70% ) 为润湿剂制粒,以制粒情况和颗粒成型率为指标筛选润湿剂。
2.3.3 润湿剂中乙醇浓度的考察 本实验按干膏粉和辅料的量加入40%的不同浓度乙醇(60%、70%、80%)配置的3%PVP K30 醇溶液,揉捏后快速过筛制粒,将湿颗粒于60℃干燥后整粒。以制粒情况、颗粒成型率为评价指标。
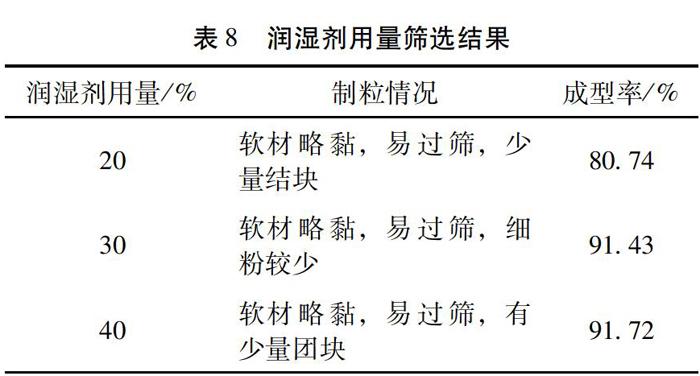
2.3.4 润湿剂用量的考察 按药粉与微晶纤维素2∶1称取3份混合药粉,按总量10%、20%、30%的量添加润湿剂,揉捏后快速过筛制粒,所得湿颗粒于60℃烘干后整粒。以制粒情况、颗粒成型率为评价指标。
2.4 颗粒处方优化 根据上述实验制粒情况,发现在制粒过程中,软材略黏筛,影响颗粒的成型率;枸杞与黄精中含有大量多糖类成分,且多糖类成分易吸湿。因此,对颗粒方进行优化,添加抗黏性与抗吸湿性辅料,从而提高颗粒成型率,改善颗粒稳定性。
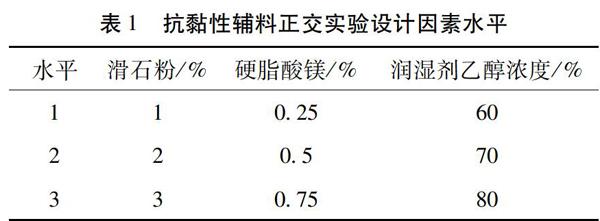
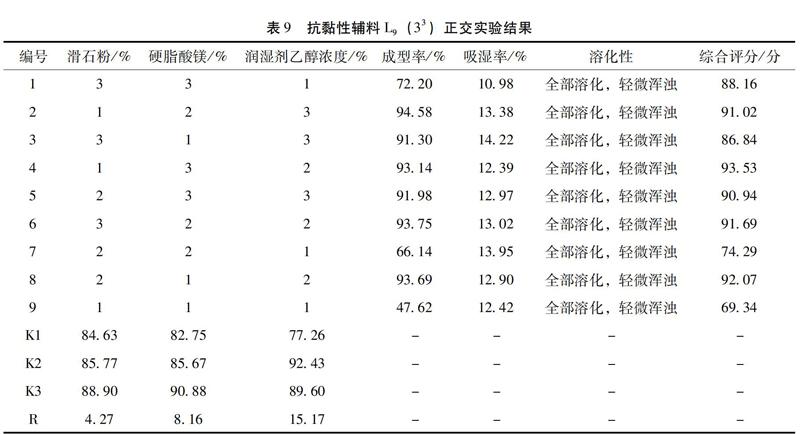
2.4.1 抗黏性辅料筛选[15] 颗粒的黏性较强,故需加入抗黏性辅料以改善其黏性,从而提高颗粒质量。在处方工艺初步筛选的基础上,固定微晶纤维素用量,选择滑石粉、硬脂酸镁为抗黏性辅料,设计正交实验表;以成型率、吸湿率、溶化性为指标,筛选抗黏性辅料。
取适量干膏粉,按照表1的设计方案,将原料与辅料混合均匀制备颗粒,分别测定颗粒成型率、吸湿率、溶化性,计算综合评分。
综合评分=(最小吸湿率值/吸湿率值) ×50 + (成型率值/最大成型率值) ×50。
2.4.2 抗吸湿性辅料的筛选[16-17] 颗粒的吸湿性较强,故需加入抗吸湿性辅料以改善其吸湿性,从而提高颗粒质量。在处方工艺初步筛选的基础上,固定微晶纤维素用量,选择甘露醇、硫酸钙为抗吸湿性辅料,以成型率、吸湿率、溶化性为指标,设计正交实验,具体见表2,筛选抗吸湿性辅料。
取适量干膏粉,按照下方表2的设计方案,将原料与辅料混合均匀制备颗粒,分别测定颗粒成型率、吸湿率、溶化性,计算综合评分。
综合评分=(最小吸湿率值/吸湿率值) ×50 + (成型率值/最大成型率值) ×50。
2.5 检查 照《中国药典(2015版,第四部)》中有关颗粒剂质量评价规定,对所得枸杞-黄精颗粒进行水分、粒度、装量差异、溶化性进行检查[18]。
3 实验结果
3.1 化学成分分析
3.1.1 枸杞-黄精中多糖类化学成分分析 根据“2.1.2”项下“供试品溶液制备”制备枸杞-黄精的多糖類成分供试品溶液,进行HPLC检测,以“2.1.3”项下“标准品溶液制备”葡萄糖、甘露糖的标准品溶液,进行HPLC检测,按照“2.1.1”项下的色谱条件进行HPLC检测。认为供试品溶液中具有相同保留时间的色谱峰为共有峰。精密吸取供试品溶液10μL,注入HPLC色谱仪,记录HPLC色谱图,生成枸杞-黄精多糖、葡萄糖、甘露糖图谱,S1-S3分别代表枸杞-黄精(1∶1)多糖、葡萄糖、甘露糖。比较供试品多糖类成分与标准品蒲萄萄、甘露糖图谱,发现多糖类成分中含有葡萄糖、甘露糖。如图1所示。
3.1.2 中黄酮类化学成分分析 根据“2.1.2”项下“供试品溶液制备”制备枸杞-黄精的黄酮类成分供试品溶液,进行HPLC检测,以“2.1.3”项下“标准品溶液制备”芦丁的标准品溶液,进行HPLC检测,按照“2.1.1”项下的色谱条件进行HPLC检测。认为供试品溶液中具有相同保留时间的色谱峰为共有峰。精密吸取供试品溶液10μL,注入HPLC色谱仪,记录HPLC色谱图,生成枸杞-黄精黄酮类成分、标准品芦丁图谱。比较供试品黄酮类成分及标准品芦丁谱图,可以确定供试品黄酮中含有芦丁。如图2所示。
3.2 方法学考察
3.2.1 线性关系考察 以“2.1.3项下”的“标准品溶液制备”方法制备的标准品溶液,精密吸取标准品溶液,用溶解试剂稀释并在容量瓶中定容。葡萄糖标准品的浓度分别为0.17mg/mL、0.84mg/mL、1.67mg/mL、2.51mg/mL、3.34mg/mL、4.18mg/mL;甘露糖标准品的浓度分别为0.19mg/mL、0.95mg/mL、1.90mg/mL、2.85mg/mL、3.80mg/mL、4.75mg/mL;芦丁标准品的浓度为0.16mg/mL、0.32mg/mL、1.60mg/mL、3.20mg/mL、4.80mg/mL、6.40mg/mL、8.00mg/mL。将各个浓度的标准品溶液分别进样。上述各溶液在选定的色谱条件下经HPLC测定后,绘制标准曲线。线性回归方程、R2及线性范围见表3,结果显示标准曲线线性相关系数在0.9996~1.0000 ,表明方法线性关系良好。
3.2.2 精密度实验 取枸杞-黄精多糖类成分、黄酮类成分供试品溶液分别连续进样6次,记录HPLC色谱图,结果见表4。葡萄糖、甘露糖、芦丁对应的色谱峰峰面积(A)的RSD在2.01%~2.72%,保留时间(T)RSD在0.48%~3.36%,符合特征图谱要求,表明仪器精密度良好。
3.2.3 稳定性实验 取枸杞-黄精多糖类成分样品、黄酮类成分供试品溶液,于0、3、6、9、12、24h分别进样,记录HPLC色谱图,结果见表4。葡萄糖、甘露糖、芦丁对应的色谱峰峰面积(A)的RSD在1.07%~2.95%,保留时间(T)RSD在0.04%~2.96%,符合特征图谱要求,表明供试品溶液在24h内稳定。
3.2.4 重复性实验 取枸杞-黄精多糖类成分样品、黄酮类成分样品,分别平行制备多糖类成分供试品、黄酮类成分供试品溶液6份,分别进样,记录HPLC色谱图,结果见表4。葡萄糖、甘露糖、芦丁对应的色谱峰峰面积(A)的RSD在0.01%~3.06%,保留时间(T)RSD在0.0004%~0.98%,符合特征图谱要求,表明方法的重复性良好。
3.2.5 加样回收率实验 精密吸取已测定的供试品溶液1.0mL,置于进样瓶中,精密吸取“2.1.1”项下标准品溶液1.0mL,摇匀,平行制备6份,根据加入标准品的量与测得量计算加样回收率,结果见表4。加样回收率为93.07%~105.11%,RSD为0.009%~0.68%,说明该方法的准确度良好。
3.3 干膏粉与填充剂比例筛选结果 由表5可知,干膏粉与MCC比例为2∶1时成型率最高,故选取干膏粉与微晶纤维素最佳比例为2∶1。
3.4 润湿剂筛选结果 由表6可知,干膏粉与MCC比例为2∶1时,润湿剂为3% PVP K30 醇溶液(70%) 成型率最高,故以3% PVP K30 醇溶液(70%)为润湿剂。
3.5 润湿剂中乙醇浓度筛选结果 由表7可知,干膏粉与MCC比例为2∶1时,润湿剂中乙醇浓度为70% 时成型率最高,故以3% PVP K30 醇溶液(70%)为润湿剂。
3.6 润湿剂用量筛选结果 由表8可知,当干膏粉与MCC比例为2∶[KG-*3/5]1时,润湿剂为3% PVP K30 醇溶液(70%),用量为40% 时成型率最高,故以3% PVP K30 醇溶液(70%),用量为40% 为颗粒润湿剂。
3.7 抗黏性辅料正交实验结果 由表9、表10可知,各因素影响程度依次为 C > B > A,最优工艺为A1B3C2 ,即在原处方(干膏粉与微晶纤维素比例2∶1)基础上,滑石粉用量1%,硬脂酸镁用量0.75%,润湿剂乙醇浓度为70%。
3.8 抗吸湿性辅料筛选结果 由表11、表12可知,各因素影响程度依次为 C > B > A,最优工艺为A3B2C2 ,即在原处方(干膏粉与微晶纤维素比例2∶1,滑石粉用量1%,硬脂酸镁用量0.75%)基础上,甘露醇用量9%,硫酸钙用量6%,润湿剂乙醇浓度为70%。
3.9 检查项下结果 由表13可知,水分小于8%,装量差异在±5%内,粒度和溶化性均符合规定。
4 结论与讨论
枸杞是宁夏道地药材,最早将其作为药用部位记录在《名医别录》[19],其功效是滋补肝肾、益精明目。枸杞中具有多种成分如枸杞多糖、枸杞色素、黄酮类化合物、生物碱等,其中大量研究表明枸杞多糖利用价值相对较高[20]。黄精是运用历史悠久的药食同源药物[21],其具有补气养阴,健脾润肺的功效。本课题组在前期研究中发现,枸杞-黄精多糖提取物对Ⅱ型糖尿病具有降糖作用[1],因此在此次研究中测定了枸杞-黄精中多糖、黄酮类的成分,通过与标准品对比发现,活性成分有葡萄糖、甘露糖以及芦丁。但通过比较标准品与供试品溶液HPLC峰发现,仍有较多峰未确定其成分,后期还需继续对其成分进行深入分析。枸杞-黄精颗粒的制备工艺采用正交设计等方法,对湿法制粒工艺进行考察和优化,筛选出适合枸杞-黄精组方颗粒的制粒工艺,为制剂质量评价及有效期的确定提供可靠的依据。
中药颗粒制剂主要是在汤剂和糖浆剂的基础上发展的中药剂型,相对于传统汤剂来说,具有方便服用、便于携带、易于调配、剂量准确等优点;而相对于片剂来说,颗粒剂的溶解时间短、药物溶出迅速、患者吸收快、患者生物利用度高等优点。本研究采用湿法制粒,该方法在国内应用较早,是一种传统的制粒方法。笔者在大量文献的基础上对枸杞-黄精颗粒的最优成型工艺进行探索,得出其最佳制备工艺为:干膏粉与微晶纤维素比例为2∶1,滑石粉用量1%,硬脂酸镁用量0.75%,甘露醇用量9%,硫酸钙用量6%,润湿剂为3% PVP K30醇溶液(70%),用量为40%。通过对颗粒剂的有关检查,均符合规定,证明该制备工艺稳定可行。
参考文献
[1]王渊学.二精方多糖提取物质量标准及对实验性Ⅱ型糖尿病小鼠血糖、血脂的影响[D].银川:宁夏医科大学,2015.
[2]倪青. 精准医学背景下的糖尿病中医药防治思路[J]. 医学研究杂志, 2018,47(2):1-4,12.
[3]杨秋香. 当归多糖对2型糖尿病预防及治疗作用的初步研究[D]. 武汉:华中科技大学, 2013.
[4]KANAGASABAPATHY G, KUPPUSAMY U R, ABD MALEK S N, et al. Glucan-rich polysaccharides from Pleurotussajor-caju(Fr.) Singer prevents glucose intolerance, insulin resistance andinflammation in C57BL/6J mice fed a high-fat diet[J]. BMC Complementary and Alternative Medicine, 2012 (12), 261.
[5]熊雄, 王懿萍, 王岳峰, 等. 黃连多糖的降血糖活性研究[J]. 时珍国医国药, 2013,24(10):2351-2353.
[6]赵文竹. 玉米须功能因子活性评价及其降血糖机理研究[D]. 长春:吉林大学, 2014.
[7]GUO Y, LI, LI J, et al. Anti-hyperglycemic activity of polysac-charides from calyx of Physalis alkekengi var.franchetii Makinoon alloxan-induced mice[J]. Int J Biol Macromol, 2017,24(99):249.
[8]侯红瑞, 陈玲, 孙国勇, 等. 知母多糖对链脲佐菌素诱导糖尿病大鼠的降血糖作用[J]. 食品工业科技, 2018,39(12):69-72,78.
[9]ZHANG Y, REN C, LU G, et al. Anti-diabeticeffect of mulberry leaf polysaccharide by inhibiting pancreatic islet cellapoptosis and ameliorating insulin secretory capacity in diabetic rats[J]. International Immunopharmacology, 2014,(1): 248–257.
[10]XU L,YANG J. Anti-diabetic effectmediated by Ramulus mori- polysaccharides[J]. Carbohydrate Polymers, 2015(117): 63–69.
[11] ZHAO Y, YANG X, REN D, et al. Preventive effects of jujube polysaccharides on fructose- induced insulin resistance and dyslipidemia in mice[J]. Food Funct, 2014,5(8):1771- 1778.
[12]WU C Y, WANG H, HE X X, et al. The hypoglycemic and antioxidant effects of polysaccharides from the petioles and pedicels of Euryale ferox Salisb on alloxan- induced Hyperglycemic mice[J]. Food Funct, 2017,8(10):3803-3813.
[13]CAO C L, HUANG Q, ZHANG B, et al. Physicochemical characterization and in vitro hypoglycemic activities of polysaccharides from Sargassum pallidum by microwave-assistedaqueous two-phase extraction[J]. International Journal of Biological Macromolecules, 2018 (109) :357–368.
[14]付亭亭,韓天燕,左文宝,等.黑果枸杞颗粒成型工艺研究[J].中国新药杂志, 2018,27(13):1560-1564.
[15]李范珠,李永吉.中药药剂学[M].北京:人民卫生出版社,2012:183-187.
[16]左文宝,王荣,杨建宏,等.补青颗粒成型工艺优化[J].中成药, 2018,40(8):1737-1740.
[17]李琦.小儿饮舒颗粒的制备工艺及质量标准研究[D].北京:北京中医药大学, 2018.
[18]国家药典委员会.中华人民共和国药典(四部)[S].北京:中国医药科技出版社, 2015:104.
[19]李静,余意,张小波,等.药用枸杞本草考证[J].世界中医药,2019,14(10):2593-2597.
[20]杨涵雨,袁以凯,付开聪.哈尼族药食同源植物黄精的利用价值与栽培要点[C].//云南省科学技术协会、中共楚雄州委、楚雄州人民政府.第八届云南省科协学术年会论文集——专题二:农业.云南省科学技术协会、中共楚雄州委、楚雄州人民政府:云南省机械工程学会,2018:381-384.
[21]朱彩平.枸杞多糖的结构分析及生物活性评价[D].武汉:华中农业大学,2006.
(收稿日期:2020-07-20 编辑:程鹏飞)
基金项目:国家自然基金项目,项目编号:81760839;国家级大创项目,项目编号:201810752004。
作者简介:王结鑫(1995-),女,汉族,硕士研究生在读,研究方向为天然药物与中药活性物质研究及开发利用。E-mail:wangjiexin69@163.com
通信作者:张立明(1971-),汉族,硕士,教授,硕士生导师,研究方向为天然药物的研究。E-mail: nyzlm@163.com
