环状RNA hsa_circ_0050900在乳腺癌中的表达及其对细胞生物学行为影响的机制研究
2020-02-04
重庆医科大学细胞生物学与遗传学教研室,重庆400016
早期的乳腺癌可以通过手术、化疗或放疗等改善患者的生活质量,但仍有20%~30%的女性患者复发[1]。目前国际通用的乳腺癌分类标准可将乳腺癌分为Luminal A型、Luminal B型、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性型、三阴性乳腺癌(triple-negative breast cancer,TNBC)及其他特殊类型乳腺癌[2]。与线性RNA不同的是,环状RNA(circular RNA,circRNA)呈闭合环状结构,且属一类特殊的非编码RNA,所以具有序列保守性和组织特异性且不易被核酸外切酶降解[3-6]。研究表明,circ RNA参与多种肿瘤的发生、发展过程[7]。本文探究在乳腺癌组织中hsa_circ_0050900的表达水平以及敲低后对细胞增殖、迁移等生物学行为的影响。
1 材料和方法
1.1 材料
1.1.1 组织标本及细胞系
本研究中的30对乳腺癌组织及癌旁组织保存于重庆医科大学基础医学院分子医学与肿瘤研究中心。所有组织标本均来自于重庆医科大学附属第一医院,且30例患者(均为女性)手术前均签署知情同意书,标本切除后经病理科冰冻切片诊断确认后立刻于液氮中保存。标本和临床信息的收集均得到重庆医科大学伦理委员会批准。乳腺癌细胞MCF-7、SK-BR-3以及正常人乳腺上皮细胞MCF-10A保存在重庆医科大学基础医学院分子医学与肿瘤研究中心。
1.1.2 主要试剂
胎牛血清(fetal bovine serum,FBS)购自重庆比欧赛因生物科技有限公司,DMEM、RPMI-1640培养基购自美国Gibco公司,MEBM培养基套装购自瑞士LONZA公司,si-circ(sihsa_circ_0050900)以及siRNA(siRNA-negative control,si-NC)质粒设计与合成由广州吉赛生物科技股份有限公司完成,胰蛋白酶购自重庆鼎国生物技术有限责任公司,转染试剂LipofectamineTM2000购自重庆茂百生物科技有限公司,TRIzol、PrimeScript RT Reagent Kit和TB Green购自宝生物工程(大连)有限公司,实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQPCR)引物由重庆茂百生物科技有限公司设计与合成,Cell-LightTMEdU Apollo567体外试剂盒购自广州锐博生物科技有限公司,TUNEL一步法测凋亡试剂盒购自上海碧云天生物技术有限公司,transwell小室购自重庆比欧赛因生物科技有限公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自武汉博士德生物工程有限公司,SDS-PAGE配胶试剂盒购自生工生物工程(上海)股份有限公司,抗细胞周期蛋白D2(cyclin D2,CCND2)抗体以及抗CDK4抗体购自美国CST公司。
1.2 方法
1.2.1 RNA测序
选取4对乳腺癌组织和癌旁组织,其提取总RNA检测浓度与纯度,RNase R消化线性RNA,琼脂糖凝胶电泳检测RNA完整性,质检合格进行测序实验。根据上海康成生物科技有限公司提供的测序结果,筛选出乳腺癌组织和癌旁组织中表达差异最显著的circRNA hsa_circ_0050900。
1.2.2 细胞培养与转染
乳腺癌细胞系MCF-7、SK-BR-3以及人乳腺上皮细胞系MCF-10A分别在含有10%FBS的DMEM、RPMI-1640及MEBM培养基中培养,3种细胞系均在37 ℃、CO2体积分数为5%的条件下培养,每隔24~48 h更换新培养基。待细胞在低倍镜下观察密度达到60%~70%时,改用无血清培养基饥饿细胞2 h,使用LipofectamineTM2000分别将si-circ和si-NC转染至MCF-7和SK-BR-3细胞中,待24~36 h后收获细胞。
1.2.3 RTFQ-PCR检测
转染24~36 h后,采用TRIzol法提取乳腺癌细胞MCF-7、SK-BR-3、正常人上皮乳腺细胞系MCF-10A的总RNA,DEPC水溶解RNA沉淀,并混匀,酶标仪检测提取RNA浓度与纯度。将提取的总RNA按照20 μL体系反转录成cDNA,反应在37 ℃ 15 min、85 ℃ 5 s的条件下进行。使用美国Bio-Rad公司的RTFQ-PCR仪检测乳腺癌细胞和乳腺癌及其癌旁组织中circRNA hsa_circ_0050900的表达水平。该检测所用的GAPDH上游引物序列为5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物序列为5’-GAAGATGGTGATGGGA TTTC-3’;hsa_circ_0050900上游引物序列为5’-AAGGACGACCCTGTCACCAA-3’,下游序列引物为5’-CCGTGAAGGTCCTCTGC AT-3’。反应条件为94 ℃预变性3 min,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,以cDNA作为模板,GAPDH作为内参,双蒸水补齐至30 μL体系,共40个循环。每个样品设置3个复孔,运用2-△△Ct法计算hsa_circ_0050900在组织和细胞中的表达量。
1.2.4 CCK-8实验检测细胞增殖
质粒转染36 h后,运用美国Bio-Rad公司细胞计数仪和细胞计数板对细胞进行计数,将各组细胞配制成密度为2×103个/mL的细胞悬液,将细胞铺到5块96孔板中,每组3个复孔。在37 ℃、CO2体积分数为5%的培养箱中培养,每天同一时间在孔板中滴加CCK-8溶液,37 ℃温育2 h,用酶标仪检测波长为450 nm的吸光度(D)值,连续检测5 d。将D值绘制成曲线。
1.2.5 EdU实验检测细胞增殖
质粒转染36 h后,将细胞从6孔板接种到带有爬片的24孔板上,在4%多聚甲醛固定30 min,0.5%TritonX-100溶液通透10 min的条件下,根据Cell-LightTMEdU Apollo567体外试剂盒说明书对细胞核进行染色,在荧光显微镜下随机挑选3个视野进行取像和计数。
1.2.6 划痕实验检测细胞迁移
细胞转染36 h后,使用200 μL吸嘴在6孔板内进行划痕,更换无血清培养基,置于倒置显微镜下拍摄0 h划痕距离,随后将6孔板放置于37 ℃、CO2体积分数为5%的培养箱中培养24 h,再置于显微镜下拍摄24 h划痕距离,通过计算出的迁移率表示细胞的相对迁移能力。
1.2.7 TUNEL一步法实验检测细胞凋亡
细胞转染24 h后,将细胞均匀铺于带有爬片的24孔板中,细胞贴壁后,用4%多聚甲醛溶液固定30 min,0.5%TritonX-100溶液通透10 min,每孔加入100 μL TUNEL检测溶液,37 ℃温育1 h,滴加抗淬灭剂封片,荧光显微镜下随机选取3个视野拍照。
1.2.8 Hoechst 33342染色实验检测细胞凋亡
细胞转染36 h后,将细胞接种于带有爬片的24孔板,用4%多聚甲醛溶液固定30 min,PBS清洗3次,每次5 min,0.5%TritonX-100溶液通透10 min,PBS清洗3次,每次5 min,经Hoechst 33342染液染色30 min,滴加抗淬灭剂,封片,荧光显微镜下随机选取3个视野拍照。
1.2.9 Transwell小室实验检测细胞迁移
将200 μL无血清的细胞悬液接种于transwell小室的上室面,下室加入500 μL含有10%FBS的DMEM、RPMI-1640培养基,随后将带有小室的24孔板水平放置于37 ℃、CO2体积分数为5%的培养箱中培养24 h,用棉签轻轻擦去基质胶和上室的细胞,用4%多聚甲醛溶液固定30 min,弃掉甲醛,PBS清洗2遍,结晶紫染色15 min,干燥后镜下随机取视野拍照计数。
1.2.10 蛋白质印迹法(Western blot)检测
用细胞刮收集转染36 h后的各组乳腺癌细胞,加入RIPA裂解液提取各组细胞总蛋白,冰上裂解30 min,每隔5 min涡旋1次。采用BCA蛋白浓度试剂盒测定蛋白浓度,100 ℃金属浴10 min。每孔按30 μg蛋白进行上样,通过恒压80 v电泳分离30 min,120 v电泳分离60 min,冰浴恒流200 mA转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用蛋白封闭液在摇床上封闭2 h,4 ℃温育一抗(兔抗GAPDH抗体1∶5 000,兔抗CCND2抗体1∶1 000,兔抗CDK4抗体1∶1 000)过夜,37 ℃温育二抗(羊抗兔抗体1∶5 000)2 h,化学发光显色,用美国Bio-Rad公司凝胶成像仪拍照,并用Image Lab分析成像条带。
2 结果
2.1 hsa_circ_0050900在乳腺癌组织和乳腺癌细胞系中的表达
根据高通量测序对4对乳腺癌组织和癌旁组织的测序结果,挑选出在乳腺癌组织中上调倍数最高的circRNA hsa_circ_0050900,与癌旁组织相比,其在乳腺癌中表达高出10.07倍(图1A)。采用RTFQ-PCR检测hsa_circ_0050900在30对乳腺癌组织和癌旁组织,乳腺癌细胞系MCF-7、SK-BR-3,以及正常人乳腺上皮细胞MCF-10A中的表达水平。结果显示,无论在乳腺癌组织还是细胞中,hsa_circ_0050900均显著高表达(P<0.001,图1B~C),此结果与测序结果一致。因此选择hsa_circ_0050900进行接下来的功能实验验证。
2.2 hsa_circ_0050900干扰质粒的效率验证
将干扰空载质粒si-NC(5’-TTCTCCGAAC GTGTCACGT-3’)和干扰质粒si-circ(5’-CA GAGGACCTTCACGGCAT-3’)分别转染MCF-7和SK-BR-3细胞,饥饿培养5 h,换完全培养基再培育24 h,采用RTFQ-PCR技术检测两株细胞中hsa_circ_0050900的相对表达量。通过RTFQ-PCR结果,相较于转染si-NC的细胞,hsa_circ_0050900的表达水平在si-circ组显著低表达(图2),表明干扰质粒构建成功。
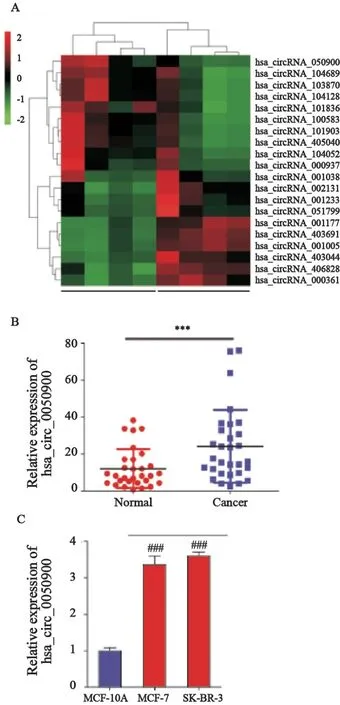
图1 RNA-seq分析显示乳腺癌组织和癌旁组织中部分差异表达的circRNA热图以及hsa_circ_0050900在乳腺癌组织和细胞中的验证Fig.1 Heat map of differentially expressed circRNAs in breast cancer tissues and para-cancerous tissues

图2 采用RTFQ-PCR对质粒转染效率进行验证Fig.2 The transfection efficiency of breast cancer cells was determined by RTFQ-PCR
2.3 敲低hsa_circ_0050900对乳腺癌细胞增殖的影响
将si-NC和si-circ质粒转染MCF-7和SKBR-3细胞,分别通过CCK-8和EdU实验,检测hsa_circ_0050900对细胞增殖能力的影响。CCK-8实验结果显示,MCF-7细胞和SK-BR-3细胞的si-circ组细胞增殖能力都显著低于对照组si-NC(图3A)。通过EdU实验检测结果,实验组si-circ的MCF-7和SK-BR-3细胞,其增殖能力显著低于si-NC组(图3B~C)。
2.4 敲低hsa_circ_0050900对乳腺癌细胞迁移的影响
将si-NC和si-circ质粒转染进MCF-7和SKBR-3细胞,通过细胞划痕实验和transwell小室迁移实验检测细胞迁移能力。细胞划痕实验结果显示,转染si-circ的两株细胞迁移距离显著小于转染si-NC的迁移距离(图4A~B)。Transwell小室迁移实验结果显示,转染si-circ细胞的迁移能力显著低于si-NC组(图4C~D)。
2.5 敲低hsa_circ_0050900调控细胞凋亡相关蛋白的表达
将si-NC和si-circ质粒转染进MCF-7和SKBR-3细胞,采用Western blot检测CCND2、CKD4蛋白的表达水平。结果显示,相较于si-NC组,CCND2、CKD4蛋白的表达水平显著降低(图5A、B)。
2.6 敲低hsa_circ_0050900对乳腺癌细胞凋亡的影响
将si-NC和si-circ质粒转染进MCF-7和SK-BR-3细胞,分别通过TUNEL一步法和Hoechst 33342染色实验检测细胞凋亡。Hoechst 33342染色实验结果显示,相较于si-NC组,si-circ组表现出以细胞核碎裂为特征的细胞凋亡更明显(图6A)。TUNEL实验结果显示,si-circ组凋亡率显著高于si-NC组(图6B)。

图4 下调hsa_circ_0050900对乳腺癌细胞迁移能力的影响Fig.4 Effects of downregulation of hsa_circ_0050900 on the migration of breast cancer cells

图5 下调hsa_circ_0050900对乳腺癌细胞蛋白表达的影响Fig.5 Effects of downregulation of hsa_circ_0050900 on protein levels of breast cancer cells

图6 下调hsa_circ_0050900对乳腺癌细胞凋亡的影响Fig.6 Effects of downregulation of hsa_circ_0050900 on apoptosis of breast cancer cells
3 讨 论
近年来,虽然乳腺癌临床诊疗水平不断提高,但其发病率仍居高不下[8-10]。
circRNA主要位于细胞质中,也有部分位于细胞核,表达与结构更稳定。研究结果表明,circRNA参与多种恶性肿瘤的发生、发展过程,进一步的功能探究表明,circRNA通过吸附microRNA作为海绵、诱导血管生成、与RNA结合蛋白相互作用、促进肿瘤免疫逃逸以及促进形成炎症微环境等多种方式参与恶性肿瘤的增殖、侵袭和转移[11]。
本研究使用RNA高通量测序技术,对4对乳腺癌及其癌旁组织进行分析,通过差异表达谱以及RTFQ-PCR技术证实circRNA hsa_circ_0050900相较于癌旁组织,在乳腺癌组织中高度表达,并通过RTFQ-PCR技术进一步证实hsa_circ_0050900在MCF-10A细胞中的表达显著低于MCF-7以及SK-BR-3细胞。之后我们构建针对hsa_circ_0050900的干扰质粒,通过脂质体转染法转染进细胞,进一步进行体外功能实验验证。一系列实验结果表明,下调hsa_circ_0050900之后,细胞的增殖、转移等生物学行为受到抑制。通过TUNEL一步法实验结果显示,下调hsa_circ_0050900,凋亡细胞数明显增多;Hoechst 33342染色实验显示核碎裂细胞增多,提示凋亡细胞增加。最后,通过Western blot实验检测下调hsa_circ_0050900之后,CCND2以及CKD4水平降低。CCND2可以与CDK4形成复合物,共同调控细胞周期。
hsa_circ_0050900的异常表达对细胞增殖、迁移及细胞凋亡均有影响,这些结果表明hsa_circ_0050900在乳腺癌的发生、发展中可能发挥重要的作用。
