经验性131I治疗对甲状腺乳头状癌不摄碘肺转移患者价值存疑
2020-02-04慕转转林岩松
慕转转,李 征,张 鑫,林岩松
1.中国医学科学院、北京协和医学院北京协和医院核医学科,北京 100730;
2.核医学分子靶向诊疗北京市重点实验室,北京100730
分化型甲状腺癌(differentiated thyroid cancer,DTC)预后相对良好,但仍有5%~25%的DTC患者可发展为远处转移[1-2],尤以肺转移最为常见,占到远处转移患者的55%~85%[3-4]。131I治疗是DTC伴远处转移患者行甲状腺全切术后的首选治疗方式,大部分摄碘良好的远处转移患者经规范治疗后可长期生存[5],部分肺部微小转移患者经131I治疗后肺部病灶甚至消失,达到完全缓解(complete remission,CR)。然而,仍有约1/3的DTC患者的远处转移病灶并不摄碘,或在多次131I治疗后失去摄碘特性,被称为碘难治性分化型甲状腺癌(radioactive iodine refractory differentiated thyroid cancer,RAIR-DTC)[6]。RAIR-DTC患者的预后差,其10年生存率仅为10%左右,部分进展迅速者生存期仅3~5年[6]。由此RAIR-DTC成为目前本领域的研究重点。其中,对于131I全身显像(whole body scan,WBS)阴性但确有结构性病变存在的患者,经验性131I治疗在其中所发挥的作用仍不明确。有研究发现,部分患者经过经验性131I治疗后血清甲状腺球蛋白(thyroglobulin,Tg)水平下降[7],但其他研究显示经验性131I治疗的杀瘤效果并不理想,并未对患者长期预后有显著改善[8-9]。因此,如何早期识别RAIR-DTC,何时终止131I治疗,何时采取除手术、131I治疗和促甲状腺激素(thyroid-stimulating hormone,TSH)抑制等一线治疗外的其他系统性治疗方式,也成为目前临床上亟待解决的几大难题。本文侧重于甲状腺乳头状癌(papillary thyroid cancer,PTC)伴不摄碘性肺转移患者的131I治疗终止时机,通过比较这部分患者在经验性131I治疗和仅TSH抑制治疗时的血清Tg反应和CT显示的肺部病灶变化情况,以探索经验性131I治疗对于PTC伴不摄碘性肺转移患者的必要性。
1 资料和方法
1.1 一般资料
回顾性分析2008年—2019年就诊于北京协和医院核医学科的45例PTC伴肺转移患者。纳入标准:①曾行甲状腺全切或近全切术;② 病理学诊断为PTC;③经病理学证实或影像学与血清学结合提示的肺转移,不伴其他部位远处转移;④Tg抗体(Tg antibody,TgAb)<115 kU/L;⑤ 术后行TSH抑制治疗(TSH<0.1 mU/L)及至少2次131I治疗;⑥131I治疗后全身显像(post treatment whole body scan,RxWBS)未见肺部摄碘灶或逐渐丧失摄碘功能;⑦ 继续单一TSH抑制治疗下规律随访,有可供分析的数据。
1.2 分组和方法
所有45例PTC伴肺转移灶患者进行自身前后对照。所有患者在清甲成功后再次行131I治疗,后续RxWBS一直未见肺部病灶摄碘或原摄碘病灶失去摄碘功能,则将清甲成功后再次行清灶治疗后RxWBS所示肺部病灶不摄碘对应的131I治疗视为经验性131I治疗,中位治疗剂量为5.55 GBq。经验性131I治疗前最后一次所测抑制性Tg记为Tg1,经验性131I治疗后6~12个月所测抑制性Tg记为Tg2。患者距最后一次131I治疗6个月以上的TSH抑制治疗阶段(仅服用左旋甲状腺素片)视为仅TSH抑制治疗期。期间首次复查视为仅TSH抑制治疗期初,此时的抑制性Tg记为Tg3;最近一次复查视为仅TSH抑制治疗期末,此时的抑制性Tg记为Tg4。若中途应用靶向药物治疗、放化疗等其他治疗措施,则仅TSH抑制治疗期末截止为应用其他治疗前最后一次复查。具体流程见图1。中位随访时长为23.7(4.6~79.8)个月。通过自身前后对照,比较经验性131I治疗前后的抑制性Tg水平(Tg1与Tg2)是否有所改善,并进一步比较经验性131I治疗及仅TSH抑制治疗两阶段的Tg变化速度和影像学变化[CT显示是否出现疾病进展(progressive disease,PD)]是否有差异。抑制性Tg的监测均需满足TSH<0.1 mU/L,TgAb<115 kU/L;Tg变化速度定义为抑制性Tg的上升水平(ng·mL-1·月-1)。影像学变化采用CT扫描,应用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版进行评估:所有测量的靶病灶(直径≥1.0 cm)直径和相对增加至少20%,且满足直径和的绝对值增加至少0.5 cm;或出现一个或多个新病灶,视为疾病PD,否则视为non-PD。观察在仅TSH抑制治疗期间患者的无进展生存期(progression-free survival,PFS)。
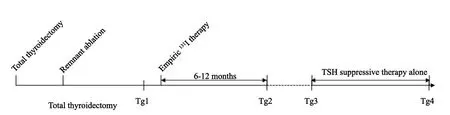
图1 患者治疗流程图Fig.1 Flow-chart of treatment
1.3 统计学处理
采用IBM SPSS 23.0软件分析数据,符合正态分布的定量资料用±s表示,不符合正态分布的定量资料用M(P25,P75)表示;定性资料以频数(百分比)表示。采用配对样本Wilcoxon符号秩和检验比较经验性131I治疗前后的抑制性Tg水平,以及两种治疗阶段下的Tg变化速度;采用配对样本的χ2检验比较两种治疗阶段1年左右的CT变化;采用Kaplan-Meier模型评估患者在仅TSH抑制治疗时的PFS。所有统计学检验以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
45例PTC患者的临床病理学资料见表1。其中女性患者31例(68.9%),男性患者14例(31.1%)。年龄小于55岁患者较55岁及以上者多(82.2% vs 17.8%)。24例(53.3%)患者术后病理学检查报告了病理学亚型,其中经典型13例(28.9%),滤泡亚型3例(6.7%),兼有上述两种亚型者3例(6.7%),实体亚型和高细胞亚型各2例(4.4%),兼有经典型和高细胞两种亚型者1例(2.2%)。38例(84.5%)患者检测了BRAF基因的突变情况,突变者远远高于野生型(66.7% vs 17.8%)。19例(42.2%)患者检测了TERT启动子突变情况,约13.3%的患者检测出TERT突变,28.9%未突变。
2.2 经验性131I治疗和仅TSH抑制治疗前后Tg变化和Tg变化速度
45例PTC患者在经验性131I治疗前中位Tg水平为5.10(2.10,11.78)ng/mL,治疗后中位Tg水平为5.63(3.20,15.53)ng/mL,两者之间差异有统计学意义(P=0.001)。仅TSH抑制治疗期初中位Tg水平为6.20(3.10,16.96)ng/mL,仅TSH抑制治疗期末中位Tg水平为10.70(4.17,29.81)ng/mL,两者之间差异有统计学意义(P=0.003)。经验性131I治疗前后和仅TSH抑制治疗1年左右时的Tg水平变化见图2。进一步分析45例PTC患者在两种治疗阶段的Tg变化速度,发现经验性131I治疗前后中位Tg变化速度为0.07(-0.01,0.23)ng·mL-1·月-1,仅TSH抑制治疗期间中位Tg变化速度为0.03(-0.01,0.50)ng·mL-1·月-1,两者之间未见明显差异(P=0.123)。

表1 45例PTC患者的临床病理学特征Tab.1 Clinicopathologic features of 45 PTC patients
2.3 经验性131I治疗和仅TSH抑制治疗时病灶的影像学变化
45例PTC患者中有31例(68.9%)于经验性131I治疗后在本院定期行CT随访,其中7例(22.6%)在仅TSH抑制治疗1年后出现PD;采用这31例患者在仅TSH抑制治疗期间的CT病灶进展情况估计PFS,发现这部分PTC伴不摄碘性肺转移患者在仅TSH抑制治疗时的中位PFS可达到54.4(46.5,66.2)个月(图3)。进一步追溯经验性131I治疗前后CT结果,有12例可追踪到经验性131I治疗前后1年病灶在CT中所呈现的变化。比较这部分患者经验性131I治疗前后1年及仅TSH抑制治疗时1年的CT变化结果,差异无统计学意义(P=1.000)。

图2 经验性131I治疗前后和仅TSH抑制治疗1年时的抑制性Tg水平变化Fig.2 The suppressed thyroglobulin (Tg) levels before and after empiric 131I therapy,and 1 year after TSH suppressive therapy alone

图3 31例PTC伴不摄碘性肺转移患者在仅TSH抑制治疗时的无进展生存期Fig.3 Progression-free survival (PFS) in 31 PTC patients with non-radioiodine (RAI)-avid pulmonary metastases during TSH suppressive therapy alone
3 讨 论
远处转移灶的摄碘性是这部分患者预后的独立风险因素之一,不摄碘型PTC患者往往预后更差、生存期更短[10-11]。出现此种情况的原因,一方面可能在于不摄碘型PTC更倾向于呈现失分化状态,恶性程度更高;另一方面,131I治疗对于此部分患者治疗效果有限。因此,明确131I 治疗对于不摄碘型PTC患者的必要性,显得尤为重要。对于131I 治疗无效的患者,应及时终止重复的131I 治疗,避免不必要的TSH刺激及辐射暴露。不同于以往研究,为避免剂量过小及残余甲状腺组织对肺部转移灶摄碘性判断的干扰,本研究仅纳入了清甲成功后再次行131I 治疗,且RxWBS仍阴性的患者,中位131I治疗剂量达5.55 GBq。
首先,我们观察了经验性131I 治疗前后Tg水平的变化,发现经验性131I治疗后血清Tg水平相对治疗前明显升高,这也与我们前期研究结果相似[12],初步提示我们经验性131I治疗的非必要性。研究显示,131I在甲状腺癌全切术后患者体内的有效半衰期(effective half-life time,Te)为2~5 d[13]。本文中,我们将距前次131I治疗6个月以上(≥36~90个Teff)且除TSH抑制治疗外无其他干预措施时视为仅TSH抑制治疗期,进一步比较了经验性131I治疗与仅TSH抑制治疗两阶段的血清学和影像学变化,发现血清Tg变化速度和病灶影像学变化均未显示明显差异。更警示我们131I治疗对于已失去摄碘特性的PTC伴远处转移患者的疗效甚微,相对于仅TSH抑制治疗未见明显优势。尤其值得我们注意的是,一部分患者在经验性131I治疗后血清Tg水平较治疗前增高,而在仅TSH抑制治疗期间则呈现下降趋势。对于这部分患者,131I不仅未发挥其治疗效果,反而可能由于治疗前TSH准备导致对病灶的激发作用,以及其他目前尚无法知晓的作用机制,使得肿瘤发展进程加速。既往研究发现,可从经验性131I治疗中获益的人群大多为小剂量诊断性全身显像(diagnostic whole body scan,DxWBS)阴性但大剂量RxWBS阳性的患者[14],而RxWBS阴性的患者几乎无法从131I治疗中获益[9]。且按照2015年美国甲状腺协会(American Thyroid Association,ATA)指南,这部分RxWBS阴性但确有结构性病变存在的患者应视为RAIR-DTC。因此,本研究无疑为再次131I治疗前实时动态评估的必要性提供了证据,尤其应重视前期131I治疗反应,权衡再次131I治疗的获益及风险[15]。在缺乏患者病情客观缓解证据的情况下,经验性131I治疗应及时被终止,不应每间隔6~12个月进行1次131I治疗。而2015年ATA指南也仅对摄碘性较好的肺部微小转移病灶,有望通过131I治疗达到最佳治疗反应(excellent response,ER)的患者做了间隔6~12个月再次131I治疗的推荐[16]。另外,根据RECIST 1.1评估标准,本研究中此部分RAIRDTC患者在仅TSH抑制治疗期间的中位PFS可达到54.4个月,这提示我们TSH抑制治疗在疾病进程中起到的基础性抑制作用不应被忽视。考虑到其他治疗方式如靶向药物、免疫治疗等带来的不良反应以及后续耐药性的产生,需严格把握应用指征,权衡利弊后再决定进一步治疗方案。
综上所述,131I治疗对于不摄碘的PTC肺转移患者疗效有限,并可能加速疾病进展,宜及时终止经验性131I治疗。对于病情较为稳定的患者,仅TSH抑制治疗下密切监测不失为一定时间段内的一项重要诊治措施。
